Lancet 子刊 | 利妥昔单抗是否会影响非霍奇金淋巴瘤患儿的免疫功能?
时间:2023-07-02 19:02:05 热度:37.1℃ 作者:网络
成熟B细胞淋巴瘤是儿童非霍奇金淋巴瘤(NHL)中最常见的病理类型,包括伯基特淋巴瘤和弥漫性大B细胞淋巴瘤等亚型。目前CD20单克隆抗体利妥昔是伯基特淋巴瘤和儿童弥漫性大B细胞淋巴瘤的标准治疗方案。国际开放标签随机三期试验Inter-B-NHL-Ritux 2010表明,儿童和青少年高风险、成熟B细胞NHL患者在化疗的基础上加用利妥昔单抗可明显提高生存率,3年无事件生存率可达93.9% 。然而,该研究亦显示相较于仅接受化疗患者,联合利妥昔单抗的患者发生严重中性粒细胞缺乏伴发热和严重感染的机率更高。
利妥昔单抗能快速清除外周血中的CD20+ B细胞,但需要较长时间恢复B细胞,也会出现药物引起的低丙种球蛋白血症(hypogammaglobulinaemia)。丙种球蛋白作为体液免疫的重要组成部分,低丙种球蛋白血症会增加细菌感染风险。免疫系统的发育和构成又与年龄相关,相较于成人患者,儿童患者更常见利妥昔单抗相关的低丙种球蛋白血症。因此,Inter-B-NHL-Ritux 2010试验的研究人员希望进一步评估利妥昔单抗对儿童和青少年,以帮助制定管理策略,应对可能发生的免疫缺陷及感染。
近日,Sarah Alexander 和 Véronique Minard-Colin 的团队在 The Lancet Haematology 发表了题为 Effect of rituximab on immune status in children with mature B-cell non-Hodgkin lymphoma: a prespecified secondary analysis of the Inter-B-NHL Ritux 2010 trial 的文章。该文章呈现了Inter-B-NHL-Ritux 2010试验预设二次分析的结果, 表明儿童和青少年高风险、成熟B细胞NHL患者接受化疗联合利妥昔单抗治疗虽有发生长期低丙种球蛋白血症的风险,但严重感染罕见。

主研究Inter-B-NHL-Ritux 2010试验共纳入来自12个国家的482例初诊儿童和青少年(6个月至18岁)高风险(即具有分期晚、中枢神经受累等不良预后风险因素)成熟B细胞NHL患者,对比化疗联合利妥昔单抗(下称联合治疗)和仅化疗的疗效及安全性。研究初始设计为所有患者随机分配至联合治疗或化疗组,但由于中期分析显示联合治疗组疗效更优,后续入组患者均接受联合治疗,即不再是随机分配。
这项二次分析共纳入421例在三个时间点(基线、治疗结束后1个月时,及治疗开始后1年时)均有至少一项免疫数据的患者进行免疫评估,包括279例联合治疗组患者(147例为随机分配、132例为非随机分配)和142例随机分配至化疗组的患者。患者平均年龄8.8岁,82%为男性,大部分患有伯基特淋巴瘤(89%)。随机分配人群(n=289)和非随机分配人群(n=132)的中位随访时间分别为58个月和50个月。
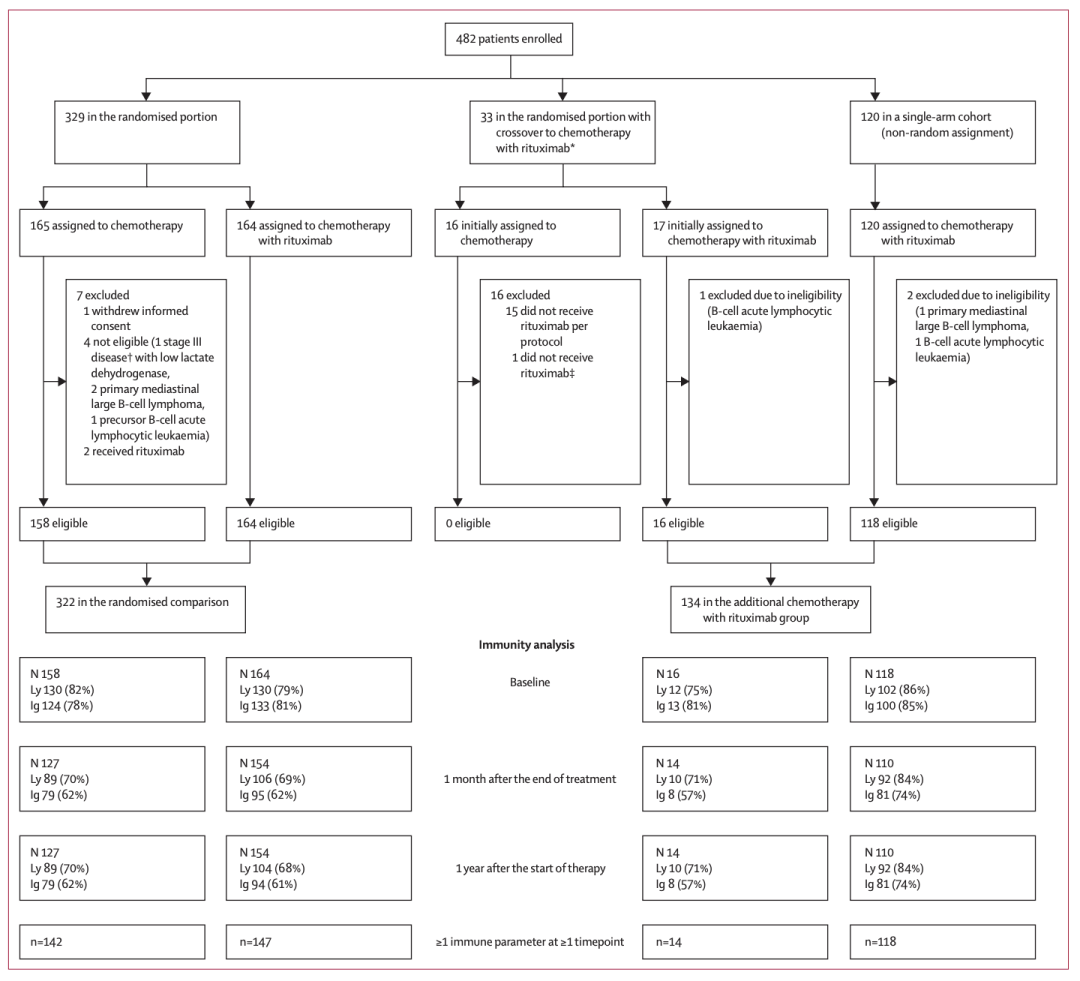
纳入免疫评估二次分析的患者分组情况
免疫评估的主要终点为淋巴细胞计数、B细胞计数和丙种球蛋白(IgG)水平。其他终点包括接受免疫球蛋白置换治疗的患者比例和疫苗血清学结果。
基线时,所有有可用数据的患者中34%(不包括伴有外周血细胞骨髓病者)伴有淋巴细胞减少症,13%伴有严重低CD19+CD20+B细胞计数, 48%伴有低丙种球蛋白血症。
治疗结束后1个月时,相较于化疗组,联合治疗组伴有淋巴细胞减少症(81% vs. 60%,OR 2.92,P=0.0011)和B细胞减少症(96% vs. 64%,OR 13.33,P<0.0001)的几率显著更高。然而,治疗开始后 1 年时,该差异不再显著。
在低丙种球蛋白血症方面,联合治疗组在治疗结束后1个月时伴有低丙种球蛋白血症的几率亦显著更高(71% vs. 47%,OR 2.72,P=0.0017),且该差异在治疗开始后1年时仍然存在(55% vs. 25%,OR 3.64,P=0.0003)。多变量分析显示,基线时年龄<15岁、接受预后较差组化疗方案治疗及IgG水平低与治疗开始后1年时IgG水平低显著相关。
治疗期间和治疗后的随访数据显示,在随机分配的患者中,相较于化疗组,联合治疗组的患者更可能接受≥1次免疫球蛋白置换治疗(5年发生率:16% vs. 7%,HR 2.63,P=0.010),最常见的接受置换的原因是低丙种球蛋白血症。疫苗血清学方面,联合治疗组中,有9%(4/47,小儿麻痹症疫苗)到42%(21/50,肺炎球菌疫苗)不等的患者的疫苗保护性抗体消失。
关于利妥昔单抗相关的感染,虽然主研究结果显示化疗预治疗后联合治疗组中4级或以上感染事件的发生率更高(18.5% vs. 化疗组11.1%,P=0.07),本项二次分析显示从治疗结束后1个月开始的随访期内,仅 1 例接受联合治疗的患者发生4级感染事件(多菌种性细菌性败血症),另外有5例患者(均接受联合治疗)发生3级感染事件(1例爱泼斯坦-巴尔病毒感染、1例带状疱疹病毒感染、1例细菌感染和2例肺炎)。
这项研究也具有局限性。比如,随访期间仅3级或以上的感染事件需要上报,因此可能忽略了较低等级的感染事件。另外,纳入二次分析的患者的免疫数据大多有缺失,而联合治疗组进行IgG检测的频率高于化疗组,因此,潜在的数据偏倚可能夸大了利妥昔单抗对IgG的负面影响。
总体而言,该研究结果显示,在化疗基础上加用利妥昔单抗会对儿童和青少年高风险、成熟B细胞NHL患者的免疫功能造成影响,尤其是会增加持续的低丙种球蛋白血症的风险,需要加强对IgG水平的监测。由于现有研究观察到的治疗后严重感染事件罕见,仍需大量的患者数据来更准确地量化该风险。另外,本研究也指向需要进一步探索接受化疗联合利妥昔单抗治疗后,哪些患者最可能从免疫球蛋白置换治疗和疫苗再接种中获益。
DOI: 10.1016/S2352-3026(23)00062-5


