顾宁院士团队《ACS Nano》:成功设计一种靶向纳米酶用于改善动脉粥样硬化斑块炎性微环境,有效预防动脉粥样硬化进展
时间:2023-07-06 07:06:33 热度:37.1℃ 作者:网络
动脉粥样硬化斑块破裂诱发的心肌梗塞和中风等心血管疾病是我国居民的首要死因,给患者家庭和社会都带来沉重的经济负担。目前临床药物主要是他汀类降脂药物,但即使在达到目标血脂后,斑块内产生的炎症仍会增加患者的急性事件风险。最新临床数据显示抗炎药物可预防斑块破裂,降低临床急性事件的发生率,然而全身性炎症抑制会干扰机体免疫系统,增加患者感染风险。
因此,寻找安全有效的抗炎策略是当前动脉粥样硬化疾病治疗的研究重点。研究表明,斑块内炎性微环境是造成炎症持续存在的重要因素。斑块内的炎性微环境(包括单核细胞的大量招募、过度氧化应激和凋亡细胞堆积等特征)会持续激活并维持炎症反应。鉴于此,斑块微环境调控已成为动脉粥样硬化治疗的新靶点,针对并消除斑块微环境中的这些炎性特征正成为一种新型的动脉粥样硬化治疗方法。
动脉粥样硬化斑块(来源:网络)
近期,顾宁院士团队基于实验室前期普鲁士蓝纳米酶的研究基础,取得了一项在改善动脉粥样硬化斑块内炎性微环境方面的重要突破。研究团队成功设计了一种具有动脉粥样硬化斑块靶向能力的普鲁士蓝纳米酶(PBNZ@PP-Man)。在这项研究中,顾宁团队中的何泓良教授等人对普鲁士蓝纳米颗粒进行了表面修饰,以增强其在体内对动脉粥样硬化斑块的靶向性。PBNZ@PP-Man通过竞争性结合到受损血管内皮高表达的P选择素上,成功降低了斑块内单核细胞的黏附和浸润程度。
同时,通过表面修饰的甘露糖分子,这种靶向纳米酶能够精准识别斑块内的炎症细胞,并发挥普鲁士蓝纳米酶的活性氧(ROS)清除能力,从而全面改善动脉粥样硬化斑块内的炎性微环境,进一步稳定斑块形成。在动物模型实验中,PBNZ@PP-Man不仅能有效降低斑块内单核细胞的黏附和浸润,还能发挥普鲁士蓝纳米酶本身的ROS清除活性,有效抑制斑块内的炎症反应,从而促进斑块的稳定化过程。
值得注意的是,与仅消除斑块内单一炎性靶点相比,PBNZ@PP-Man在调控炎性斑块微环境和减轻动脉粥样硬化方面的效果更为显著。这一研究可为改善动脉粥样硬化斑块微环境提供了一种新策略。

【文章要点】
研究人员采用表面修饰技术对普鲁士蓝纳米酶颗粒进行了修饰,成功合成了具有斑块靶向性的PBNZ@PP-Man。通过应用多种表征方法,包括动态光散射(DLS)、扫描电子显微镜(SEM)和透射电子显微镜(TEM),对材料进行了全面的表征。此外,还对其酶活进行了评估,结果显示在不同条件下呈现出多种酶活性,包括类过氧化物酶(POD)活性、过氧化氢酶(CAT)活性和超氧化物歧化酶(SOD)活性等。这些表征结果为后续的研究和应用提供了基础。
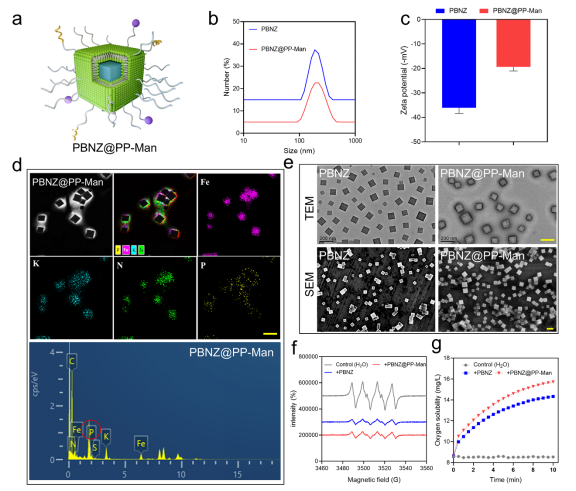
图1 PBNZ@PP-Man的理化性质表征分析
在细胞水平上,对靶向纳米酶PBNZ@PP-Man进行了详尽的研究。细胞黏附实验结果显示, PBNZ@PP-Man具备与受损血管内皮细胞靶向结合的能力,通过竞争性抑制单核细胞的黏附和迁移,有效减少了单核细胞在血管内膜中的浸润,从而减轻了动脉粥样硬化引起的炎症反应。在血管内膜中,多功能普鲁士蓝纳米酶能够通过甘露糖分子介导选择性地内吞进入巨噬细胞,降低巨噬细胞内的氧化应激水平,修复受损的巨噬细胞。通过上述作用机制,多功能普鲁士蓝纳米酶能够抑制单核细胞向血管内膜的迁移,并清除内膜中过度产生的ROS。这些研究结果揭示了多功能普鲁士蓝纳米酶的重要作用,为其在调控动脉粥样硬化炎症反应中的潜在应用提供了理论基础。

图2 PBNZ@PP-Man靶向受损内皮细胞、抑制单核细胞黏附与迁移
研究人员利用喂食高脂肪饲料的ApoE-/-小鼠建立了动脉粥样硬化(AS)模型,用以验证靶向纳米酶PBNZ@PP-Man在斑块中的靶向能力,包括斑块处受损内皮细胞和斑块内巨噬细胞。离体成像结果显示,相比未修饰纳米酶组,靶向纳米酶PBNZ@PP-Man组在主动脉中的荧光效率提高了3.2倍,而不同纳米酶在其他脏器中的分布相似。值得注意的是,靶向纳米酶PBNZ@PP-Man组在肝脾脏器中的分布显著降低,这表明颗粒表面PEG修饰降低了肝脾网状内皮系统对其的清除作用,从而有利于动脉粥样硬化斑块的靶向治疗。此外,通过研究不同斑块组织细胞与荧光标记纳米酶的共定位,评估了靶向纳米酶PBNZ@PP-Man在靶向斑块处P-selectin和斑块中巨噬细胞方面的能力。研究结果显示,与其他纳米酶相比,PBNZ@PP-Man组能够更有效地靶向斑块处的受损内皮细胞上的P选择素以及斑块中的巨噬细胞。
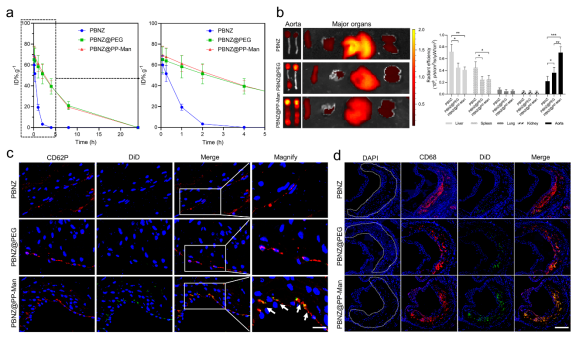
图3 PBNZ@PP-Man体内代谢行为研究
最后,研究人员进一步探索了PBNZ@PP-Man在体内抗动脉粥样硬化效果和作用机制。结果显示, PBNZ@PP-Man治疗组能够显著减少主动脉弓处的斑块面积,增加斑块处的胶原含量,并降低斑块内巨噬细胞的浸润程度。进一步的生化分析表明,PBNZ@PP-Man通过抑制单核细胞向内膜的迁移、减少炎性细胞因子的分泌和降低斑块内ROS水平等多重作用来调控斑块内的微环境,缓解炎症反应,从而实现斑块的稳定化目标。
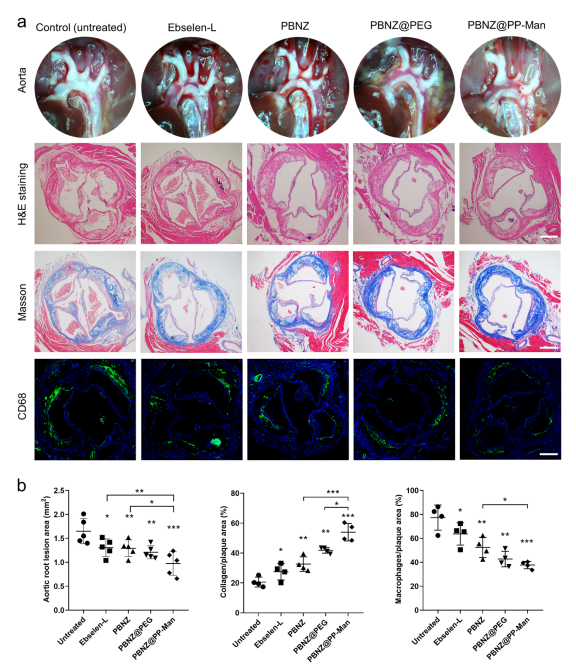
图4 PBNZ@PP-Man显著抑制动脉粥样硬化发展进程
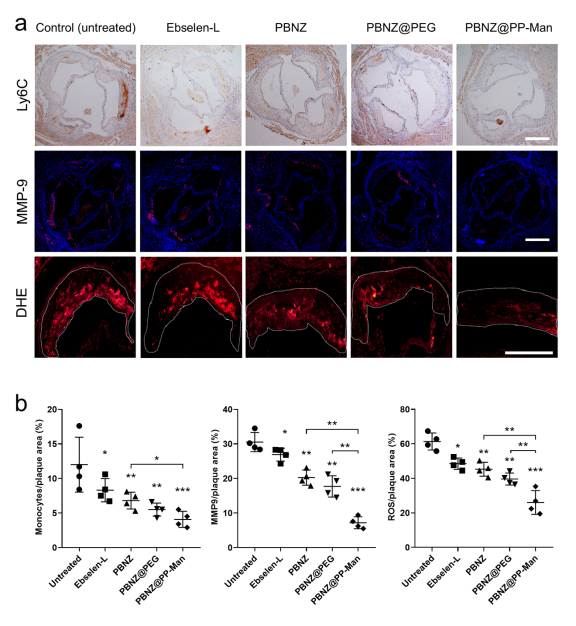
图5 PBNZ@PP-Man缓解斑块炎性微环境、抑制斑块进程
综上所述,这项研究为动脉粥样硬化的治疗提供了崭新的方向。研究人员指出,靶向纳米酶具有精确性和高效性,为动脉粥样硬化的治疗带来了新的希望。该技术的应用有望改善患者的炎症状况,预防斑块的进一步发展和破裂,从而降低心脏病和中风等严重并发症的风险。未来,研究团队将进一步完善纳米酶的设计和修饰,进行全面的体内用药安全性评估,争取尽早将这一创新疗法应用于临床实践,造福更多的患者。
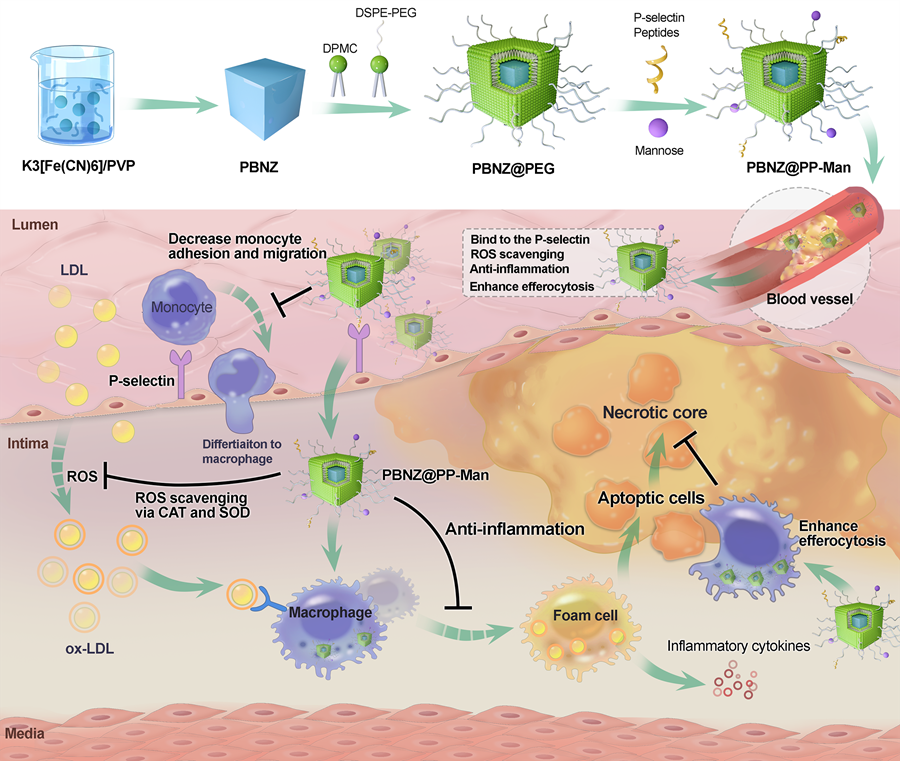
图6 PBNZ@PP-Man缓解斑块炎性微环境作用机制
相关工作以《Design of a Multifunctional Nanozyme for Resolving the Proinflammatory Plaque Microenvironment and Attenuating Atherosclerosis》为题发表在ACS Nano上,该论文的第一作者是东南大学生物科学与医学工程学院的何泓良教授,南京大学的顾宁教授和东南大学的张宇教授为论文的共同通讯作者。参与该工作的还有东南大学生物科学与医学工程学院的研究生韩庆功、王诗、龙濛濛等。该研究得到了国家自然科学基金项目(82072067、61821002、51832001、82202321)、科技部重点研发计划(2017YFA0205502、2022YFF0710800)和江苏省前沿引领技术基础研究专项(BK20222002)的共同资助。
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c01420


