【JMC】高效低毒-靶向线粒体Mcl-1抑制剂的开发
时间:2023-07-07 15:07:54 热度:37.1℃ 作者:网络
导语
髓系白血病1 (MCL-1)是BCL-2家族的一种抗凋亡蛋白,通过与促凋亡的BCL-2蛋白结合来阻止细胞凋亡。MCL-1的过表达在许多肿瘤类型中都很常见,与肿瘤发生、预后不良和耐药密切相关。MCL-1定位于线粒体,在调节线粒体凋亡途径中的核心作用使其成为癌症治疗的一个有吸引力的靶点。虽然MCL-1抑制剂的研发已取得重大进展,但是在研发过程中仍然面临着一些问题:
- 首先,大部分报道的Mcl-1抑制剂由于药物理化性质差、膜通透性低、血清蛋白结合率高等因素导致抗肿瘤活性较差;
- 其次,部分进入临床试验阶段的Mcl-1抑制剂(AZD5991, AMG-176等)由于副作用的原因致使临床试验终止(NCT03218683,NCT03797261)。
近些年来有很多工作致力于通过结构优化来提高Mcl-1抑制剂的亲和力,而忽略了Mcl-1抑制剂在细胞内的分布。据报道,由于大多数Mcl-1抑制剂的线粒体膜穿透性较低,在细胞中表现出了脱靶效应。作者认为抑制剂对线粒体的靶向作用可以提高结合效率,减少潜在的脱靶效应,从而增强Mcl-1抑制剂的抗肿瘤活性,减少潜在副作用。作者基于课题组的前期工作设计了一种β-咔啉与金属配位的复合物9,可靶向线粒体Mcl-1,单药或与ABT-199(Bcl-2抑制剂)联用时显示出良好的抗肿瘤活性。
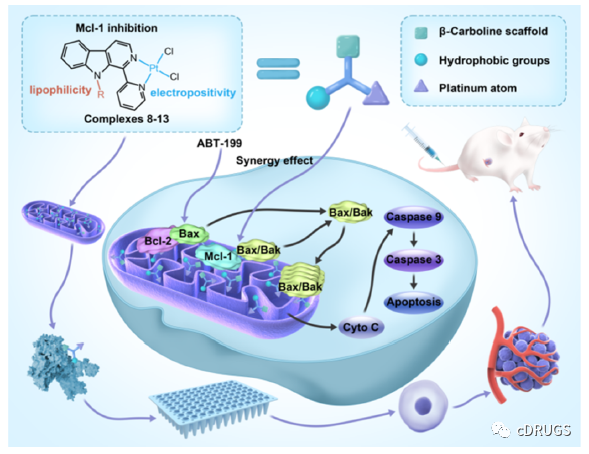
设计基于铂(II)的配合物主要基于铂(II)配合物与具有疏水性基团取代的β-羰基配体,为与Mcl-1的结合提供了有利的条件。铂(II)配合物具有亲脂性,并且能够在溶液中形成带正电荷的物质,这些亲脂性和带正电荷的物质能够在线粒体膜电位的驱动下穿过线粒体膜并在线粒体内聚集,为靶向线粒体提供了有力的保障。
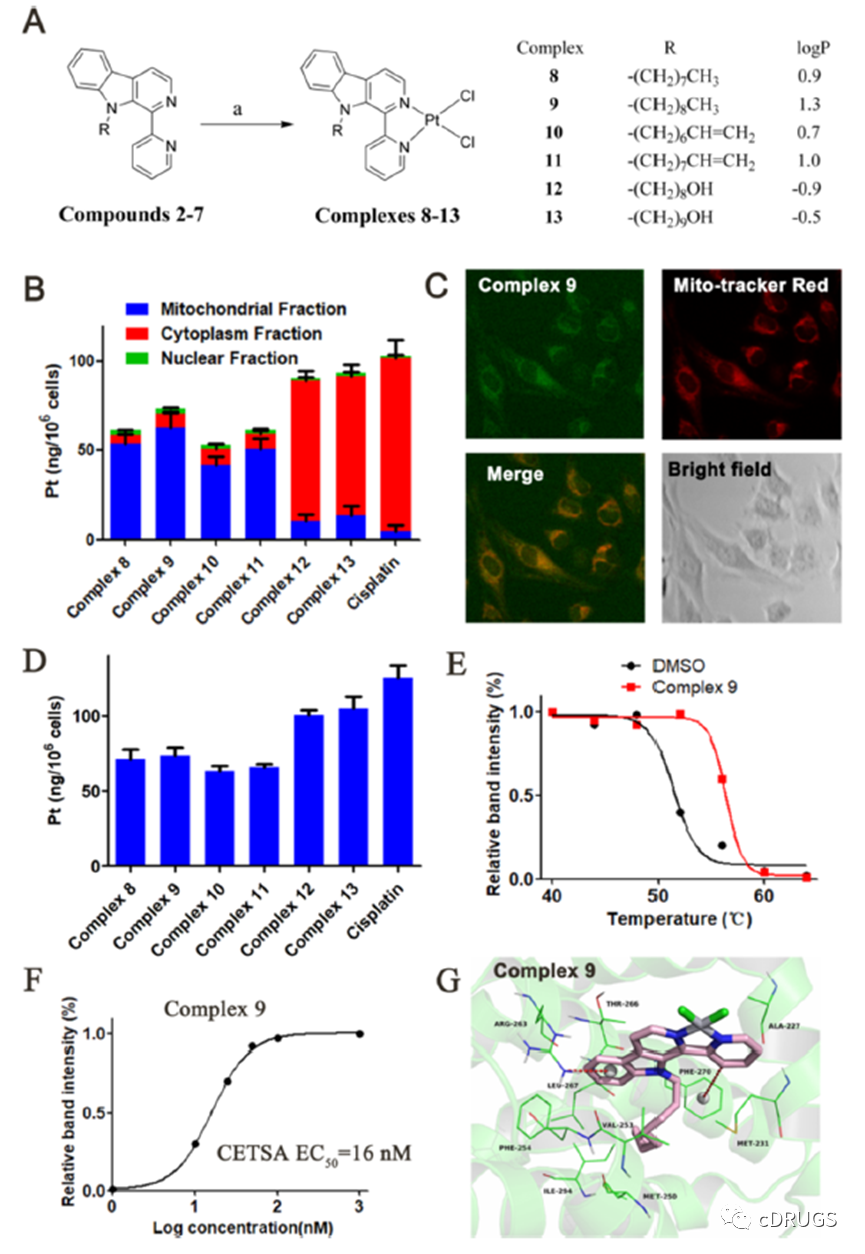
这些铂(II)配合物8−13被设计为靶向线粒体发挥其抗肿瘤活性。因此,利用ICP-MS和共聚焦荧光显微镜研究显示铂(II)配合物主要定位于细胞内线粒体。以顺铂为对照时发现大多数顺铂定位于细胞质部分。在这些铂(II)配合物中,配合物9显示出最高的线粒体靶向能力。通过共聚焦荧光显微镜进一步证实铂配合物9在细胞内的定位,复合体9和MitoTracker Red的显微镜图像融合得很好,与ICP-MS结果一致,表明复合体9定位于线粒体。据报道,靶向线粒体的分子通常既带正电又亲脂,用ICP-MS测定了这些铂(II)配合物的Log P。如图所示,Log P值较高的铂(II)配合物显示出线粒体靶向性增强。根据Lipinski规则配合物9表现出最佳的亲脂性(1 < Log P < 3)。
此外,所有铂(II)配合物8−13都具有足够的溶解度,可用于机理研究。为了进一步评估其在细胞中的靶标作用,作者通过细胞热移试验(CETSA)测试确定了配合物9使Mcl-1蛋白的熔点提高了5℃,表明配体介导的靶蛋白稳定。且复合物9在剂量依赖性细胞中稳定Mcl-1, EC50值为16 nM。这些结果表明,在细胞环境中,复合物9是一种有效的Mcl-1抑制剂。
与配体2−7或Pt(DMSO)2Cl2相比,铂(II)配合物的抗增殖活性显著增强,这表明β-咔啉配体和铂(II)在形成配合物后协同抑制了Mcl -1依赖性癌细胞。LP-1和NCI-H929细胞对复合物8 ~ 13高度敏感,IC50值在0.1 ~ 2 μM范围内。最有效的复合物9显示出比复合物12高13倍的抗增殖活性,尽管它们的Mcl-1亲和力仅相差3倍。这一结果可能与复合体9比复合体12具有更高的线粒体靶向能力有关。更重要的是,复合物9对LP-1细胞的活性是阳性对照A-1210477的91倍,尽管它们对Mcl-1的亲和力都在低纳摩尔范围内。这一结果表明,线粒体靶向Mcl-1抑制剂比其他类似亲和力的Mcl-1抑制剂具有更强的抗肿瘤活性。
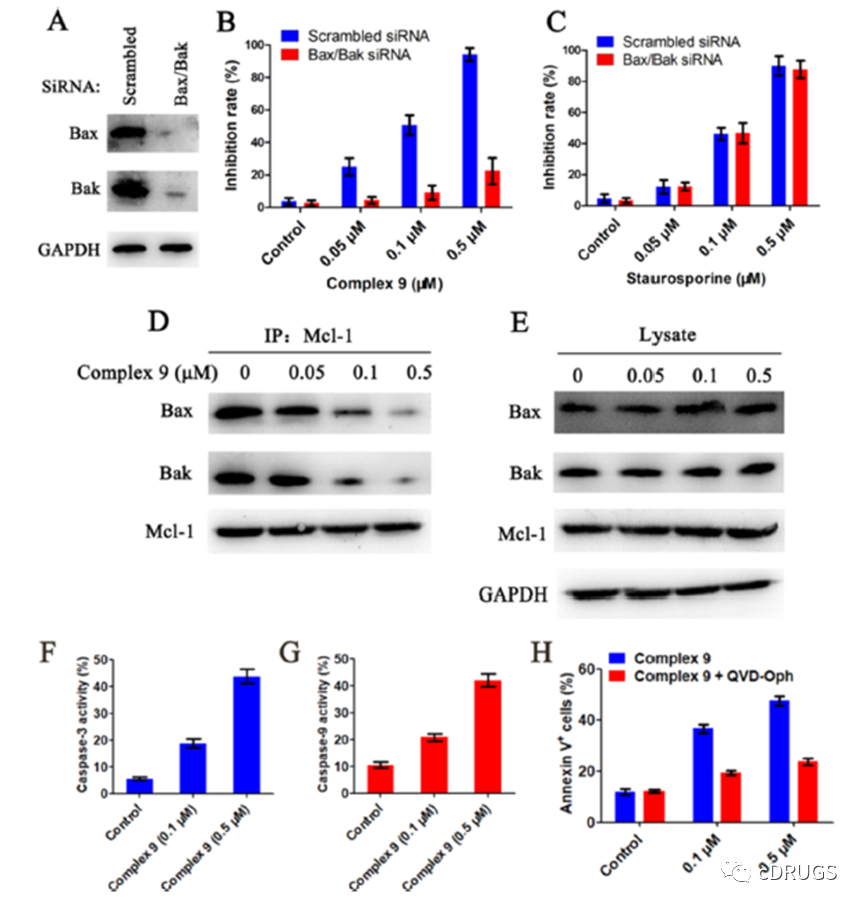
Bak和Bax是Mcl-1通路激活所必需的蛋白。为了进一步研究铂(II)配合物的作用机制,作者用siRNA处理LP-1细胞,Western blotting证实Bax/Bak的沉默。然后通过CCK8试验评估复合物9对这些Bax/ bak缺陷细胞的活性。Bax/Bak基因沉默显著抑制复合物9的抗肿瘤活性,而阳性对照对Bax/ bak缺陷细胞和LP-1细胞表现出相同的活性。这些结果表明复合物9诱导了Bax/ bak依赖性癌细胞的杀伤。复合物9处理细胞后,总蛋白中Bax和Bak的水平没有变化,而随着复合物9浓度的增加,免疫沉淀蛋白中的Bax和Bak水平降低,这表明复合物9与Mcl-1一起减弱了Bax/Bax的PPIs。通过流式细胞术研究复合物9对caspase-9/3活化的影响发现配合物9处理LP-1细胞4小时后,caspase-9/3活性呈剂量依赖性增加。
此外,配合物9与caspase抑制剂共处理进一步证实了配合物9对caspase-9/3杀伤肿瘤细胞的依赖性。且caspase抑制剂显著降低了复合物9在LP-1细胞中的诱导凋亡活性,表明复合物9通过caspase依赖性凋亡杀死LP-1细胞。
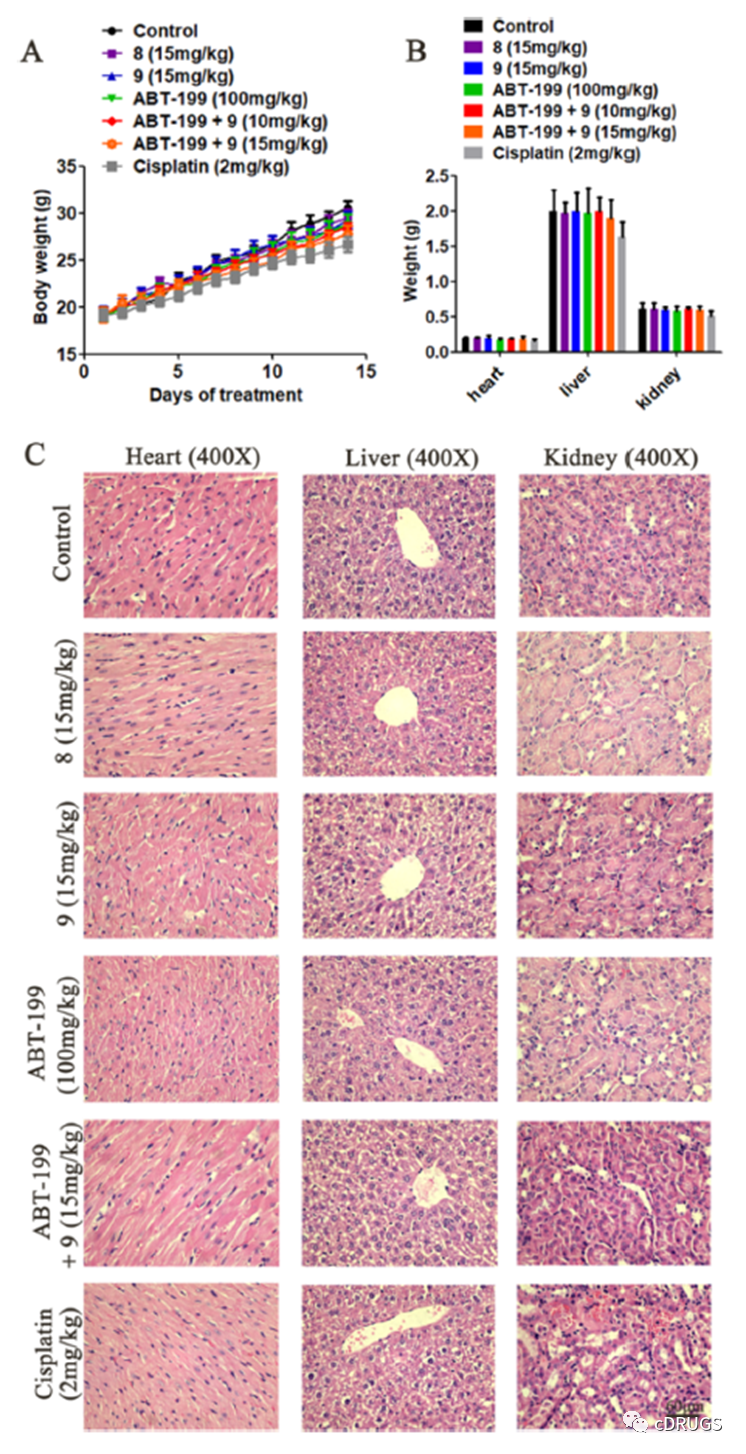
在证明配合物9在细胞水平上是一种选择性抗肿瘤药物后,作者通过小鼠实验和病理分析评估了铂(II)配合物的体内安全性。如图所示,复合物9单独使用或与ABT-199联合使用均未引起小鼠体重减轻或其他副作用。14 d后处死小鼠,取肾、肝、心、脾、肺等脏器进行病理分析, H&E染色切片显示复合物9未对处理小鼠的肾、肝、心、脾和肺造成明显的病理损伤。作为对照,顺铂治疗导致小鼠肾脏损害,这与顺铂的临床副作用一致。这些结果表明,复合物9在小鼠中单独使用或与ABT-199联合使用均具有良好的耐受性。
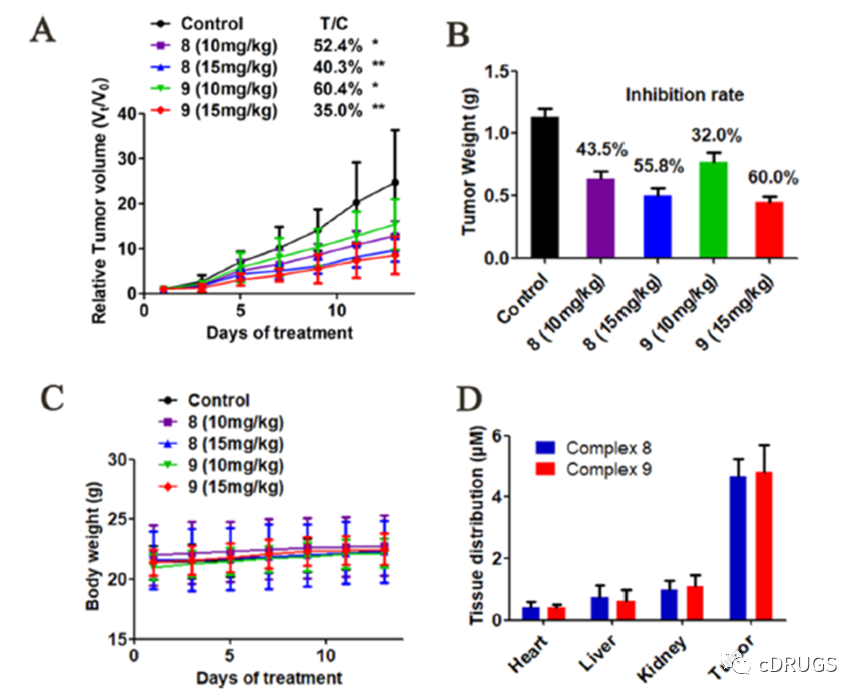
如图所示,配合物8和9对HeLa异种移植瘤生长的抑制作用均呈剂量依赖性,相对肿瘤生长率分别为40.3%和35.0%。在相同剂量(15 mg/ kg)下,复合物9的体内抗肿瘤活性略高于复合物8,抑制率分别为60.0和55.8%。此外,配合物8和9在各组中均未引起体重下降,表明配合物毒性较低。采用ICP-MS法测定了小鼠心脏、肝脏、肾脏和肿瘤组织中铂的含量,治疗后铂主要积聚在肿瘤组织中。药物在肿瘤中的浓度高于对肿瘤细胞系相应的细胞IC50值。然而,心脏、肝脏和肾脏的药物浓度低于正常肝细胞的IC50值。这些结果解释了复合物在异种移植小鼠模型中的高功效和低毒性。观察到铂复合物在肿瘤组织中的积累可能与复合物8和9与肿瘤中Mcl-1蛋白的结合有关。
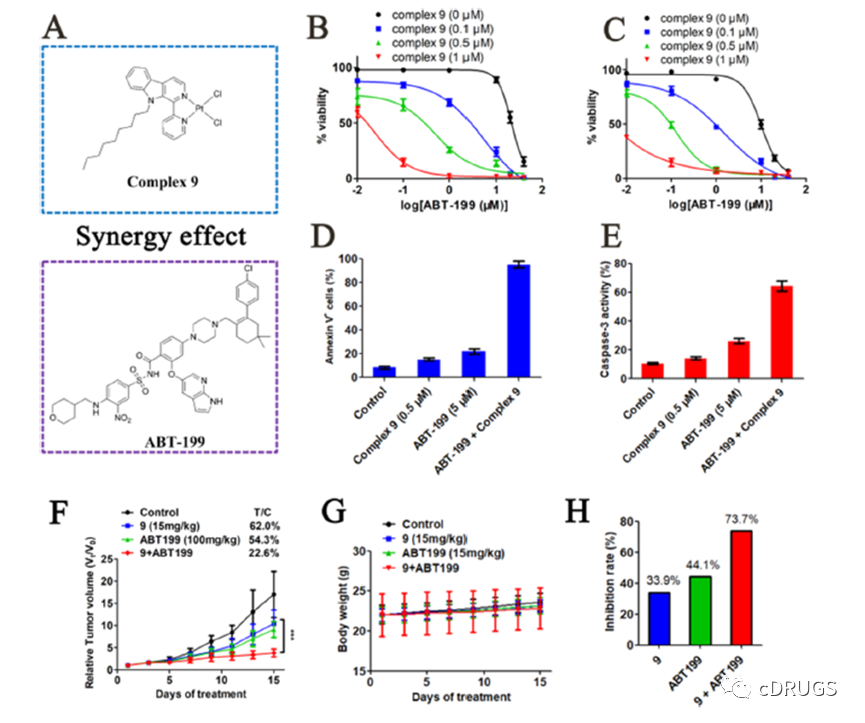
Mcl-1被鉴定为Bcl-2抑制剂ABT-199的关键耐药蛋白。通过siRNA介导的敲低或小分子抑制剂抑制Mcl-1可增加多种癌细胞对Bcl-2抑制剂的敏感性。因此,作者在ABT-199耐药细胞(HeLa和THP-1)中测试了复合物9与ABT-199的协同作用,复合物9显著改变了ABT-199在HeLa和THP-1细胞中的剂量-反应曲线,提示Mcl /Bcl-2抑制的协同作用。此外,通过细胞凋亡检测进一步证实了复合物9与ABT-199的协同作用。如图所示,配合物9和ABT-199作为单一药剂的效果较弱,而联合作用可显著诱导THP-1细胞凋亡,且凋亡率高于90%。
此外,通过caspase-3激活实验进一步评价了复合物9与ABT199联合的作用,复合物9与ABT-199协同激活THP-1细胞中的caspase-3。这一观察结果与细胞凋亡结果一致。在异种移植小鼠模型中进一步研究了复合物9和ABT199的协同抗肿瘤活性。如图所示,复合物9和ABT199均能有效抑制THP1异种移植肿瘤的生长,T/C值分别为62.0和54.3%。配合物9与ABT-199联合使用的活性显著高于单药,T/C值为22.6% (P < 0.001)。联合用药对肿瘤生长的抑制率(73.7%)远大于单独用药,表明复合物9与ABT-199协同抑制肿瘤生长。在15天的治疗期间,各组小鼠的体重均未下降,这表明复合物9和ABT-199在小鼠中具有良好的耐受性。
结论
复合物9是第一个靶向线粒体Mcl-1的铂基抑制剂。复合物9选择性地抑制Mcl-1,使其在肿瘤细胞的线粒体中积累,从而在体外和小鼠模型中增强抗肿瘤活性。机制研究表明,复合物9通过线粒体凋亡途径杀死Mcl -1依赖性细胞。复合物9与ABT-199协同杀灭多种肿瘤模型中的癌细胞,且无明显副作用。研究表明,开发小分子靶向线粒体Mcl-1抑制剂是一种潜在的有效策略,可以在小鼠模型中实现安全有效的抗肿瘤效果。该策略可以广泛应用于其他线粒体蛋白,以产生具有提高肿瘤杀伤效率和最小脱靶效应的抑制剂。
原文链接:
DOI: 10.1021/acs.jmedchem.3c00355


