半年内国产6款Claudin18.2创新药物获批临床,全球在研进入热潮
时间:2021-06-26 21:01:59 热度:37.1℃ 作者:网络
前不久,石药集团宣布其靶向Claudin18.2的ADC药物SYSA1801获批临床,拟用于治疗晚期实体瘤患者。值得一提的是,在这之前今年已有5款靶向Claudin18.2的抗体药物获批临床,SYSA1801是2021年第6款靶向Claudin18.2获批临床的抗体药物。由此可见,该靶点成为了近期药企们争相研发的方向之一。

Claudin18.2为何备受青睐
Claudin(CLDN)是人体正常组织中紧密连接最重要的一种蛋白质,具有4个跨膜结构域,是细胞紧密连接的重要分子,参与机体生理过程如细胞旁通透性和电导的调节,其构成了细胞旁屏障,控制着细胞间分子的流动。该家族包含至少27个成员,其中Claudin18有Claudin18.1和Claudin18.2两种异构体。
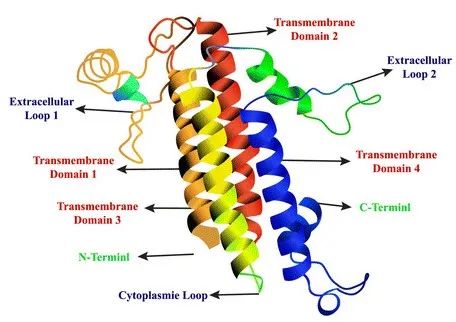
claudins蛋白结构示意图
研究发现,Claudin的不同亚型在不同组织中表达分布不同,其异常表达与肿瘤的发生发展有关。正常生理状态下,Claudin18.2仅低水平表达于已分化的胃壁细胞中,但在病理状态下,Claudin18.2在多种肿瘤中有的表达显著上调,包括80%的胃肠道腺瘤、60%的胰腺肿瘤,以及部分胆管、卵巢和肺部肿瘤中。
因其在正常组织中的高度特异性表达,再加上在多种癌症中的激活表达,使得Claudin18.2蛋白成为了研究人员开发胃癌、胰腺癌等实体瘤免疫疗法的理想靶点。同时,由于胃癌是国内的一大瘤种,Claudin 18.2靶点有望实现胃癌新靶点药物的瓶颈突破。
国内外研发方向:单抗、双抗、CAR-T
提及Claudin18.2这个靶点,还要从2016年ASCO会议上说起,当时Ganymed公司针对该靶点的抗体Zolbetuximab(IMAB362)以黑马身份出现,成为了当年ASCO会议的最大亮点,安斯泰来在当年立刻收购了Ganymed公司,使得Claudin18.2在肿瘤免疫领域获得广泛关注。
至此之后,默默无闻的Claudin18.2似乎突然崛起。据不完全统计,目前仅国内就有数十家公司在开发该靶点的创新疗法,包括单抗、双抗、CAR-T等疗法。
Claudin 18.2在研项目信息:
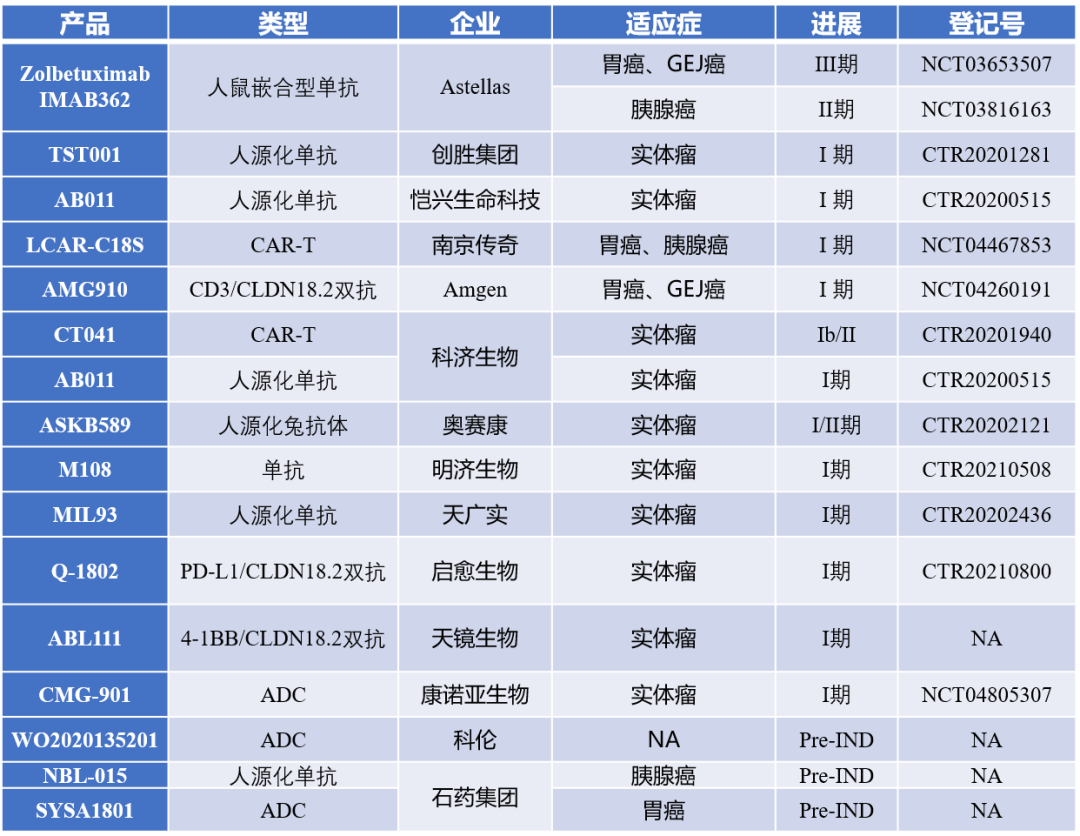 资料来源:ClinicalTrials,CDE,各公司官网
资料来源:ClinicalTrials,CDE,各公司官网
以下将对全球范围内进展较快的Claudin18.2药物进行部分展开介绍:
单抗
1.Zolbetuximab:生存期延长一半
安斯泰来的Zolbetuximab是第一种针对Claudin18.2靶点开发的药物,是一种嵌合的IgG1单克隆抗体,在肿瘤细胞表面与Claudin18.2特异结合,从而引发抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC),凋亡和抑制细胞增殖。
在目前所有被批准进入临床试验的靶向Claudin18.2药物中,研发进度最快的也是Zolbetuximab,正在全球范围进行多项多中心双盲随机Ⅲ期的临床试验。
根据往届ASCO大会上公开的研究数据,使用Zolbetuximab+CAPOX(卡培他滨+奥沙利铂)化疗方案治疗局部晚期或转移性胃癌患者,中位无进展生存期为7.9个月,中位总生存期13.2个月;仅采用CAPOX化疗方案治疗的患者,中位无进展生存期为4.8个月,中位总生存期为8.4个月。采用Zolbetuximab治疗,患者的无进展生存期和总生存期延长了近一半。
在2019年公开的Ⅱ期研究数据中也证实,Zolbetuximab治疗晚期胃癌或胃食管交界处癌或食道腺癌患者,临床获益率达到23%。同时,从分组分析中可以明显观察到,Zolbetuximab对于Claudin 18.2表达水平更高、尤其是表达水平≥70%的患者疗效更加显著。
2.TST001
TST001是创胜集团旗下子公司迈博斯生物自主研发的Claudin18.2人源化单克隆抗体新药,可通过高亲和力特异性结合Claudin18.2蛋白,介导ADCC)和CDC 机制,直接靶向杀灭Claudin18.2表达阳性的肿瘤细胞。凭借先进的工艺技术,TST001的岩藻糖修饰比例得以在生产中大大降低,进一步增强了TST001的肿瘤杀伤活性。 2020年4月,TST001先后在中国、美国获批临床试验。在中国,TST001获批为拟在临床试验中单药或联合标准治疗用于治疗Claudin18.2表达阳性的晚期实体瘤,包括但不限于胃/胃食管结合部腺癌,胰腺导管腺癌,胆管癌,胆囊癌,肺腺癌等。目前,TST001正在美国及中国进行1期试验,以评估其安全性及耐受性,以及于晚期实体瘤(包括但不限于胃癌及胰腺癌)患者的抗肿瘤活性。3.AB011
AB011是恺兴生命科技与科济生物开发的一款重组人源化抗Claudin18.2单克隆抗体注射液,这是我国自主研发的首个针对Claudin18.2的单抗,也是国际上首个针对该靶点的人源化单抗。临床前研究结果显示AB011具有良好的安全性和有效性,当与奥沙利铂和5-氟尿嘧啶联合使用时,在肿瘤小鼠模型中表现出强大的体内抗肿瘤活性。目前,AB011正在中国开展治疗Claudin18.2阳性实体瘤的1期临床研究。
4.ASKB589(人源化兔抗体)
ASKB589注射液是奥赛康自主研发、具有自主知识产权一款人源化Claudin18.2抗体,该在研药物主要通过ADCC和CDC杀伤肿瘤细胞,拟用于胃及胃食管结合部腺癌、胰腺癌等适应证。2020年4月,该药已在中国获批临床,并已经启动ASKB589注射液在局部晚期或转移性实体瘤患者中安全性、耐受性和有效性临床研究。双抗
1.AMG910
AMG910是安进开发的一款靶向CD3/Claudin18.2的双特异性抗体药物。在全球范围内,安进正在开展一项1期临床研究,以评估AMG 910治疗Claudin18.2阳性的胃癌和胃食管交界腺癌患者的安全性、耐受性、药代动力学和疗效。在中国,安进和百济神州已联合提交了AMG910的临床试验申请,并于今年7月1日获得CDE受理。2.Q-1802
Q-1802是启愈生物开发的同时靶向PD-L1及Claudin18.2的双特异性抗体,可利用Claudin18.2 抗体将PD-L1抗体特异性地靶向到肿瘤组织,显著降低系统暴露量,降低副作用。此项目是苏桥生物仅用9个月时间就圆满完成了从工艺开发到三批生产的全部工作。目前,该药物已获批进入临床。 CAR-T1.CT041
CT041是科济生物自主研发的一款人源化抗Claudin18.2自体CAR-T细胞疗法。2020年5月,科济生物宣布该疗法在美国获批临床;8月,该产品首次在中国获批临床,针对的适应证为至少二线治疗失败的晚期胃/食管胃结合部腺癌和至少一线治疗失败的晚期胰腺癌,目前已启动CT041自体CAR-T细胞注射液在晚期胃/食管胃结合部腺癌和胰腺癌受试者中的Ib/II期临床试验。2020年10月5日,美国FDA授予该疗法孤儿药资格,用于治疗胃腺癌和食管胃结合部腺癌。2.LB1904
据悉,传奇生物开发的靶向Claudin18.2的CAR-T细胞疗法LB1904已经进入临床I期试验,用于治疗胃癌或胰腺癌。另外,传奇生物还启动了一项评价三个靶向Claudin 18.2的CAR-T细胞制剂LCAR-C182A /LCAR-C182B /LCAR-C182C治疗晚期胃癌和胰腺导管细胞癌安全性、耐受性和有效性的开放性I期临床研究。Claudin18.2靶向治疗的十个问题
已有的临床结果表明,Zolbetuximab治疗胃癌具有显著的疗效和安全性。尽管大量的研究结果不断涌现,但靶向Claudin18.2在许多研究中的不同结果可能反映了测试群体的局限性,以及使用的界限值的差异。在接下来的部分中,我们将集中讨论最近人们关注的10个问题,以期找到Claudin18.2治疗的未来方向。
1. 是否有统一的检测手段?应使用高度特异性的试剂来区分Claudin18.2和剪接变体(claudin 18.1)。CLAUDETECTTM18.2试剂盒(由Ganymed开发,现由Astellas获得)是一种半定量免疫组织化学试验,首次用于人体研究和FAST研究。而MONO试验是用抗Claudin18.2兔抗血清(Zymed)鉴定样本。这可能部分解释了这些试验中不同的阳性阈值和疗效。这里提倡使用统一的检测手段来鉴别Claudin18.2。
2. 人口流行特征是什么?
Claudin18.2阳性群体的大量分布为其广泛应用奠定了基础。FAST试验和MONO试验分别显示了白人群体48%和45%的客观分布。36%和24%的患者出现高表达水平。在其他试验中,一些调查补充了Claudin18.2阳性患者的患病率。在日本的一项研究中,52%(135/262)的原发性肿瘤呈阳性(FAST的标准),这支持了在亚洲人中使用Zolbetuximab的治疗评估。进一步的研究表明,高Claudin18.2在美国样本中达到34%,在亚洲样本中达到24%。亚裔还是高加索人群体更符合条件还有待探索。HER-2总阳性率为10%,这表明,与HER-2的患病率(16.6%)相比,Zolbetuximab可使更多的人群受益。在FAST研究中,只有14%的Claudin18.2阳性患者同时表达HER-2,这表明Claudin18.2可以作为一个新的胃癌亚群的非重叠靶点。
3. CLDN 18.2作为预后的评判价值有多少?
与HER-2相似,Claudin18.2是否可以作为有意义的预后评判指标,以及与这一点相关的直接证据尚不清楚。首先,Claudin18.2表达水平是否与Lauren亚型以及癌症基因组图谱(TCGA)和亚洲癌症研究小组(ACRG)的分子亚型相关存在争议。另外,Claudin18.2的相关性在弥漫型还是在肠道亚型中更高,或有无显著性差异是有争议的。然而,在一个高加索人群的研究(n=481)中,Claudin18.2的表达水平与Lauren亚型之间没有显著的相关性,而高表达的Claudin18.2与EBV状态、TCGA分子亚型相关。另一种组织微阵列分析(n=523)证实了这一点,其中Claudin18.2阳性与EBV相关癌症和弥漫型相关。其次,基因改变值得我们关注。近年来,CLDN18-ARHGAP26/6融合在伴有淋巴结转移和远处转移的弥漫型胃癌中普遍存在,显示以奥沙利铂/氟嘧啶为基础的化疗无效。因此,融合状态可作为有效性的有效反应预测因子。组织学样本显示,浸润前沿的claudin18与增殖潜能呈负相关。有必要进一步分析以确定其预后价值。
4. 是否需要新的界限值?
值得注意的是,Claudin18.2水平的界限值在不同的试验中有所不同。首先,MONO试验和FAST试验之间存在PFS差异(14.5周vs.7.5个月),这可能与患者状态和不同的界限值(由不同的测试试剂引起)有关。其次,相对于中等水平,对高表达水平的Claudin18.2(≥75%肿瘤细胞中强度≥2+)进行亚组分析,总有更好的疗效(16.6个月vs.9.3个月)。然而,在MONO研究中,≥70%肿瘤细胞中≥2+Claudin18.2的患者获得相同的ORR。III期试验(NCT03505320)的灵感就是为了进一步证实这一点,使患者获得与FAST试验一样高的水平。进一步的研究,调查CLDN18.2表达的最佳界限值是有必要的。不同的检测试剂和患者群体(种族)是否需要唯一的界限值也需要进一步的探索。
5. Zolbetuximab是否有资格成为第二位的靶向候选药物(与HER-2相比)?
毫无疑问,Zolbetuximab在HER-2阳性进展期胃癌患者的靶向治疗中处于领先地位。EOX+zolbetuximab治疗效果最好(13.2个月),可与ToGA(13.3个月)相比较,显示其更大的潜力,成为胃癌的第二个有希望的靶点。CLDN18.2高表达亚组(16.6个月)的mOS甚至优于ToGA(13.8个月)。与Trastuzumab相似,恶心和呕吐是最常见和最严重的不良反应。到目前为止,还没有观察到与Zolbetuximab相关的治疗耐药性。尽管在FAST研究中Claudin18.2和HER-2共表达显示对Zolbetuximab有效,但针对Claudin18.2阳性/HER-2阳性以及Claudin18.2阳性/HER-2阴性患者的试验仍在进行中。
6. 联合治疗会取得更好的效果吗?
目前,临床热点主要集中在靶向药物与化疗/免疫治疗的协同作用上。虽然目前尚无联合免疫治疗的报道,但靶向Claudin18.2理论上可促进T细胞浸润和抗原递呈,从而提高免疫检查点抑制剂的疗效。像bevacizumab这样的抗血管生成药物可以启动参与ADCC的IgG下游效应器,从而帮助Zolbetuximab发挥作用。化疗不仅可以增强Zolbetuximab诱导的ADCC,而且可以直接诱导癌细胞凋亡。此外,化疗通过增加Claudin18.2的表达使肿瘤细胞对Zolbetuximab更敏感,随后诱导促炎性细胞因子。临床前和临床资料均表明,化疗方案可帮助Zolbetuximab提高对Claudin18.2阳性进展期胃癌患者的生存率。
2018年,一项在高加索人种中的II期试验(NCT03505320)对HER-2阴性/Claudin18.2阳性的不可切除胃癌/GEJ癌症应用Zolbetuximab+mFOLFOX进行了评估。除有效性和安全性外,还将评估Zolbetuximab的药代动力学和免疫原性。接下来将进行一项III期试验(NCT03504397),将在更大的人群中调查Zolbetuximab+mFOLFOX的联合疗效。另一种一线治疗选择CAPOX也将在III期试验(NCT03653507)中与Zolbetuximab联合,以验证其疗效。
然而,考虑到东西方人群的差异,三种药物联合使用所增加的毒性大于疗效,这在亚洲人身上很难复制。为了在保持疗效的同时避免不耐受,顺铂+氟尿嘧啶(S-1)作为一线治疗方法有望与Zolbetuximab联合应用。亚洲人群中Claudin18.2阳性患者值得更多考量。
7. 有没有其他的靶向剂?
其他具有高选择性和亲和力的分子,如GB7004-09hu15和IMAB362-VCME,具有很强的抗肿瘤作用,但毒性较小。他们证明了抗体偶联药物在Claudin18.2靶点上的应用,也为临床探索提供了新的思路。此外,利用高选择性分化抗原的Claudin18.2特异性表位作为抗原载体进行免疫接种,可产生杀瘤潜力并抑制转移。
8. CAR-T细胞治疗胃癌有效吗?
由于Claudin18.2的高特异性有助于T细胞识别肿瘤,因此被用于嵌合抗原受体T(CAR-T)细胞治疗。尽管CAR-T细胞治疗在实体瘤中曾遭遇挫折,但由于与标准疗法相比,PDX模型可验证体内疗效,因此可能会取得突破性进展,证明Claudin18.2特异性CAR-T细胞可作为其他潜在Claudin18.2阳性肿瘤的有前途的治疗策略,特别是胃癌。
正在进行的I期研究(NCT03159819)探讨了Claudin18.2特异性CAR-T细胞的临床应用,包括安全性、耐受性和细胞动力学。针对12例Claudin18.2阳性实体瘤患者,其中胃癌7例。在11名可评估的受试者中,1名获得CR(胃癌),3名患PR(包括2名胃癌),5名患者获得SD,2名患者疾病进展。胃癌的ORR为42.8%(3/7),总ORR达33.3%,mPFS为130天。
9. 胃癌中CAR-T细胞治疗安全吗?
尽管CAR-T细胞治疗因其毒性如细胞因子风暴而具有挑战性,但临床前研究和正在进行的试验缓解了这种担忧。Jiang等人将T细胞与抗原结合元件hu8E5−2I结合,构建了Claudin18.2 CAR-T细胞,表明它不仅赋予CAR-T细胞强大的清除小鼠Claudin18.2阳性细胞的能力,而且对PDX模型正常组织无明显毒性。I期试验报告没有严重的胃毒性或细胞因子释放综合征(CRS),除了淋巴细胞和中性粒细胞减少外,没有观察到4级不良事件。轻微的靶向非肿瘤效应可能与独特的肿瘤微环境有关。
10. 如何改进CAR-T细胞治疗?
在PDX模型中,CD3和Claudin18.2的双特异性T细胞接合器(BiTEs)被设计成具有两个结合位点。因此,BiTEs可通过结合其CD3和靶向Claudin18.2来引导T细胞,从而改善ADCC,且毒性小。这种疗法被证明优于传统疗法。Claudin18.2的新型四价双特异性(TetraBi)抗体显示出令人印象深刻的抗肿瘤活性,提供了比双特异性形式更好的疗效。在临床前研究中,尽管BiTEs在PDX模型上取得了成功,但原位模型的效果和安全性是否会保持乐观仍不确定。虽然没有显著的不良事件报告,但发生了1级或2级的CAR-T细胞治疗特异性CRS,提示细胞因子风暴可能在理论上挑战临床应用。接下来,一些正在进行的I期试验正在探索Claudin18.2 CAR-T细胞治疗在更大规模人群中的治疗浓度和安全性,包括剂量限制毒性和最大耐受剂量(NCT03874897,NCT03890198)。它们将提供疗效的证据。
结语
目前,全球还未有靶向Claudin18.2的药物上市,但全球研发已相继展开,其可能成为继HER-2之后胃癌的第二重要靶点。 参考文献: 1.CDE官网 2.clinicaltrials.gov 3.各公司官网 4.小药谈靶点:Claudin18.2

