综述:铁死亡与肝脏疾病
时间:2021-08-04 18:01:53 热度:37.1℃ 作者:网络
细胞死亡是生命活动过程中一项重要的生理或病理现象。铁死亡(ferroptosis)是新近发现的一种程序性死亡方式,在形态、生物化学、遗传学水平上,与其他类型的死亡方式如凋亡、坏死、自噬等明显不同[1]。铁死亡在多种疾病的发生发展过程中起重要作用,如帕金森病、缺血再灌注损伤、肿瘤等。近期研究[2-5]显示,在多种肝脏疾病中均发现不同程度的铁代谢紊乱和脂质过氧化物集聚等铁死亡特征,而调控铁死亡可以影响肝脏疾病进程。本文旨在总结和评价铁死亡的发生机制及在肝脏疾病中的作用与进展,为未来肝脏疾病诊疗水平的提升提供新思路。
1 概述
1.1 铁死亡的概念提出及特征
使用高通量筛选技术发现了最早的铁死亡诱导剂,erastin和ras选择性致死化合物(RSL3)。研究发现,凋亡、坏死和自噬抑制剂均不能抑制二者诱导的细胞死亡,相反,抗氧化剂和铁螯合剂可以抑制这一过程。随后证实这种细胞死亡方式与细胞内铁和自由基(ROS)有关[6-7]。2012年,Dixon等[1]将这种铁依赖性、脂质过氧化物集聚为特征的死亡方式命名为铁死亡。线粒体的变化是铁死亡的主要形态学特点,包括线粒体体积变小、膜密度增加以及线粒体减少或消失。在生化特征上,铁死亡表现为谷胱甘肽(GSH)耗竭、谷胱甘肽过氧化物酶4(GXP4)失活,脂质过氧化物集聚等。
1.2 铁死亡发生机制
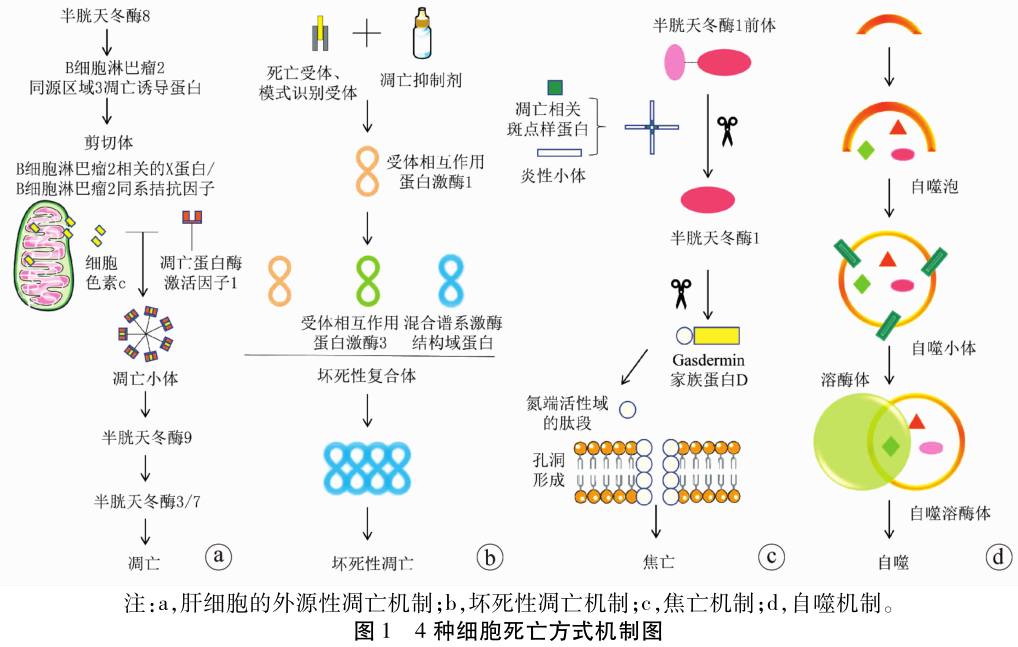
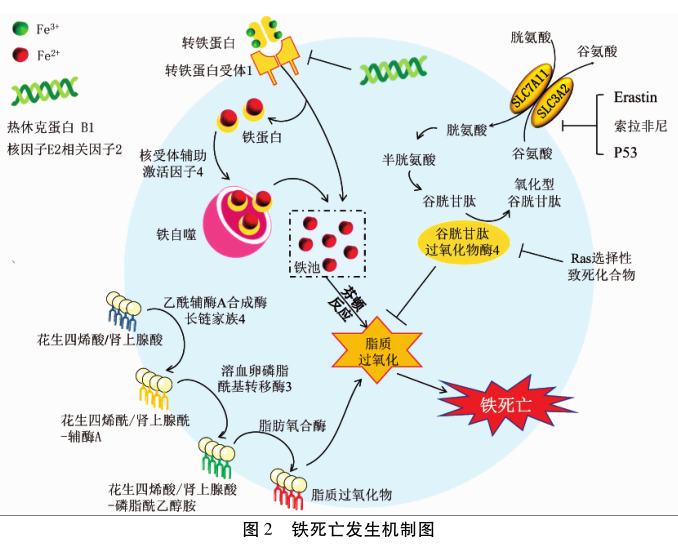
与目前已知的四种细胞死亡方式不同(图 1),铁死亡发生机制主要与铁代谢紊乱、氨基酸抗氧化系统失衡和脂质过氧化物集聚有关(图 2)。当铁代谢紊乱引起细胞内游离铁增多时,铁通过芬顿反应催化产生ROS,ROS进一步促进脂质过氧化,引起脂质过氧化物集聚,诱发铁死亡。位于细胞膜的胱氨酸/谷氨酸逆转运体(system XC-)参与GSH的合成,GPX4利用GSH为底物将脂质过氧化物还原为正常的脂质,防止脂质过氧化物集聚,抑制铁死亡发生[8]。因此,铁死亡是由GPX4清除过氧化物能力不足和/或脂质过氧化反应过强造成脂质过氧化物集聚,最终诱发细胞死亡。
1.2.1 氨基酸抗氧化系统失衡
氨基酸在铁死亡中扮演了重要角色。生理条件下,system XC-由溶质转运家族7A11(SLC7A11)和SLC3A2组成,将胱氨酸运输至细胞内并被还原为半胱氨酸,用于合成细胞内主要的抗氧化剂GSH。GSH是GPX4的一个必要辅因子,可将还原型GSH转化为氧化型GSH,同时还原脂质过氧化物,从而减轻氧化应激损伤[8]。Erastin、p53、索拉非尼通过抑制system XC-和/或GSH合成间接抑制GPX4活性[9-10],而RSL3能直接抑制GPX4活性[8],无论是间接或直接抑制GPX4,均会导致清除脂质过氧化物能力不足,细胞内脂质过氧化物集聚,诱发铁死亡。因而,system XC-和GPX4是铁死亡氨基酸代谢中的重要调控靶点。
1.2.2 铁代谢紊乱
血液循环中的Fe3+与转铁蛋白结合并运输,通过转铁蛋白受体1进入细胞后被还原并释放到胞质的不稳定铁池(LIP)中,而多余的铁贮存在铁蛋白中。胞内LIP,主要以Fe2+的形式存在,由于Fe2+的不稳定性和高反应活性,铁通过芬顿反应产生羟自由基,可直接与细胞膜、质膜中的多不饱和脂肪酸反应,产生大量脂质ROS,导致细胞死亡。核受体辅助激活因子4作为货物受体将铁蛋白靶向运至溶酶体并进行自噬性降解,进而释放游离铁,该过程被称为铁自噬,主要负责铁的释放和回收[11]。研究[6, 12]显示,增加铁蛋白降解或抑制铁蛋白表达,会增加胞内LIP,提高细胞对铁死亡的敏感性,相反,铁抑素及其衍生物、铁螯合剂通过减少细胞内铁离子含量或抑制多种催化脂质过氧化反应的含铁金属酶活性增加铁死亡抗性[13]。此外,核因子E2相关因子2 (NRF2)、热休克蛋白B1等基因通过抑制转铁蛋白受体1表达,影响铁代谢进而调节细胞对铁死亡的敏感性[14-15]。总之,铁吸收增加或铁储存减少均会影响细胞对铁死亡的敏感性。
1.2.3 脂质过氧化物集聚
脂质过氧化物集聚是铁死亡的核心,脂质代谢组学显示铁死亡过程中多不饱和脂肪酸如花生四烯酸(AA)或肾上腺酸(AdA)是最容易发生氧化反应的脂质,且受三种合成酶调控。乙酰辅酶A合成酶长链家族4(ACSL4)将AA或AdA催化为花生四烯酰-辅酶A和肾上腺酰-辅酶A,然后溶血卵磷脂酰基转移酶3 (LPCAT3)将其酯化为磷脂酰乙醇胺(PEs)形成AA-PE和AdA-PE,最后经脂肪氧合酶氧化为脂质过氧化物。研究[16-18]显示,敲除或抑制上述三种合成酶均可抑制铁死亡的发生发展。脂质过氧化物分解代谢生成毒性的醛类物质如4-羟基-2-壬烯醛或丙二醛,联合细胞膜、质膜上持续的氧化反应,最终造成细胞膜、质膜结构和功能不可逆破坏,导致细胞死亡[12]。
2 铁死亡与肝脏疾病的关系
肝损伤的类型取决于损伤的性质及严重程度,尽管不同性质的肝脏疾病可以由不同原因引起,但是肝脏病变由肝炎、肝纤维化、肝硬化甚至原发性肝癌演变的病理机制是相似的。研究显示,在肝脏疾病的不同发展阶段中,均发现铁代谢紊乱、氨基酸抗氧化系统失衡和脂质过氧化物集聚等铁死亡特征,而调控铁死亡可以影响肝脏疾病进程。因此,探究铁死亡在肝脏疾病中的作用,有助于为治疗肝脏疾病提供新策略。
2.1 铁死亡在肝脏炎症及纤维化中的作用
遗传性血色素沉着病(HH)是遗传性系统性铁过载,铁沉积在各个器官中,通过芬顿反应产生ROS,引起氧化损伤,最终导致严重的慢性并发症,包括肝硬化、糖尿病和心脏病。HH病理特点表现为铁调素-铁转运蛋白稳态失衡,由此导致铁过载。临床前研究[19]显示,HH小鼠模型肝内铁过载可以诱发肝细胞和巨噬细胞铁死亡。
酒精性肝病(ALD)是由于长期大量饮酒导致的肝脏疾病。研究[20]显示,ALD患者血清铁调素降低,而二价金属离子转运体在肠道中表达增加,导致血清中铁及铁蛋白水平增加。乙醇会破坏沉默调节蛋白1(SIRT1)的活性,Yin等[21]在比较乙醇喂养的敲除SIRT1小鼠与野生型小鼠研究中发现,敲除SIRT1会加重脂质代谢异常,促进肝脏脂质过氧化。这些特点提示ALD患者存在铁死亡的关键特征。然而,最近有研究[2]认为,肠道SIRT1失活能改善乙醇诱导的肝脏铁稳态失调,进而改善酒精性肝损伤,其认为,肠道SIRT1失活的这种肝脏保护作用与抑制铁死亡有一定关系。这与Yin等的发现相左,有关ALD肠道SIRT1与铁死亡的关系仍需进一步研究。
非酒精性脂肪性肝病(NAFLD)是一种与胰岛素抵抗和遗传易感密切相关的代谢应激性肝损伤。非酒精性脂肪性肝炎(NASH)是单纯性脂肪肝进展至肝硬化的中间阶段,目前尚不清楚单纯性脂肪肝向脂肪性肝炎转变的潜在机制。2020年初,由22个国家30位专家组成的国际专家小组发布的有关代谢相关脂肪性肝病(MAFLD) 新定义的国际专家共识[22],建议用“MAFLD”取代“NAFLD”。基于既往大量文献中使用NAFLD,在本文中仍然沿用此称谓。在NASH的发病机制中,脂质过氧化物集聚引起的氧化应激被认为是重要的起始因子,而代谢紊乱所致的铁沉积也被认为是NASH加重因素。因此,在NASH发病机制中可能存在铁死亡。Tsurusaki等[23]研究发现,在缺乏胆碱富含乙硫氨酸饮食小鼠模型中,应用铁死亡抑制剂可以抑制ALT、AST等肝损伤标志物和TNFα、IL-6等炎症细胞因子升高,其认为铁死亡是导致单纯性脂肪肝发展为NASH的诱因。随后,Li等[3]在蛋氨酸胆碱缺乏饮食小鼠模型中发现,铁死亡特征表现包括ROS集聚、线粒体形态改变和铁死亡相关基因上调等,抑制铁死亡能减轻小鼠肝损伤、炎症反应甚至纤维化程度。
肝纤维化是肝硬化的早期可逆阶段,是各种病因引起慢性肝损伤后的疤痕修复反应。其发生的中心环节是肝星状细胞(HSC)激活后导致的细胞外基质大量积累。靶向活化的HSC死亡是治疗肝纤维化的重要目标之一。Zhang等[24]研究发现,索拉非尼和erastin能靶向诱导HSC铁死亡,且这一过程与RNA结合蛋白胚胎致死性异常视觉基因1水平升高有关,进一步研究发现,其能稳定自噬相关蛋白Beclin-1的表达,促进整体自噬水平,诱导核受体辅助激活因子4与铁蛋白重链结合,降解铁蛋白,增加LIP,诱导HSC铁死亡。血红素加氧酶1(HO-1)是细胞铁死亡的关键调控因子。异甘草酸镁可上调HO-1表达,进而促进转铁蛋白、转铁蛋白受体、铁蛋白重链过表达,铁外排泵—膜铁转运蛋白低表达,导致细胞内铁沉积,脂质过氧化物集聚,诱发HSC铁死亡,抑制肝纤维化形成[25]。因此,靶向激活铁自噬及HO-1诱导HSC铁死亡或是治疗肝纤维化的新途径。
2.2 铁死亡在肝癌及索拉非尼耐药中的作用
肝细胞癌(HCC)是造成全球严重疾病负担的恶性肿瘤之一,在最常见的癌症中占第六位,在癌症相关死亡中占第二位。Louandre等[5]在研究HCC索拉非尼作用机理时发现HCC与铁死亡存在密切联系。近年来,有许多关于HCC与铁死亡的相关研究,已知的铁死亡在肝癌中的调控途径有:(1)铁死亡主要受system XC-和GPX4调控,影响system XC-或GPX4活性能诱导肝癌细胞铁死亡[26]。常见的铁死亡诱导剂erastin及索拉非尼均能通过抑制system XC-诱导铁死亡。Tang等[27]将索拉非尼装载到锰硅纳米颗粒中,通过双重耗竭GSH,诱发铁死亡。(2)p53是肿瘤抑制基因,通过调控铁死亡影响HCC发生发展。1)Jiang等[9]研究发现,p53下调SLC7A11转录,影响system XC-活性,进而诱导肝癌细胞铁死亡。2)p53上调精胺/精脒-N1-乙酰基转移酶1表达,使花生四烯酸15脂氧合酶水平升高,促进脂质过氧化物集聚,诱发铁死亡[28]。3)Gao等[29]发现铁死亡的发生需要谷氨酰胺和谷氨酰胺酶2。谷氨酰胺酶2是谷氨酰胺转化为谷氨酸的关键酶,调节GSH合成。p53上调谷氨酰胺酶2转录,其过表达抑制肿瘤细胞生长和集落形成。(3)其他的调控途径:CDGSH铁硫结构域1,一种线粒体铁输出蛋白,靶向抑制CDGSH铁硫结构域1,可以促进线粒体铁沉积和ROS生成,诱发铁死亡[30];miRNA-214通过抑制激动转录因子4表达,抑制GSH合成,诱导肝癌细胞铁死亡[31];抑癌基因BRCA1相关蛋白1通过抑制SLC7A11表达,诱发铁死亡[32]。总之,这些铁死亡在HCC中的分子机制均提示铁死亡在HCC的发生发展中扮演着重要角色。
索拉非尼,一种多激酶抑制剂,是首个获批用于晚期HCC患者的全身疗法。研究[5]显示,相较于索拉非尼激酶抑制活性的促凋亡效应,其通过抑制system XC-诱发肝癌细胞铁死亡效应更加显著。有研究报道,索拉非尼或许是通过调节肝细胞核因子4α(HNF4A)和肿瘤高甲基化基因1(HIC1)转录调控进而促进肝癌细胞铁死亡。Zhang等[33]发现了两类基因:铁死亡上调因子和铁死亡下调因子,其产物通过影响GSH合成而在调节肿瘤发生发展中发挥相反作用。铁死亡上调因子由HIC1调控,而铁死亡下调因子由HNF4A调控。他们发现与正常肝组织相比,肝癌中HNF4A上调,而HIC1下调,证实铁死亡在肝癌中受到抑制,erastin能破坏HNF4A和HIC1之间的平衡从而诱导肝癌细胞铁死亡,由于erastin与索拉非尼有相似的促进铁死亡作用,他们认为或许索拉非尼也通过此途径诱导铁死亡。这有待进一步研究证实。
尽管索拉非尼已被广泛用于临床,但治疗效果短暂,几乎所有患者在应用索拉非尼的几个月内就出现耐药性。研究发现,索拉非尼耐药与铁死亡密切相关:(1)索拉非尼激活p62-Keap1-NRF2途径增加肝癌细胞铁死亡抗性[14]。(2)Sun等[34]发现索拉非尼激活NRF2后,上调金属硫蛋白-1G,金属硫蛋白-1G通过阻断GSH耗竭介导的肝癌细胞脂质过氧化而发挥负性调节作用。(3)Bai等[35]首次证明在索拉非尼作用下的肝癌细胞,由于NRF2失活和随后ROS集聚,sigma受体表达被动上调并通过减少GSH消耗拮抗铁死亡;另一方面,该研究团队应用氟哌啶醇,一种sigma受体拮抗剂,确证其可以协同索拉非尼促进肝癌细胞铁死亡[36]。(4)在研究索拉非尼对蛋白质内稳态影响的实验中发现,索拉非尼抑制蛋白质生物合成,Sauzay等[37]认为这种抑制作用或许是肝癌细胞暴露于索拉非尼后产生的适应性应激反应,其保护肝癌细胞拮抗铁死亡。(5)视网膜母细胞瘤(Rb)蛋白是调节真核细胞多种基因转录功能的蛋白家族成员之一, 它主要作为细胞增殖、细胞周期进程的负性调节因子。Rb的功能丧失在HCC中很常见。研究[38]报道,Rb蛋白缺乏的肝癌细胞在暴露于索拉非尼时细胞死亡率比Rb蛋白水平正常的肝癌细胞高2~3倍,或许评估肝癌患者的Rb状态可用于判断肝癌患者应用索拉非尼的耐药性。以上铁死亡参与的肝癌索拉非尼耐药机制可能为解决索拉非尼耐药提供新思路。
2.3 铁死亡在其他肝病中的作用
药物性肝损伤(DILI)是指由药物本身或其代谢产物等引起的肝损伤。对乙酰氨基酚(APAP)是常用的解热镇痛药,过量服用APAP是诱发DILI最主要的原因之一。其特征为GSH耗竭,GPX受抑制和不依赖于凋亡相关的半胱氨酸天冬氨酸蛋白酶,这与铁死亡的特征高度契合。Lörincz等[4]对比铁死亡抑制剂、坏死性凋亡抑制剂和抗氧化剂在不同APAP浓度下肝细胞活力,发现给予小鼠高浓度的APAP(10 mmol/L)时,铁死亡抑制剂Fer-1有明显的抑制肝细胞损伤作用,而更高浓度(20 mmol/L)时,这种保护作用更加显著。自身免疫性肝病患者血清中铁调素水平低于正常人,提示可能出现肝内铁过载,在刀豆蛋白A诱发的小鼠急性肝损伤模型中,小窝蛋白1通过抑制活性氮集聚增加肝细胞铁死亡抗性[39]。阻断肝期疟原虫感染的肝细胞SLC7A11-GPX4通路使脂质过氧化物集聚,诱导铁死亡发生,可以清除肝期疟疾感染[40]。
3 展望
铁死亡是一个复杂的细胞死亡过程,其发生机制涉及多种调控因素。近年来的研究进展为铁死亡的分子机制提供了新的认识,特别是铁死亡与细胞代谢的关系,但仍存在许多关键问题尚待解决,例如,最终诱发铁死亡的分子是什么?脂质过氧化物集聚是如何引发铁死亡的?调控铁死亡的主要代谢过程如铁、氨基酸、脂质代谢是如何相互联系,最终决定细胞是生存还是铁死亡?此外,铁死亡与多种人类疾病尤其是肝脏疾病的相关性也已得到很好的证实,铁死亡的提出为解决各类肝脏疾病尤其是HCC、HCC索拉菲尼耐药等问题提供了新的研究方向和思路,但是铁死亡在多大程度上影响肝脏疾病的发生发展仍不清楚,而铁死亡在各类肝脏疾病中的作用也不尽相同,需要更加深入地了解铁死亡的分子机制及在肝脏疾病中的作用,为各类肝脏疾病提供新的治疗策略。
图文来源:临床肝胆病杂志

参考文献:
[1] DIXON SJ, LEMBERG KM, LAMPRECHT MR, et al. Ferroptosis: An iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI: 10.1016/j.cell.2012.03.042.
[2] ZHOU Z, YE TJ, DECARO E, et al. Intestinal SIRT1 deficiency protects mice from ethanol-induced liver injury by mitigating ferroptosis[J]. Am J Pathol, 2020, 190(1): 82-92. DOI: 10.1016/j.ajpath.2019.09.012.
[3] LI X, WANG TX, HUANG X, et al. Targeting ferroptosis alleviates methionine-choline deficient (MCD)-diet induced NASH by suppressing liver lipotoxicity[J]. Liver Int, 2020, 40(6): 1378-1394. DOI: 10.1111/liv.14428.
[4] LÖRINCZ T, JEMNITZ K, KARDON T, et al. Ferroptosis is involved in acetaminophen induced cell death[J]. Pathol Oncol Res, 2015, 21(4): 1115-1121. DOI: 10.1007/s12253-015-9946-3.
[5] LOUANDRE C, EZZOUKHRY Z, GODIN C, et al. Iron-dependent cell death of hepatocellular carcinoma cells exposed to sorafenib[J]. Int J Cancer, 2013, 133(7): 1732-1742. DOI: 10.1002/ijc.28159.
[6] YANG WS, STOCKWELL BR. Synthetic lethal screening identifies compounds activating iron-dependent, nonapoptotic cell death in oncogenic-RAS-harboring cancer cells[J]. Chem Biol, 2008, 15(3): 234-245. DOI: 10.1016/j.chembiol.2008.02.010.
[7] DOLMA S, LESSNICK SL, HAHN WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3(3): 285-296. DOI: 10.1016/s1535-6108(03)00050-3.
[8] YANG WS, SRIRAMARATNAM R, WELSCH ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1-2): 317-331. DOI: 10.1016/j.cell.2013.12.010.
[9] JIANG L, KON N, LI T, et al. Ferroptosis as a p53-mediated activity during tumour suppression[J]. Nature, 2015, 520(7545): 57-62. DOI: 10.1038/nature14344.
[10] SATO M, KUSUMI R, HAMASHIMA S, et al. The ferroptosis inducer erastin irreversibly inhibits system xc- and synergizes with cisplatin to increase cisplatin's cytotoxicity in cancer cells[J]. Sci Rep, 2018, 8(1): 968. DOI: 10.1038/s41598-018-19213-4.
[11] MANCIAS JD, WANG X, GYGI SP, et al. Quantitative proteomics identifies NCOA4 as the cargo receptor mediating ferritinophagy[J]. Nature, 2014, 509(7498): 105-109. DOI: 10.1038/nature13148.
[12] KAGAN VE, MAO G, QU F, et al. Oxidized arachidonic and adrenic PEs navigate cells to ferroptosis[J]. Nat Chem Biol, 2017, 13(1): 81-90. DOI: 10.1038/nchembio.2238.
[13] BRUNI A, PEPPER AR, PAWLICK RL, et al. Ferroptosis-inducing agents compromise in vitro human islet viability and function[J]. Cell Death Dis, 2018, 9(6): 595. DOI: 10.1038/s41419-018-0506-0.
[14] SUN X, OU Z, CHEN R, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells[J]. Hepatology, 2016, 63(1): 173-184. DOI: 10.1002/hep.28251.
[15] SUN X, OU Z, XIE M, et al. HSPB1 as a novel regulator of ferroptotic cancer cell death[J]. Oncogene, 2015, 34(45): 5617-5625. DOI: 10.1038/onc.2015.32.
[16] DOLL S, PRONETH B, TYURINA YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1): 91-98. DOI: 10.1038/nchembio.2239.
[17] DIXON SJ, WINTER GE, MUSAVI LS, et al. Human haploid cell genetics reveals roles for lipid metabolism genes in nonapoptotic cell death[J]. ACS Chem Biol, 2015, 10(7): 1604-1609. DOI: 10.1021/acschembio.5b00245.
[18] SHINTOKU R, TAKIGAWA Y, YAMADA K, et al. Lipoxygenase-mediated generation of lipid peroxides enhances ferroptosis induced by erastin and RSL3[J]. Cancer Sci, 2017, 108(11): 2187-2194. DOI: 10.1111/cas.13380.
[19] WANG H, AN P, XIE E, et al. Characterization of ferroptosis in murine models of hemochromatosis[J]. Hepatology, 2017, 66(2): 449-465. DOI: 10.1002/hep.29117.
[20] DOSTALIKOVA-CIMBUROVA M, BALUSIKOVA K, KRATKA K, et al. Role of duodenal iron transporters and hepcidin in patients with alcoholic liver disease[J]. J Cell Mol Med, 2014, 18(9): 1840-1850. DOI: 10.1111/jcmm.12310.
[21] YIN H, HU M, LIANG X, et al. Deletion of SIRT1 from hepatocytes in mice disrupts lipin-1 signaling and aggravates alcoholic fatty liver[J]. Gastroenterology, 2014, 146(3): 801-811. DOI: 10.1053/j.gastro.2013.11.008.
[22] ESLAM M, NEWSOME PN, SARIN SK, et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement[J]. J Hepatol, 2020, 73(1): 202-209. DOI: 10.1016/j.jhep.2020.03.039.
[23] TSURUSAKI S, TSUCHIYA Y, KOUMURA T, et al. Hepatic ferroptosis plays an important role as the trigger for initiating inflammation in nonalcoholic steatohepatitis[J]. Cell Death Dis, 2019, 10(6): 449. DOI: 10.1038/s41419-019-1678-y.
[24] ZHANG Z, YAO Z, WANG L, et al. Activation of ferritinophagy is required for the RNA-binding protein ELAVL1/HuR to regulate ferroptosis in hepatic stellate cells[J]. Autophagy, 2018, 14(12): 2083-2103. DOI: 10.1080/15548627.2018.1503146.
[25] SUI M, JIANG X, CHEN J, et al. Magnesium isoglycyrrhizinate ameliorates liver fibrosis and hepatic stellate cell activation by regulating ferroptosis signaling pathway[J]. Biomed Pharmacother, 2018, 106: 125-133. DOI: 10.1016/j.biopha.2018.06.060.
[26] ZHANG X, SUI S, WANG L, et al. Inhibition of tumor propellant glutathione peroxidase 4 induces ferroptosis in cancer cells and enhances anticancer effect of cisplatin[J]. J Cell Physiol, 2020, 235(4): 3425-3437. DOI: 10.1002/jcp.29232.
[27] TANG H, CHEN D, LI C, et al. Dual GSH-exhausting sorafenib loaded manganese-silica nanodrugs for inducing the ferroptosis of hepatocellular carcinoma cells[J]. Int J Pharm, 2019, 572: 118782. DOI: 10.1016/j.ijpharm.2019.118782.
[28] OU Y, WANG SJ, LI D, et al. Activation of SAT1 engages polyamine metabolism with p53-mediated ferroptotic responses[J]. Proc Natl Acad Sci U S A, 2016, 113(44): e6806-e6812. DOI: 10.1073/pnas.1607152113.
[29] GAO M, MONIAN P, QUADRI N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Mol Cell, 2015, 59(2): 298-308. DOI: 10.1016/j.molcel.2015.06.011.
[30] YUAN H, LI X, ZHANG X, et al. CISD1 inhibits ferroptosis by protection against mitochondrial lipid peroxidation[J]. Biochem Biophys Res Commun, 2016, 478(2): 838-844. DOI: 10.1016/j.bbrc.2016.08.034.
[31] BAI T, LIANG R, ZHU R, et al. MicroRNA-214-3p enhances erastin-induced ferroptosis by targeting ATF4 in hepatoma cells[J]. J Cell Physiol, 2020, 235(7-8): 5637-5648. DOI: 10.1002/jcp.29496.
[32] ZHANG Y, SHI J, LIU X, et al. BAP1 links metabolic regulation of ferroptosis to tumour suppression[J]. Nat Cell Biol, 2018, 20(10): 1181-1192. DOI: 10.1038/s41556-018-0178-0.
[33] ZHANG X, DU L, QIAO Y, et al. Ferroptosis is governed by differential regulation of transcription in liver cancer[J]. Redox Biol, 2019, 24: 101211. DOI: 10.1016/j.redox.2019.101211.
[34] SUN X, NIU X, CHEN R, et al. Metallothionein-1G facilitates sorafenib resistance through inhibition of ferroptosis[J]. Hepatology, 2016, 64(2): 488-500. DOI: 10.1002/hep.28574.
[35] BAI T, LEI P, ZHOU H, et al. Sigma-1 receptor protects against ferroptosis in hepatocellular carcinoma cells[J]. J Cell Mol Med, 2019, 23(11): 7349-7359. DOI: 10.1111/jcmm.14594.
[36] BAI T, WANG S, ZHAO Y, et al. Haloperidol, a sigma receptor 1 antagonist, promotes ferroptosis in hepatocellular carcinoma cells[J]. Biochem Biophys Res Commun, 2017, 491(4): 919-925. DOI: 10.1016/j.bbrc.2017.07.136.
[37] SAUZAY C, LOUANDRE C, BODEAU S, et al. Protein biosynthesis, a target of sorafenib, interferes with the unfolded protein response (UPR) and ferroptosis in hepatocellular carcinoma cells[J]. Oncotarget, 2018, 9(9): 8400-8414. DOI: 10.18632/oncotarget.23843.
[38] LOUANDRE C, MARCQ I, BOUHLAL H, et al. The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells[J]. Cancer Lett, 2015, 356(2 Pt B): 971-977. DOI: 10.1016/j.canlet.2014.11.014.
[39] DENG G, LI Y, MA S, et al. Caveolin-1 dictates ferroptosis in the execution of acute immune-mediated hepatic damage by attenuating nitrogen stress[J]. Free Radic Biol Med, 2020, 148: 151-161. DOI: 10.1016/j.freeradbiomed.2019.12.026.
[40] KAIN HS, GLENNON E, VIJAYAN K, et al. Liver stage malaria infection is controlled by host regulators of lipid peroxidation[J]. Cell Death Differ, 2020, 27(1): 44-54. DOI: 10.1038/s41418-019-0338-1.


