Circulation:西湖大学常兴团队利用碱基编辑,为治愈杜氏肌营养不良症带来希望
时间:2021-11-17 06:02:35 热度:37.1℃ 作者:网络
杜氏肌营养不良症(DMD)是一种单基因遗传性疾病,患者在童年时期骨骼肌功能开始弱化,10岁左右失去行走能力,最终会因为心肺功能的严重损伤而在20-30岁左右去世。其发病原因在于DMD基因突变,造成肌营养不良蛋白Dystrophin表达缺失,引发骨骼肌和心肌的严重缺陷。
作为最常见的致死性遗传病之一,估计每3500-5000个新生男性中会出现一位DMD患者。尽管在过去30年中,学术界积累了大量针对DMD的基础和临床研究成果,然而目前尚未开发出高效、精准的治疗手段,病人的生命预期以及生活质量并没有得到显着的改善。
近年来,基因编辑技术的迅速发展,为DMD等单基因遗传疾病的治疗带来了新的希望。人类遗传学和分子生物学研究证明,通过诱导外显子跳读,恢复DMD基因的读码框,从而产生部分缺失并同时保留生物学功能的Dystrophin蛋白,是治疗杜氏肌营养不良症这一疾病的有效策略。
近日,西湖大学生命科学院常兴课题组在 Circulation 杂志在线发表了题为:Therapeutic Exon Skipping via a CRISPR-guided Cytidine Deaminase Rescues Dystrophic Cardiomyopathy In Vivo 的研究论文。
该研究证明利用CRISPR-AID(TAM)碱基编辑器,可以在小鼠模型中高效诱导外显子跳读,恢复Dystrophin蛋白表达,治愈杜氏肌营养不良症。

西湖大学常兴研究员为本文通讯作者,助理研究员李甲博士为本文第一作者。
此前,常兴课题组自主开发了CRISPR-AID(TAM)碱基编辑器(Nature Methods-2016),并在此基础上创建了针对RNA剪接的遗传操作体系(Molecular Cell-2018)。
为了探索这一基因编辑系统对于DMD的治疗效果,研究团队首先鉴定了一种新的小鼠模型---DmdE4*。该小鼠的寿命缩短(约50%)、进行性心肌病、脊柱形态异常、肌肉功能衰退等症状,更好地模拟了DMD病人的心脏病理进程。
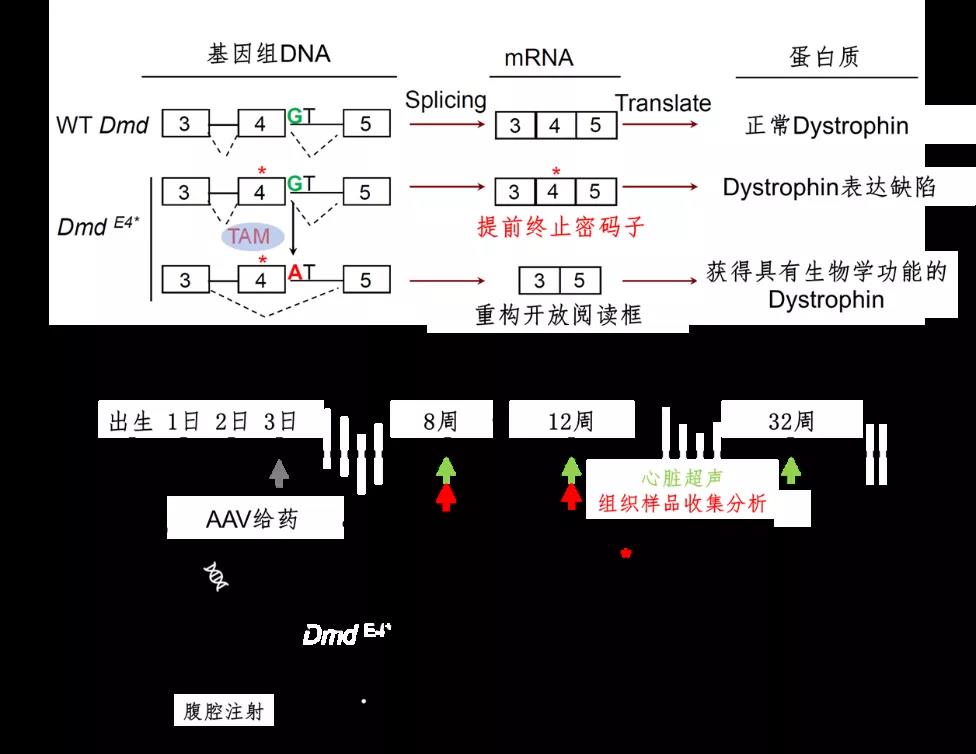
图1 针对DmdE4*小鼠的基因治疗原理(A)和治疗方案(B)
针对这一模型,研究团队以携带致病突变的外显子为目标,利用Cas9-AID碱基编辑器,在目的外显子5'剪接位点诱导G>A突变,使其发生外显子跳读,恢复Dystrophin蛋白的表达,实现修复心肌和骨骼肌的功能(图1A)。随后设计AAV9载体,针对DmdE4*小鼠进行了基因治疗 (图1B)。在经过治疗的DmdE4*小鼠中,心肌及多个肌肉组织中均可以观察到致病外显子发生了跳读,并因此恢复了Dystrophin蛋白的表达(图2A),同时心肌损伤的表型也得到了修复,最终成功延长了DmdE4*小鼠的生存期(图2B)。

图2 针对DmdE4*小鼠的基因治疗效果,A 经过治疗一年后小鼠心脏中Dystrophin(红色)和Sarcoglycan(绿色)蛋白表达恢复;B 经过治疗的小鼠(红色)生存期得到了明显的提高。
该研究初步证明了此基因编辑方案对于治疗DMD的有效性、安全性和持久性。相比较其他DMD的实验性治疗方案,利用CRISPR-AID碱基编辑器,直接诱导碱基置换,不引发DNA双链断裂,具有更精确和更安全的优点。因此该研究对于DMD这一疾病的药物开发以及病理研究均具有重要的科研意义。
同时,常兴团队的研究成果已经完成了初步的成果转化,与国内新兴的基因治疗公司合作,致力于尽快攻克DMD等传统方法难以治愈的遗传性疾病。
原始出处:
Jia Li , Kaiying Wang , Yuchen Zhang, et al. Therapeutic Exon Skipping via a CRISPR-guided Cytidine Deaminase Rescues Dystrophic Cardiomyopathy In Vivo. Circulation, 2021.


