【Hemasphere】德国124例继发性CNS淋巴瘤的治疗策略和预后因素
时间:2023-07-30 17:34:55 热度:37.1℃ 作者:网络
继发性CNS淋巴瘤
继发性中枢神经系统淋巴瘤(SCNSL)的临床管理极具挑战性,由于缺乏SCNSL特异性研究,治疗概念多从PCNSL转移而来。在PCNSL中,大剂量甲氨蝶呤(HD-MTX)仍是这些方案的基础,通常辅以阿糖胞苷(AraC)、塞替派(TT)或异环磷酰胺(IFO)。具体而言,HD-MTX、AraC、TT和利妥昔单抗联合治疗(称为MATRix方案)已成为欧洲PCNSL患者广泛接受的治疗方案。诱导治疗(如MATRix)后给予巩固治疗,包括大剂量化疗和自体干细胞移植(HDT-ASCT)或全脑放射治疗(WBRT);两种方案在基于HD-MTX的诱导后的年轻患者中均有效且可行,并获得了有前景的生存率。
目前已发表了4项治疗SCNSL的前瞻性研究,但均缺乏对照组,因此无法证明哪个方案更优,导致在为患者选择诱导治疗时仍存在不确定性。此外尽管SCNSL的标准治疗似乎是HDT-ASCT强化巩固治疗,但大多数患者最终并未接受HDT-ASCT。
总的来说,关于SCNSL的最佳治疗仍有多个问题有待回答。因此德国学者开展一项多中心、回顾性研究,旨在评估和比较三级血液中心在真实世界中采用的当前治疗概念的疗效和可行性,希望可以回答SCNSL患者的诱导策略,评估HDT-ASCT和其他预后临床因素的作用。研究结果近日发表于《Hemasphere》。
研究结果
作者收集了5家中心2008年至2020年间接受根治性治疗的SCNSL患者的回顾性数据。入选标准如下:(a)经组织病理学、细胞学和影像学确定的系统性B细胞淋巴瘤累及CNS的患者;(B)成人(≥18岁);(c)计划进行根治性强化系统治疗的患者。排除仅计划接受HD-MTX和/或WBRT的患者。
研究队列
共纳入2008年至2020年间在德国5家三级血液中心接受强化治疗的124例患者。患者具有不同的B细胞淋巴瘤亚型,将其分为低度恶性淋巴瘤、弥漫性大B细胞淋巴瘤(DLBCL)和其他侵袭性淋巴瘤(图1A)。
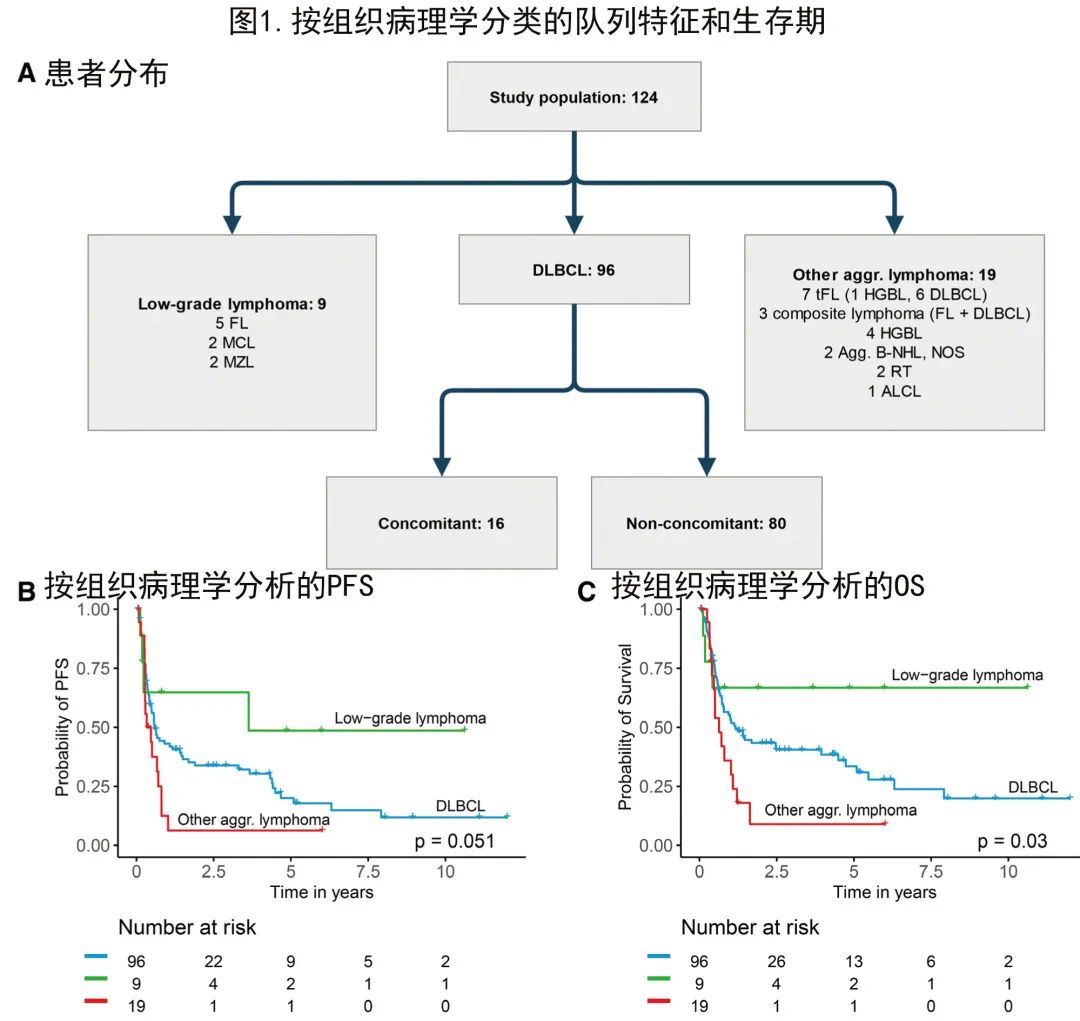
DLBCL共96例,是本队列中最常见的组织病理学(DLBCL-SCNSL;表1)。其他侵袭性淋巴瘤占19例患者,包括转化型滤泡性淋巴瘤(tFL)、同时存在FL和DLBCL的复合淋巴瘤、高级别B细胞淋巴瘤(HGBL)、侵袭性淋巴瘤非特指型、Richter转化和间变性大细胞淋巴瘤(ALCL)。低级别淋巴瘤是最小亚组(9例患者),包括FL、套细胞淋巴瘤和边缘区淋巴瘤(表1)。
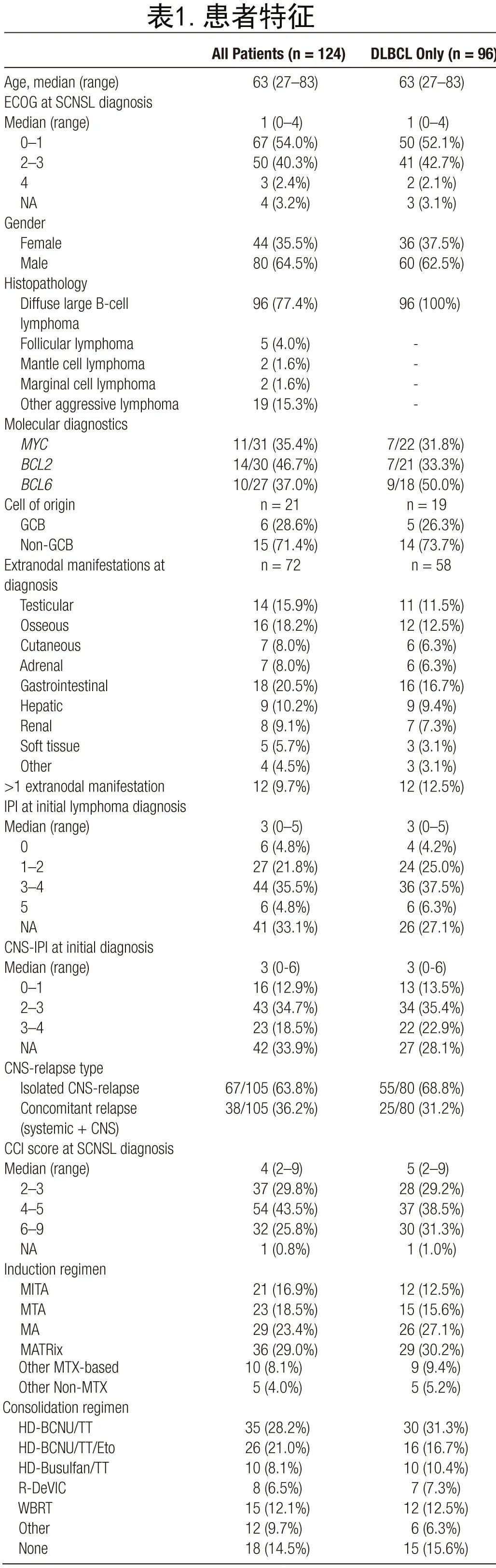
具体到DLBCL-SCNSL队列,16例患者在初诊时诊断为同步全身受累(新发SCNSL)。大多数患者(n=80)为复发性或难治性DLBCL-SCNSL,其中55例有孤立的CNS表现,而25例也表现出伴随的全身复发。58例(60%)DLBCL-SCNSL患者在初次诊断时诊断为结外淋巴瘤表现。包括IPI、CNS-IPI分布和初诊时淋巴瘤表现在内的所有特征列于表1。
SCNSL的组织病理学是预后因素
首先分析了组织病理学淋巴瘤亚组对临床结局的影响。生存分析显示OS存在明显差异(对数秩P=0.03),其中低级别淋巴瘤是预后最佳的亚型,其他侵袭性淋巴瘤是预后最差的亚型,DLBCL介于这2个亚组之间。该分析表明,组织病理学确实是SCNSL结局预测的重要因素(图1)。
诱导治疗在DLBCL-SCNSL预后因素中的作用
接下来分析了诱导治疗的反应作为DLBCL-SCNSL生存的假定预后因素,因此比较了缓解者(完全[CR]或部分缓解[PR])和非缓解者(疾病稳定[SD]或疾病进展[PD])。正如预期,与无缓解患者相比,早期缓解DLBCL-SCNSL患者的PFS(中位PFS 3.7个月vs 39.0个月;时间依赖性cox P<0.01;图2A)和OS(中位OS 7.2个月vs 55.8个月;时间依赖性cox P<0.01;图2B)均显著更好。这些结果强调,即使排除了潜在的先导时间偏倚,诱导治疗应答也是DLBCL-SCNSL真实世界环境中的重要预后因素。
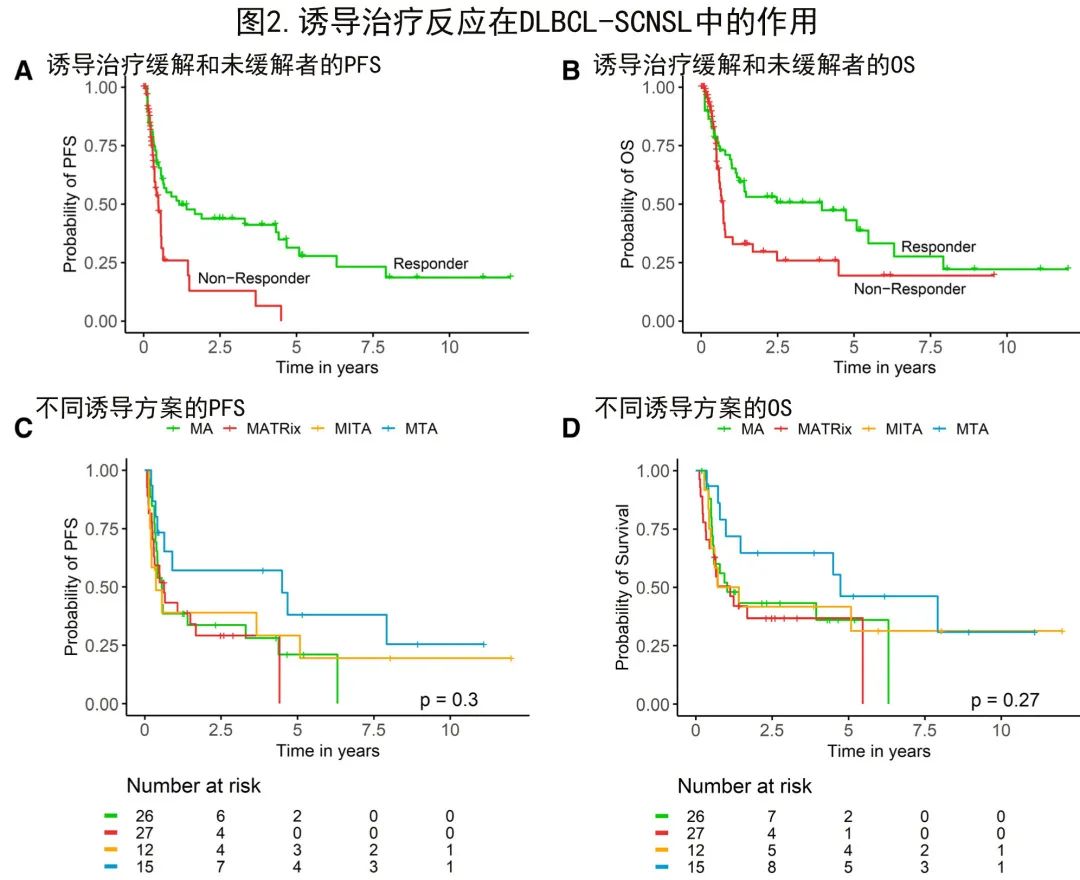
治疗分为5种诱导方案:26例(27%)患者HD-MTX/AraC (MA)、29例(30%)患者MATRix方案、12例(13%)患者HD-MTX/IFO/AraC/TT (MITA)、15例(16%)患者HD-MTX/AraC/TT (MTA)和14例患者(15%)其他方案。1例患者在诱导治疗开始前死亡。5例患者仅接受了R-TT/AraC,其中2例患者随后接受了HDT-ASCT,导致1例患者持续长期缓解>5年。
作者假设更好的初始治疗反应可带来总体更优的结局,并评估了最初接受上述详细方案治疗的患者的生存期。接受MA、MATRix、MITA和MTA治疗的患者的中位PFS分别为6.6、7.5、4.4和52.9个月,中位OS分别为12.1、13.3、12.6和55.8个月;中位PFS和OS的这些差异无统计学显著性,很可能是由于每组中的患者数量较少(PFS的对数秩P=0.3;图2 C;OS的对数秩P=0.27;图2D)。值得注意的是,在最终接受HDT-ASCT的MATRix诱导患者中,OS有积极变化的趋势。总之,本研究未发现任何类型的诱导治疗是主要的预后因素。
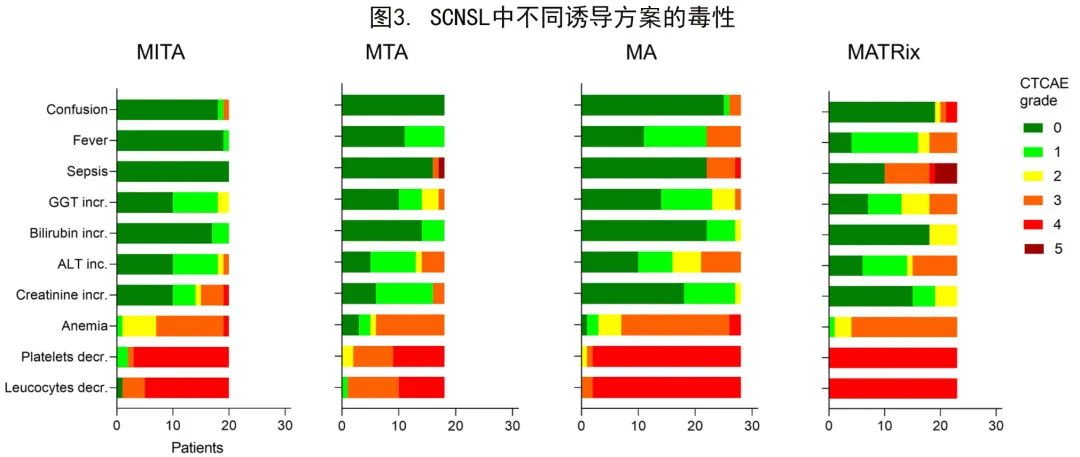
毒性分析
生存数据分析仅限于DLBCLSCNSL亚组,但考虑到组织病理学不影响药物副作用,在整个队列中评价了CTCAE分级评估的毒性。89例患者的详细毒性数据可用(图3)。所有方案均具有显著的血液学毒性,大多数患者(89%;79/89)为4级毒性。但MTA方案是唯一例外:18例患者中仅11例(61%)发生CTCAE 4级血液毒性。5级事件仅在MATRix治疗组的4名患者和MTA治疗组的1名患者中报告,表现为感染。
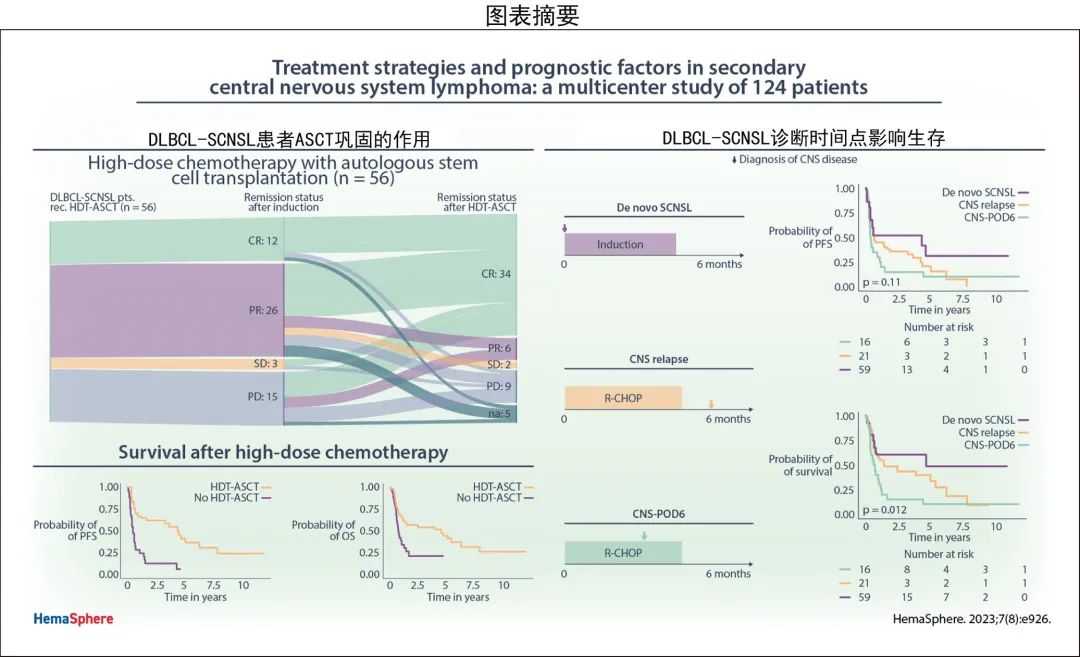
HDT-ASCT巩固的作用
在PCNSL中,诱导治疗后的巩固治疗是标准治疗。考虑到CNS放疗的神经系统长期副作用,巩固性HDT-ASCT大部分取代了WBRT。采用这种治疗模式,HDT-ASCT也是SCNSL的新兴标准。
因此在DLBCL-SCNSL队列中评估了HDT-ASCT对预后的影响(图4)。在96例DLBCL-SCNSL患者中,56例(58%)接受了HDT-ASCT巩固治疗,而WBRT仅应用于12例(12.5%)患者(表1)。所有DLBCL-SCNSL患者均接受了基于TT的预处理方案治疗,包括联合BCNU(46/56;82%)或白消安(10/56;18%;表1)。16例(16.7%)患者在BCNU/TT方案中添加了依托泊苷(总剂量450 mg/m2)。
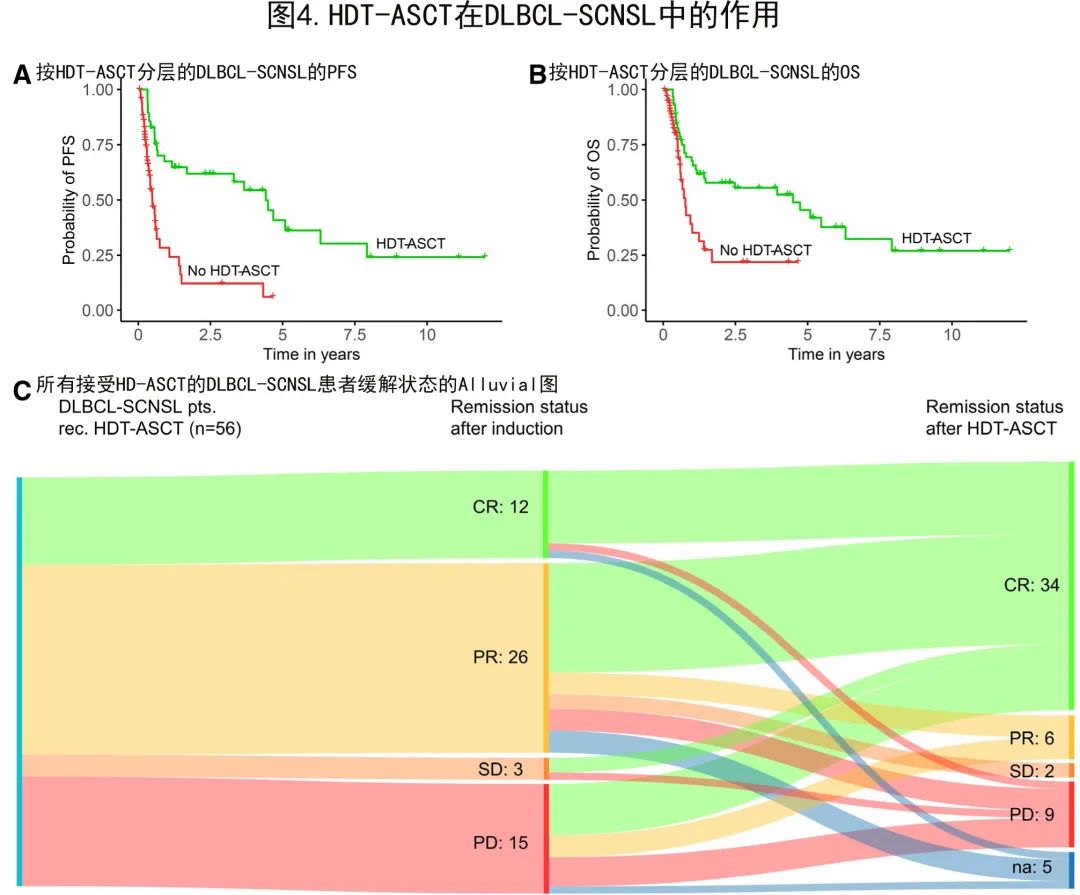
控制假定先导时间偏倚的生存分析显示,完成HDT-ASCT患者的中位PFS(有和无HDT-ASCT患者分别为39.0个月和4.6个月,时间依赖性cox P<0.001;图4A)和中位OS(有和无HDT-ASCT患者分别为55.8个月和6.9个月,时间依赖性cox P=0.02;图4B)更优。仅2例(3.7%)患者在HDT-ASCT期间死亡,强调了其在SCNSL真实世界环境中的可行性。
诱导后未达到CR的44例DLBCL-SCNSL患者中,有31例(71%)在HDT-ASCT后缓解状态改善。值得注意的是,18例在诱导治疗期间SCNSL进展或稳定的患者仍接受HDT-ASCT,其中12例(67%)在HDT-ASCT后出现有临床意义的缓解(CR 9例患者,PR 3例患者)(图4 C);其中3例(17%)对诱导难治但HDT-ASCT巩固治疗的患者达到了持久的长期生存(>5年),该患者亚组的2年OS为44%。
总体而言,HDT-ASCT在DLBCL-SCNSL中至关重要,缓解状态和生存期均明显改善。对于诱导难治性SCNSL这一极具挑战性的情况,给予HDT-ASCT可诱导部分患者缓解和长期生存。
SCNSL诊断时间点作为预后因素
假设SCNSL诊断的时间点可能具有预后相关性,SCNSL队列分为三种临床情况(图5A):初诊时同时出现CNS和系统性淋巴瘤表现(新发SCNSL;De novo SCNSL);系统性淋巴瘤初诊后6个月内出现SCNSL的早期表现(CNS-POD6);淋巴瘤初诊后>6个月后出现SCNSL(CNS复发)。
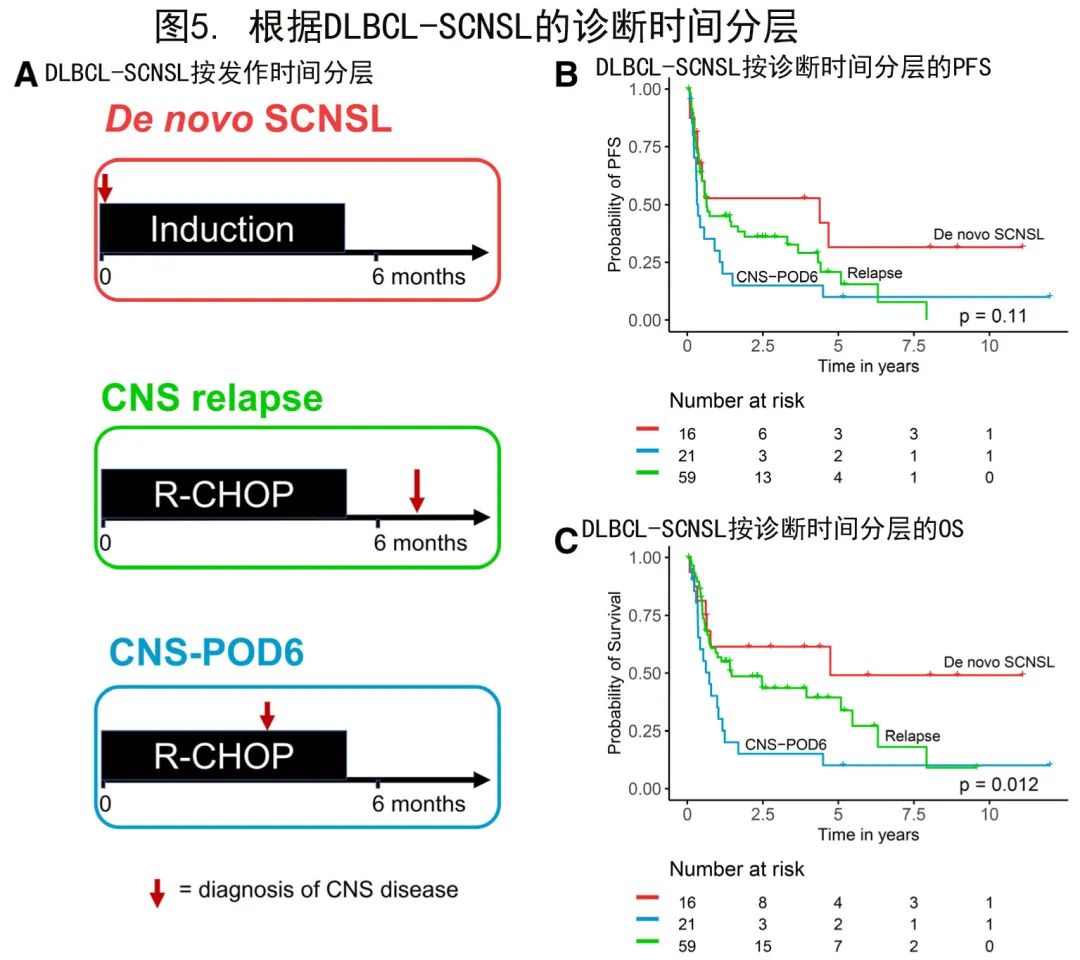
基于该临床分层分别分析了DLBCL-SCNSL患者的生存期。新发SCNSL、CNS复发和CNS-POD6患者的中位PFS分别为51.7个月、7.5个月和4.2个月(对数秩P=0.11;图5B),中位OS分别为55.8个月、17.3个月和8.6个月(对数秩P=0.01;图5C)。这些数据表明,基于CNS疾病发作时间区分SCNSL患者是一种有意义的预后工具,应在未来的临床研究中进行正交验证和考虑。
新发DLBCL-SCNSL
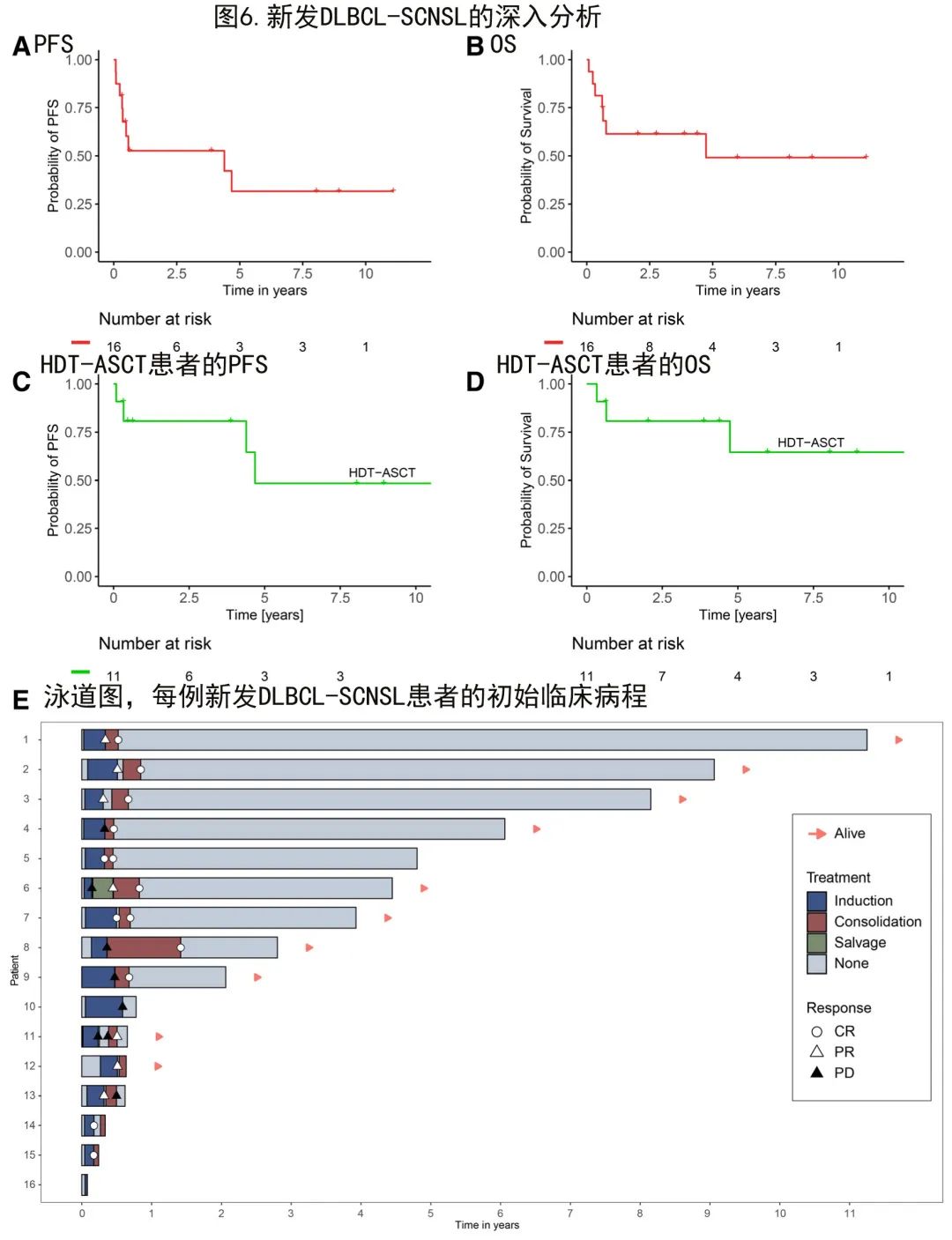
初诊时新发全身和CNS淋巴瘤尤其罕见,缺乏治疗建议,因此对该SCNSL亚型进行了详细分析(图6)。96例DLBCL-SCNSL患者中共有16例(17%)为新发SCNSL,表现出良好的PFS(中位PFS 51.7个月;图6A)和良好的OS(中位OS 55.8个月;图6B)。其中大多数患者接受了HDT-ASCT(11/16例患者;69%),这些强化治疗患者表现出极好的PFS(中位数55.1个月;图6 C)和OS(未达到中位数;图6D)。值得注意的是,唯一一例没有接受过HDT-ASCT的长期幸存者最终接受了CAR-T细胞治疗;剩下4例未接受HDT-ASCT的患者死于败血症(n=2)和PD(n=2,其中1例拒绝挽救治疗)。每例患者的临床病程见图6E。
多变量分析
为进一步评估DLBCL-SCNSL中确定的临床风险因素的统计学显著性,在多变量分析中对其进行了检验(图7)。对于PFS,诱导治疗反应和HDT-ASCT是显著的预后因素(P=0.01和P=0.016;图7A)。DLBCL-SCNSL诊断时间分层模型中CNS-POD6具有显著性(P=0.046),但CNS复发无显著性(P=0.171)。
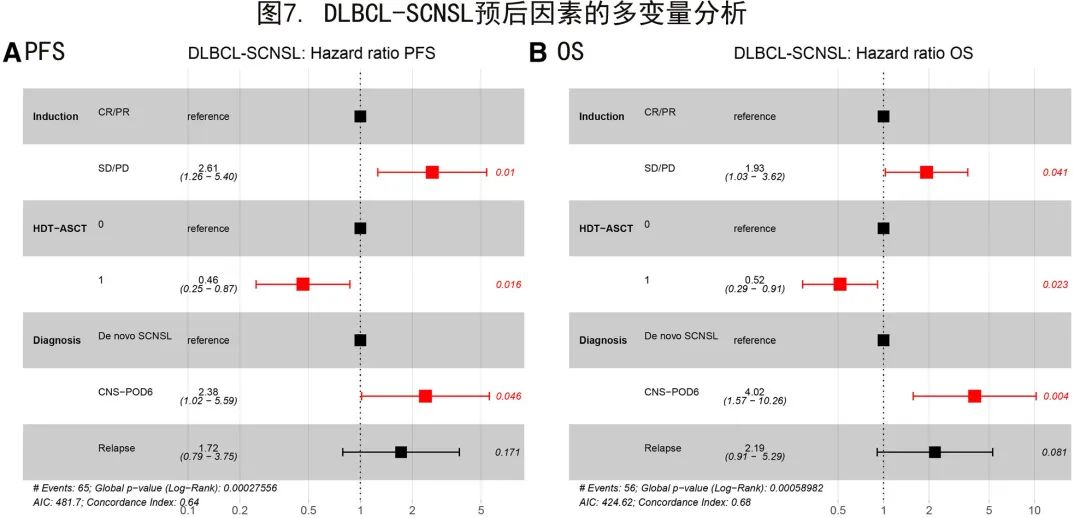
对于OS,诱导治疗反应(P=0.041)和完成HDT-ASCT (P=0.023)是显著的预后参数。此外,CNS-POD6达到显著性(P=0.004),但CNS复发未达到显著性(P=0.081;图7B)。
总结
继发性中枢神经系统淋巴瘤(SCNSL)是一种罕见且治疗困难的非霍奇金淋巴瘤类型,以全身和中枢神经系统(CNS)疾病表现为特征。本研究纳入真实世界中124例接受强化治疗并接受临床长期随访的SCNSL患者并分析治疗策略和相关预后因素。初始组织病理学分为低度恶性、其他侵袭性和弥漫性大B细胞淋巴瘤(DLBCL),病理分型具有预后意义。与无缓解者相比,诱导治疗的总体缓解是早期缓解DLBCL-SCNSL的预后因素,其无进展生存期(PFS)和总生存期(OS)显著更佳。但诱导方案的类型并不能预测生存率。大剂量化疗和自体干细胞移植(HDT-ASCT)巩固后,DLBCL-SCNSL患者的中位PFS和OS更好;诱导治疗无效患者的有利缓解和生存期以及新发DLBCL-SCNSL患者的极佳结果(65%长期生存率),进一步强调了HDT-ASCT的重要作用。系统性淋巴瘤初诊后6个月内疾病进展出现SCNSL的早期表现 (CNS-POD6)是一个以前未被重视的亚组,结局特别令人沮丧;SCNSL诊断时间分层模型显示,6个月内CNS疾病进展是未来研究的一种有前景的候选预测因子。
参考文献
Treiber H,et al. Treatment Strategies and Prognostic Factors in Secondary Central Nervous System Lymphoma: A Multicenter Study of 124 Patients.Hemasphere . 2023 Jul 21;7(8):e926. doi: 10.1097/HS9.0000000000000926. eCollection 2023 Aug.


