Cancer Res | 浙江中医药大学何强团队发现肾细胞癌的肿瘤进展的调控新机制
时间:2023-01-10 12:02:39 热度:37.1℃ 作者:网络
异常表观遗传重编程有助于肾细胞癌(RCC)的研究进展,阐明RCC表观遗传重编程的关键调控因子识别治疗漏洞,改善治疗具有重要意义。
2023年1月4日,浙江中医药大学何强团队在Cancer Research (IF=13)上在线发表题为“YAP-activated SATB2 is a coactivator of NRF2 that amplifies anti-oxidative capacity and promotes tumor progression in renal cell carcinoma”的研究论文,该研究报道了核基质相关蛋白SATB2在RCC样本中的上调,这与不良预后相关。SATB2抑制抑制了RCC的生长和自我更新能力。YAP/TEAD4激活SATB2表达,并依赖SATB2增强细胞增殖。转录组分析表明,SATB2在不改变NRF2水平的情况下调节NRF2下游靶点以抑制氧化应激。集成ChIP-seq和ATAC-seq分析表明,SATB2与NRF2协同驱动增强子-启动子相互作用,放大转录活性。
SATB2招募SWI/SNF复合体亚基,包括BRD7或BRG1,以维持DNA可及性。SATB2增加引发染色质重构,使RCC对SATB2缺陷更加敏感。此外,SATB2消融促进了RCC对化疗诱导的细胞凋亡的敏感性。最后,靶向SATB2或BRD7有效地限制了患者来源的异种移植物和患者来源的类器官中YAP高的肿瘤的增殖。总之,该研究证实了SATB2是RCC中的致癌染色质组织者,靶向SATB2是抑制YAP高的RCC的有效策略。

根据最新的癌症统计数据,起源于63个肾小管上皮细胞的肾细胞癌(RCC)是美国64个成年人中最常见的肾癌类型。RCC中比例最高的是透明细胞肾细胞癌(ccRCC)(2)。大型患者样本的高产量测序数据已经确定了RCC中几个重要的致癌驱动因素,包括VHL, 67 SETD2, BAP1以及TP53。多年来,人们为了更有效地治疗肾细胞癌进行了大量的努力,如靶向激酶信号通路。血管内皮生长因子受体(VEGFR)和酪氨酸激酶抑制剂70 (TKIs)已成为转移性肾细胞癌联合免疫治疗的一线治疗或作为二线单独治疗的重要治疗方案。然而,相当一部分RCC患者在接受激酶靶向治疗后出现不同程度的肿瘤复发和耐药性。
免疫治疗已成为除化疗或放射治疗之外的另一种策略,靶向程序性细胞死亡蛋白(PD-1)或细胞毒性T淋巴细胞相关蛋白4 (CTLA-4)在各种恶性肿瘤(包括肾癌)中取得了显著的成功。乐伐替尼联合派姆单抗也显示出较好的抗肿瘤活性和可控的安全性,可能是转移性肾癌ICI后治疗的一种选择。然而,许多RCC患者的总体预后仍不能令人满意。此外,大多数RCC患者没有明确的治疗脆弱性。因此,阐明肾细胞癌的发生机制,确定肾细胞癌分子病理学诊断和预后预测的有效指标具有重要意义。
表观遗传改变是指基因表达或细胞表型的可遗传畸变,而不改变DNA序列。DNA和组蛋白的共价修饰在操纵基因表达的表观遗传重塑中发挥重要作用,包括DNA甲基化、组蛋白乙酰化或组蛋白泛素化。染色质结构和转录调控异常是包括RCC在内的各种恶性肿瘤的标志。在这些染色质调控因子中,核基质相关蛋白(NMPs)属于一个重要的亚群,可以通过与基因组DNA的基质附着区(MAR)结合来改变染色质组织。特殊富含AT序列结合蛋白-2 (Special AT-rich Binding Protein-2, SATB2)作为关键NMPs之一,在肾细胞癌中异常表达,其表达模式在临床数据中已被集中检测。
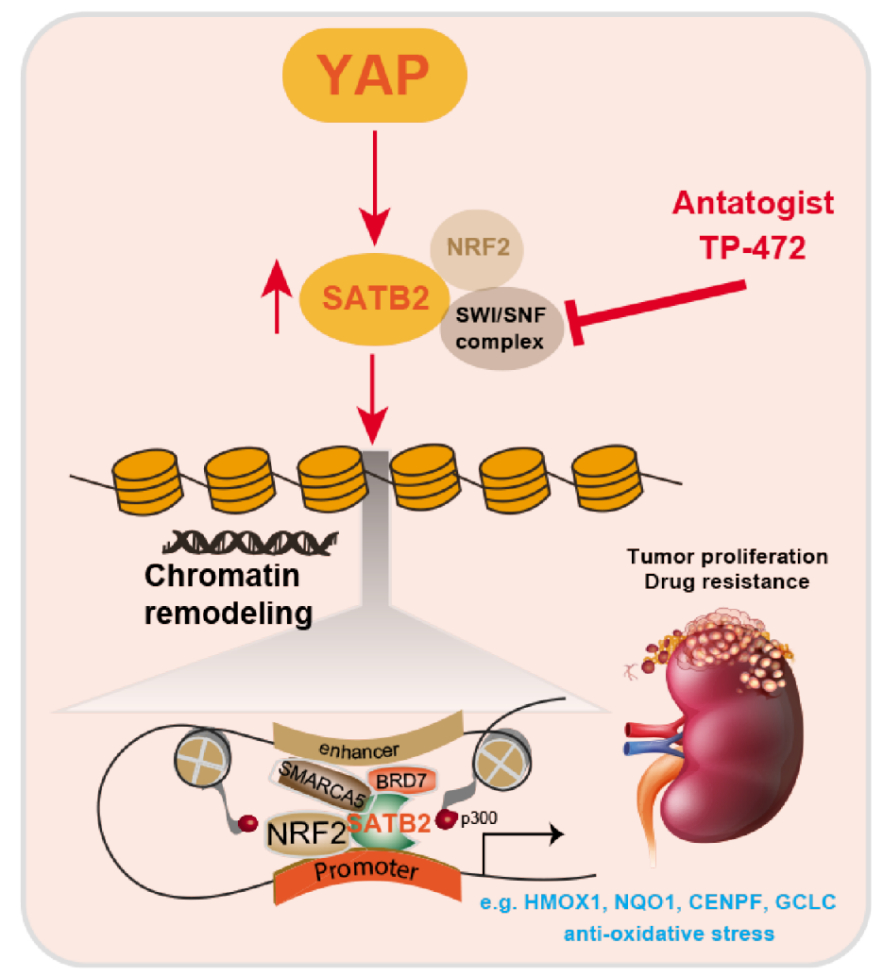
YAP/SATB2/NRF2轴调节RCC抗氧化应激的示意图(图源自Cancer Research )
先前的研究表明SATB2在脾后皮层区域化、干性维持和肿瘤免疫细胞微环境中具有多种作用。据报道,SATB2可以将染色质重塑蛋白招募到特定的DNA序列,诱导染色质重排,从而激活或抑制基因转录。Gergana Dobreva等人发现SATB2能够增强Runx2和ATF4的活性,调节成骨细胞的分化。此外,SATB2还可以作为Ctip2的抑制因子诱导染色质结构的变化。有趣的是,SATB2被报道具有与肿瘤生长或抑制相关的双重功能。一方面,SATB2的降低与结直肠癌患者生存差相关,提示SATB2是一个有利因素。另一方面,SATB2可能通过上调NOX4在口腔鳞状细胞癌(OSCC)的致瘤性中发挥关键作用。到目前为止,SATB2和RCC癌变之间的具体联系仍不确定。同时,SATB2作为一种重要的染色质组织者,如何在肾癌细胞中操纵染色质重塑和表观遗传结构是一个值得深入研究的问题。
研究表明,Hippo通路能够结合Ste20样激酶1/2 (MST1/2)和大肿瘤抑制因子1/2 (LATS1/2)、YES关联蛋白(YAP)和/或其旁系TAZ等亚基,在肿瘤发生中发挥抑制作用。YAP 是一种转录激活因子,Hippo信号通路主要通过增强YAP细胞质的定位来降低其活性。据报道,YAP可能是一种重要的癌基因,可促进实体瘤体积和肿瘤发生。YAP的转录活性主要由其磷酸化状态和定位决定。累积的核定位很大程度上表明YAP激活,代表最重要的调控类型。
值得注意的是,YAP活性通常将表观遗传异常与肿瘤发生过程中的代谢障碍联系在一起。例如,S1P/S1PR3轴抑制YAP的磷酸化,促进YAP-c- MYC复合物的形成,从而增强PGAM1介导的糖酵解。此外,在结肠癌中,YAP的致癌活性主要依赖于ZMYND8以增强细胞内胆固醇的从头合成。在肺腺癌中,XC - 系统的抑制导致内源性谷氨酸的积累,进一步通过抑制YAP来决定铁下垂的敏感性。此外,抗凋亡癌蛋白survivin是YAP的下游介质,是LKB1缺陷LUAD进展的重要因素。然而,YAP是否存在其他表观遗传脆弱性或促进RCC的信号尚不清楚。
该研究确定了SATB2是RCC中的致癌染色质组织者,与患者的不良预后相关。在机制上,YAP促进SATB2的转录,并依赖SATB2发挥致瘤作用。增加的SATB2介导染色质重塑以驱动抗氧化串扰。重要的是,大型临床前模型中证明,抑制SATB2或靶向其相关的SWI/SNF复合物是一种有前途的治疗YAP高RCC肿瘤的方法。
参考信息:
https://doi.org/10.1158/0008-5472.CAN-22-1693


