Nature重磅综述 | 深度解析代谢与细胞衰老间的恶性循环
时间:2023-01-26 21:01:56 热度:37.1℃ 作者:网络
代谢是生物体维持生命的化学反应的总称,是不断进行物质和能量交换的过程,如果将人体比作一辆行驶中的汽车,那么代谢就是这辆汽车的发动机工作系统。衰老过程中往往会发生代谢异常,“汽车”的“发动机系统”出现工作障碍,难免行驶得磕磕绊绊,甚至危及生命。2021年10月18日,美国塔夫茨大学的Christopher D. Wiley教授和巴克老年研究中心的Judith Campisi教授在Nature Metabolism上发表了题为 “The metabolic roots of senescence: mechanisms and opportunities for intervention” 的综述文章,为我们详细梳理了代谢与衰老间联系,并为衰老干预措施的开发提供了建设性意见。
摘 要
细胞衰老往往伴随着细胞永久性的增殖停滞和多种表型的变化。这些变化包括大量生物活性分子的释放,这些分子统称为衰老相关分泌表型(senescence-associated secretory phenotype, SASP)。研究表明,衰老和SASP会因细胞和机体代谢状态发生变化,而细胞和机体的衰老状态反过来又驱动了代谢功能障碍相关的表型。本文回顾了目前探讨衰老和代谢关系的相关研究,重点关注了细胞水平的发现,包括细胞衰老的代谢驱动因子和衰老相关的细胞代谢改变。此外文章还关注了靶向代谢或衰老细胞的干预措施,并探讨了这些干预措施是如何通过影响代谢和细胞衰老间的相互联系,最终延缓衰老的。最后,本文发现最有效的干预措施可能是通过打破“细胞衰老诱发代谢疾病,代谢疾病又加剧细胞衰老”这一恶性循环而发挥作用。
细胞衰老的历史渊源 二十世纪六十年代早期Hayflick和Moorhead首次提出了细胞衰老的概念,即脊椎动物细胞在应激条件下进入的非分裂状态。培养过程中正常细胞最终停止分裂,这一发现挑战了Alexis Carrel在二十世纪零零年代初期提出的观点,即“正常的培养细胞本质上是“不朽的””。并且Hayflick和Moorhead认为细胞分裂的最终停滞反映了生物体衰老的观点,和Carrel认为生物体死亡可能是多细胞性结果的观点有所不同。他们还指出,源自恶性肿瘤的细胞不会经历这种形式的衰老,这表明细胞衰老状态的存在抑制了癌症的发展。多年后,Sager及其同事表明细胞衰老是对潜在肿瘤诱导刺激的反应,因此正式提出细胞衰老反应是一种有效抗癌机制的假设。自二十世纪六十年代以来,有关细胞衰老的生理和病理功能的发现急速增加。而衰老细胞经历并导致多方位代谢重编程改变的观点也得到广泛认可,本文对此展开了讨论。
衰老细胞的自发和非自发效应 细胞衰老的核心是不可逆的细胞增殖停滞,这一观点得到了广泛的证明。细胞增殖停滞是一种有效的自主抗癌机制。因此,大多数携带阻止或抑制衰老细胞生长停滞的突变 (例如,p53或pRB失活或显性负突变) 的人和小鼠都易患癌症,并且通常会因恶性肿瘤而过早死亡。
此外,部分衰老细胞由于抗凋亡蛋白的表达增加获得了对细胞死亡的自主抗性。而某些癌细胞也具有同样的特性,因此针对此特性开发的部分无效的抗癌药物目前正被重新利用,用于延缓衰老药物的研发,而这些药物可以选择性的只杀死衰老细胞,而对其它细胞不起作用。然而,目前尚不清楚细胞死亡的自主抗性是如何普遍存在于不同类型的衰老细胞中的。例如,衰老的内皮细胞通常比衰老的成纤维细胞更容易发生自发性细胞凋亡,但即使是成纤维细胞在面临某些类型的DNA损伤如转录阻断损伤时也会在衰老后发生凋亡。除此之外,目前关于衰老细胞对细胞死亡的自主抗性机制也未完全了解。
最后,所有衰老细胞最终都表现出复杂的、多成分的衰老相关分泌表型 (SASP)。SASP会非自主地改变邻近细胞的行为和组织微环境。随着细胞类型和细胞衰老方式的变化,SASP也表现出极高的可塑性,同时会随着时间推移发生极大的动态变化。SASP的一个显著特点是含有大量的促炎分子,包括细胞因子、趋化因子、生物活性脂质和损伤相关分子模式 (damage-associated molecular patterns, DAMPs)。而慢性炎症作为衰老组织的一个共同特征,是许多衰老相关疾病 (例如晚年癌症) 的主要危险因素,慢性炎症在衰老组织的积累可能就是由于衰老细胞分泌的SASP导致的。
近年来研究发现,除SASP之外,衰老细胞的表型还具有显著的可变性、异质性和可塑性。例如,对于大部分衰老细胞来说,生长停滞是由细胞周期蛋白依赖性激酶与细胞周期抑制因子p16INK4a和p21CIP1 (由CDKN2A和CDKN1A基因编码) 启动和/或强制执行的。同样,其他常用的衰老标志物,例如衰老相关的β-半乳糖苷酶 (senescence-associated β-galactosidase,SA-β-gal)阳性率的升高,核纤层蛋白lamin B1 (LMNB1) 的表达降低,以及核蛋白HMGB1的分泌和重新定位,也可能只适应于绝大多数而不是全部的衰老细胞。因此,评估特定刺激诱导衰老反应的能力以及评估体内组织中衰老细胞的比例需要使用多种标记物。
衰老细胞的适应性与不适应性效应 根据生理环境的不同,衰老可能是有益的,也可能是有害的。这种二元性与拮抗基因多效性的进化理论是一致的。如果一个基因具有多个功能,其中一些功能有利于生命体生长繁殖,而另一些功能不利于生命体的生长繁殖,那么这一现象被称为拮抗基因多效性。当生物处在恶劣的自然环境且寿命较短时,拮抗基因多效性会促进年轻个体的存活,而在现代受保护的环境中,个体寿命得以延长,原本有益的基因在个体年老时可能是有害的。因此衰老表型及衰老相关疾病可能是拮抗基因有害的一面造成的。
关于细胞衰老的有益作用,如前文所述,细胞生长停滞有利于降低癌症的发生率。此外,衰老细胞分泌的SASP因子还有利于胚胎中某些结构的形态发生,并有助于胎盘中分娩活动的起始。而且,衰老细胞在某些组织损伤部位的短暂积聚,有助于伤口愈合、组织修复和再生,这可能也归功于特定的SASP因子。
相比之下,衰老细胞在大多数哺乳动物组织中随着年龄的增长而逐渐增加,并且似乎可以一直存留。尚不清楚这种增加是由于产量增加还是清除率降低。更重要的是,在人类细胞、组织以及转基因小鼠模型上开展的实验以及对细胞和小鼠的药理干预都强烈暗示衰老细胞与许多衰老相关的疾病 (如神经退变和衰老相关癌症) 的病理学有关。而衰老细胞的这些不利影响大部分可能归因于其分泌的包含大量促炎因子的SASP。
是什么引发了衰老反应?人们对体内尤其是在衰老过程中衰老细胞是如何被诱导的知之甚少。已知的衰老反应诱导因素 (至少在培养细胞和小鼠模型中) 包括DNA损伤、癌基因活化和线粒体功能障碍。因为即使在衰老和病变组织中衰老细胞的比例也比较低,所以很难确定在体内它们是如何被诱导衰老的。令人兴奋的是,单细胞层次的转录组学和蛋白质组学分析有望帮助确定自然衰老和与衰老相关疾病中的主要驱动因素。在所有情况下,衰老细胞都必须进行代谢的重编程,以维持其生长停滞状态,并表达维持高度复杂、动态和异质性的SASP所需的基因和蛋白质。这些代谢变化的原因和后果将在后文展开讨论。
衰老的代谢驱动因素
几种形式的代谢应激既可以导致衰老,也可以影响SASP(图1)。本文将针对这些应激因素开展描述及探讨。
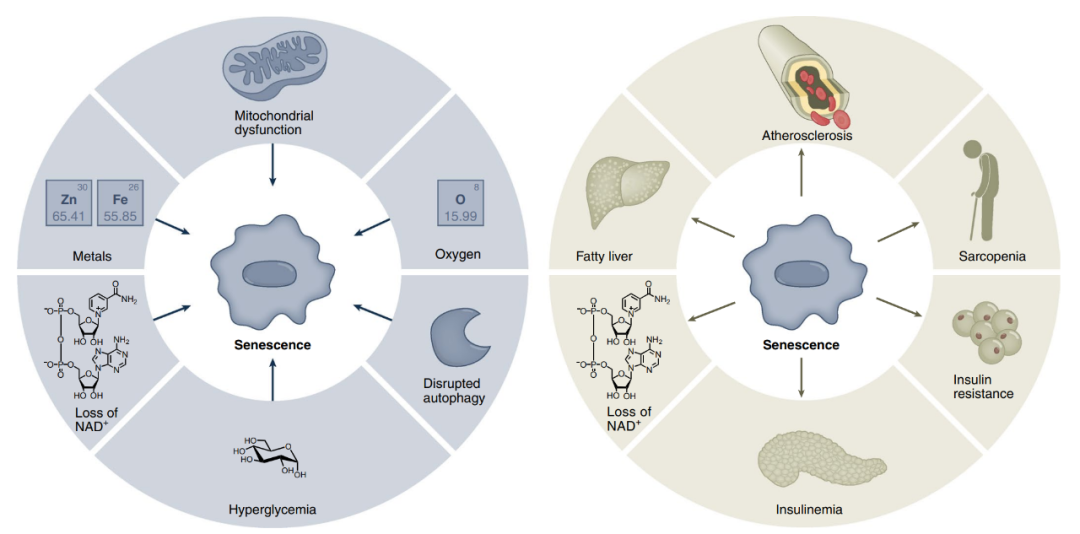 图1 代谢与细胞衰老的关系
图1 代谢与细胞衰老的关系
左图:衰老的代谢驱动因子。①线粒体功能障碍,通过打破细胞质中的NAD+/NADH比率、产生活性氧和其他潜在机制来驱动衰老。②过量金属 (尤其是过渡金属) 的积累会促进衰老。③sirtuin表达减少、PARP活性的丧失以及细胞氧化还原状态的改变导致的NAD+的丧失也会导致衰老。④高血糖也会导致衰老。⑤自噬功能障碍在某些情况下会导致衰老,但在其他情况下也会阻止衰老。⑥高浓度的非生理氧促进衰老。
右图:衰老细胞是代谢疾病的驱动因素。①衰老细胞和/或SASP可以加剧动脉粥样硬化斑块的形成以及斑块不稳定性。②在肝脏中,衰老细胞可以促进脂肪变性。③SASP还会激活巨噬细胞,提高CD38水平并降低NAD+水平。④在胰腺中,衰老的β细胞会促进高胰岛素血症,但随着β细胞受到免疫系统的攻击,可能会变成低胰岛素血症。⑤在外周组织 (例如脂肪) 中,衰老细胞可以促进胰岛素抵抗,因此衰老细胞可以通过多种方式引发糖尿病和代谢疾病。⑥最后,衰老细胞会加剧肌少症,进而影响基础代谢、活动水平,最终导致个体的虚弱。
线粒体功能障碍 线粒体是衰老相关病理学的主要调节细胞器。突变的线粒体DNA (mtDNA) 的快速积累会导致小鼠的过早衰老,而保护线粒体功能的过氧化氢酶 (mCAT) 的过度表达则会延长小鼠寿命。因此,线粒体功能对细胞衰老和SASP可能具有类似的影响。
线粒体功能障碍的许多驱动因素也会导致细胞衰老。这些驱动因素包括线粒体DNA的缺失和突变、电子传递链抑制剂、线粒体伴侣蛋白HSPA9的缺失、线粒体蛋白脱乙酰基酶SIRT3和SIRT5的缺失以及复合物I的非正常组装。这种线粒体功能障碍相关衰老 (mitochondrial dysfunction-associated senescence, MiDAS) 表型缺乏SASP的几个促炎症因子,但却包含其自身独特的SASP因子。MiDAS主要由胞浆NADH的积累驱动 (图2),随着NAD+/NADH比率的降低,关键的糖酵解酶GAPDH的表达也会降低,最终导致ATP耗竭、AMPK激活和细胞周期阻滞。
此外,线粒体是活性氧 (ROS) 的来源。小鼠线粒体超氧化物歧化酶 (SOD2) 的缺失会加速细胞衰老。通过线粒体自噬消除线粒体的转基因细胞培养模型可延缓衰老并减少促炎SASP因子的表达,而这种保护作用与活性氧和核DNA尤其是端粒相关损伤的减少有关。此外,线粒体ROS还可以激活JUN氨基端激酶,该激酶则反过来促进细胞溶质染色质片段的释放和SASP促炎成分的激活。此外还有很多研究都表明线粒体来源的活性氧可能是细胞衰老的关键驱动因素。
值得注意的是,尽管有证据表明衰老细胞会加速衰老并限制健康寿命和中位值寿命,但很少有措施能通过拮抗ROS来延长寿命,并且这些干预措施均不能减少衰老细胞的积聚。相反,通过靶向线粒体来预防衰老和SASP激活的干预方法也会对线粒体生物学的其他方面起作用。因此,线粒体活性氧是否是衰老细胞随年龄累积的原因仍是一个悬而未决的问题。例如,PGC-1B耗竭会降低线粒体生物发生,而雷帕霉素会增加线粒体自噬。虽然这两种操作都减少了活性氧,但它们也改变了线粒体代谢和其他方面的功能。此外,活性氧是一些过程中必不可少的信号分子,如细胞增殖、先天免疫、干细胞更新、分化和存活。因此,活性氧、衰老和体内衰老之间的关系可能比目前培养模型所表现的更为复杂。
最近的研究还表明,通过阻断小鼠体内的Itpr2钙通道来降低内质网 (endoplasmic reticulum, ER) 与线粒体接触,可减少衰老细胞的数量和几种SASP因子的水平,进而延长健康寿命和最大寿命。但目前尚不清楚这些影响是否是由于线粒体钙超载减少、内质网线粒体接触减少或两者的某种组合所致。这些策略证明了在衰老细胞不断累积的过程中线粒体所发挥的决定性作用,但没有明确说明活性氧本身是否起主要作用。
许多细胞培养研究,特别是使用小鼠细胞的研究,需要注意的一个重要问题是,虽然包括线粒体ROS在内的ROS肯定会在培养中诱导衰老,但这些研究中的大多数是在大是在空气氧浓度条件下进行的,而非生理氧浓度,这会对实验结果产生影响。因此,许多观察到的现象可能是高氧状态的潜在表型。
氧化 细胞衰老的表型很大程度上取决于细胞可获得的氧浓度,二者呈现负相关,更多的氧往往会加速衰老。哺乳动物基因组中有60多种耗氧酶,因此氧浓度是许多生物过程 (包括衰老) 的关键调控因素也就不足为奇了。大气氧浓度下培养的鼠成纤维细胞会经历更为快速的衰老,因此鼠细胞对氧浓度更敏感,但如果氧浓度降低至3% (更接近在体内基质中观察到的水平则) 会增加小鼠细胞的增殖能力,同时也会增加人细胞系 (例如人羊水干细胞) 复制性寿命并增强其干性。此外,使用诱导细胞周期停滞的药物 (如nutlin-3a) 处理细胞会导致细胞衰老,而这种衰老表型的存续也依赖于O2的存在。培养条件下的小鼠成纤维细胞分泌的与人相似的SASP需要较低的O2水平,并且这种SASP更接近随年龄增长所观察到的情况。尽管有以上这些发现,亚生理水平的氧(即缺氧)也可以激活AMPK,AMPK可以通过mTOR抑制SASP。更广泛地说,这些数据表明在使用大气而不是生理氧浓度研究衰老 (以及可能的许多其他条件) 时可能出现假象。氧浓度因组织和物种而异,因此在研究衰老时,相关细胞类型的生理氧浓度是一个重要的考虑因素。
但不幸的是,在某些情况下高氧是必须的。例如,肺尚未发育的早产儿通常需要补充氧,但会增加儿童早期患呼吸道疾病 (如哮喘) 的风险。同样,出现COVID-19严重症状的病人需要补充氧。用中度高氧 (40% O2) 处理胎儿气道平滑肌细胞和肺成纤维细胞可在短短7天内增加衰老标志物,表明衰老细胞可能在这些疾病中发挥作用。相反,最近发现100%高压氧可降低特定外周血单核细胞群的衰老标志物,因此不同细胞类型的衰老细胞对氧的反应可能截然不同。此外,小鼠心脏缺血-灌注模型中会积累衰老细胞,消除这些衰老细胞可明显提高小鼠的缺血恢复效果,这表明氧的波动也会导致衰老和病理变化。因此,氧浓度是细胞培养环境中的重要考虑因素,并且可能在动物模型和人体的特定环境下促成衰老。
NAD+代谢紊乱 在衰老的过程中,NAD+在调节细胞周期停滞和SASP中起主要作用 (图 2)。NAD+是聚ADP核糖聚合酶 (PARP) 和沉默调节蛋白家族蛋白 (SIRTs) 的主要辅因子。PARP通过防止基因毒性应激来对抗衰老,但也会促进衰老细胞中NF-kB的激活和分泌。事实上,上皮细胞衰老过程中PARP1的丢失与未修复的单链断裂水平增加有关,这反过来又通过p38MAPK激活加强细胞周期停滞。同样的,抑制烟酰胺磷酸核糖基转移酶 (NAMPT)——可阻止NAD回补并降低总NAD+水平——两者都能够促进衰老停滞并抑制SASP的促炎功能;这种效应类似于MiDAS的表型。重要的是,许多组织中的NAD+水平随着年龄的增长而下降,这种下降与多种退行性疾病有关,包括与衰老相关的肌肉损失和糖尿病。

图2 NAD代谢和细胞衰老
NAD+水平和NAD+/NADH 比率在衰老过程中受多种途径控制。NAD+/NADH 的比例是通过丙酮酸在细胞质中转化为乳酸,或者通过苹果酸-天冬氨酸穿梭途径将还原性的NADH转移到线粒体中来维持的。通过电子传递链 (eTC) 复合物 I的活性,NADH在线粒体中进一步被氧化回NAD+。任何这些过程的中断都会导致细胞质中NADH增加、AMPK活化以及诱导衰老。NAD+通过PARPs和Sirtuins发挥作用,以防止基因毒性应激和p53激活,这会促进衰老,但会拮抗SASP。SASP因子被衰老细胞释放后可以与巨噬细胞上的同源受体结合,然后提高CD38的水平。而CD38作为环状ADP核糖 (cADPR) 合成的一部分,能够降低周围组织中NAD+的水平。
几种Sirtuins家族的蛋白在衰老反应和SASP中起关键作用。除了拮抗MiDAS43的SIRT3和SIRT5,SIRT1、2和6在衰老中也重要作用。SIRT2使有丝分裂检查点激酶BUBR1去乙酰化并稳定其存在,BUBR1在衰老过程中会下降导致非整倍体的出现 (衰老的有效驱动力)。值得注意的是,补充NAD+前体烟酰胺单核苷酸 (NMN) 延长了早衰BUBR1+/-小鼠的寿命。SIRT6基因敲除小鼠表现早衰和炎症激活状态,这种表型至少部分是由逆转录转座子的去抑制驱动的 (衰老也会发生这种情况)。此外,SIRT6的过表达能够防止衰老过程中发生的同源重组丢失。最后,SIRT1在衰老过程中被自噬降解。SIRT1活性的丧失与衰老的多方面有关,包括SASP激活,细胞周期停滞,以及几种衰老相关的退行性疾病,包括神经变性、恶液质、脂肪肝和动脉粥样硬化等。Sirtuins和PARP一起证明了NAD+消耗酶在衰老中的重要性,并帮助解释了为什么NAD+水平随着年龄的增长而减少,会对组织造成明显伤害。
另外值得注意的是,在衰老的过程中NAD+并不总是有益的。我们假设,由于NAD+的损失会拮抗SASP,增加的NAD+可能会产生相反的效果并促进SASP。已有研究证明在衰老细胞中NAMPT和NAD+水平升高,这种上升与AMPK和p53活化减少有关,会导致p38MAPK和NF-kB活性增加以及促炎SASP因子的分泌。因此,NAD+可能会对抗衰老,但一旦进入衰老阶段,NAD+增加可能反而通过SASP促进退行性病变。细胞衰老也在组织水平的NAD+代谢中起作用。SASP促进巨噬细胞中的CD38活化。CD38在合成环状ADP核糖 (cADPR) 期间消耗NAD+,并且是NAD+随年龄增长而消耗的主要驱动因素。因此,衰老细胞可能会导致NAD+损失,从而导致更多衰老细胞的产生 (图 1)。这种负反馈可能会导致多种NAD+和衰老相关的衰老相关疾病 (例如,糖尿病)。相比之下,消除衰老细胞或抑制SASP可能会保护NAD+稳态,而抑制CD38反过来可能具有保护作用并防止随着年龄增长而衰老加剧。
如上所述,MiDAS是由细胞质NAD+/NADH比值降低引起的,但NAD+/NADH比值降低也可在没有线粒体功能障碍的情况下发生。例如,通过氨氧乙酸 (AOA) 抑制苹果酸-天冬氨酸穿梭,将还原性的NADH从细胞质运输到线粒体,从而诱发衰老。穿梭酶苹果酸脱氢酶1 (MDH1) 的缺失具有相似的表型。当在细胞质 (ME1) 和线粒体 (ME2) 中催化NAD+依赖性苹果酸转化为丙酮酸的苹果酸酶被抑制时,会发生类似的结果。这些酶与p53的相互调节,两者的消耗都会驱动p53依赖性衰老,但p53反过来抑制苹果酸酶。这些研究表明,NAD+/NADH比率与p53之间的相互作用是代谢应激条件下衰老的关键调节因子。
高血糖症 大量研究表明,在高葡萄糖水平的条件下培养细胞会加速细胞衰老。但是因为已发现高血糖会通过多种途径加速衰老,所以目前还没有统一的模型可以解释所有类型的高血糖相关衰老。大多数研究集中于内皮细胞,包括视网膜内皮细胞;此外,成纤维细胞和肾上皮细胞也得到了广泛研究。尽管如此,似乎不存在多种细胞系普适的高血糖相关衰老机制。例如,在高葡萄糖培养的视网膜内皮细胞中诱导精氨酸酶1 (ARG1) 表达和激活,导致一氧化氮 (NO) 减少和氧化应激升高。链脲佐菌素 (STZ) 诱导的糖尿病视网膜病变小鼠模型中的视网膜内皮细胞以ARG1依赖性方式发生衰老,抑制ARG1活性可防止视网膜上皮细胞中高糖诱导的衰老和糖尿病诱导的视网膜衰老。但恰恰相反的是,人脐静脉内皮细胞 (HUVEC) 中的报告表明,在高糖诱导的衰老过程中,精氨酸酶活性下降,而这种下降与NO合成减少有关。在高糖处理的HUVEC中补充精氨酸可以防止这些影响并拮抗衰老。通常,NO拮抗内皮细胞衰老,因此这些细胞中葡萄糖诱导衰老的关键效应物可能与细胞NO产生水平有关。这种机制不太可能是普遍存在的,因为ARG1仅在少数细胞类型中表达,并且只有少数细胞能够产生NO。
高葡萄糖也会促使成纤维细胞衰老,葡萄糖限制可以延长寿命。尽管成纤维细胞产生NO,但它们不表达ARG1,因此尚不清楚用内皮细胞观察到的规律是否适用于这种细胞类型。例如,用N(G)-硝基-L-精氨酸甲酯 (L-NAME) 抑制一氧化氮合酶 (NOS) 会导致内皮细胞衰老,但当成纤维细胞与巨噬细胞共培养时可以对抗衰老。因此,NO在不同细胞类型的衰老反应中的作用需要进一步研究。
在另一项研究中,高糖通过降低SIRT3的水平促进成纤维细胞的衰老,而SIRT3的过表达阻止了这种高糖诱导的衰老。SIRT3的丢失可以驱动MiDAS,因此过量葡萄糖降低SIRT3是高糖诱导衰老的最有可能的机制。此外,高葡萄糖会加速内皮细胞中SIRT家族的丧失,这种丧失也与衰老发生有关。由于SIRT3使线粒体蛋白脱乙酰,而高糖饮食可以增加线粒体蛋白乙酰化并降低NAD+/NADH比率,因此高血糖可能通过MiDAS或MiDAS类似表型驱动衰老。
高血糖还会导致糖基化终产物 (AGEs) 的形成,这会在某些模型中导致衰老。例如,用外源性AGEs (例如糖化白蛋白) 处理肾近端小管上皮细胞,会以晚期糖基化终末产物受体 (RAGE) 依赖性方式存在引发p21或p16表达增加,同时SA-β-gal的激活相应增加。值得注意的是,这些研究仅包含治疗后48小时的短期观察结果,因此没有考虑慢性暴露和AGE去除的影响。而且这些影响很有可能是细胞类型特异的。与之相反的是,RAGE的激活通过与p53结合并拮抗p21表达来延长小鼠脂肪前体细胞的寿命。因此需要更多的研究来充分阐明AGEs与细胞衰老之间的关系。此外,将高血糖与衰老联系起来的研究并没有解释SASP,因此这种衰老形式的后果仍然有些不清楚。糖尿病和衰老之间的联系正在增加,糖尿病并发症部位衰老细胞的增加表明这是未来研究的一个重要领域。
衰老细胞的代谢
衰老细胞的代谢状态会发生一些变化 (图3)。在这里,我们回顾了其中的一些变化,以及这些变化在衰老表型发展中的意义。

图3 衰老细胞代谢状态的改变
衰老细胞中游离在胞质中的多不饱和脂肪酸增加,这些多不饱和脂肪酸可以被转化为脂类氧化物,作为以脂质为基础的SASP的一部分。在衰老过程中,脂肪酸也会在脂滴中积累。甾醇优先以p53依赖性方式在某些衰老细胞的内质网中积累,从而抑制甾醇反应元件结合蛋白2 (sterol response element-binding protein 2,SReBP2) 的激活,并导致细胞中的甾醇合成的减少。衰老细胞中,线粒体质量及mtDNA通常会增加,这与线粒体膜电位和ROS生成的改变有关。衰老细胞的溶酶体会变得通透,从而导致细胞质酸化,并抑制一些自噬途径,进而导致衰老细胞中过渡金属的累积。最后,由于衰老细胞中核糖核苷酸还原酶2的缺失,其中dNTP的水平可能较低。需要注意,衰老是一种复杂多变的现象,不同的衰老细胞中可能只会出现部分上述的代谢变化。
脂质代谢 越来越多的证据表明衰老细胞中脂质代谢会改变。在上述证据中的第一个发现是衰老细胞中鞘磷脂神经酰胺途径会更加活跃,尤其是该途径中的鞘磷脂酶。另外,用衰老细胞中相似浓度的神经酰胺处理细胞,会导致细胞中增殖标志物降低,并导致成纤维细胞及内皮细胞中衰老标志物的增加。总的来说,神经酰胺和鞘氨醇促进细胞衰老,而1-磷酸鞘氨醇 (sphingosine-1-phosphate,S1P) 则通过其同源受体促进细胞增殖。神经酰胺激活的蛋白磷酸酶 (PP1和PP2A) 通过使CDK2去磷酸化和特异性上调p21来促进衰老。鞘氨醇具有类似的作用,但其机制尚不清楚。最近已有综述文章总结了神经酰胺、鞘脂和细胞衰老之间的关系
其他研究表明,在致癌基因诱导的细胞衰老中,β-氧化 (脂质的代谢分解) 的上调对于SASP中许多促炎因子的分泌是十分重要的。此外,脂肪酸合酶 (fatty acid synthase,FASN) 在衰老细胞中的增加,对于细胞周期停滞和部分SASP的分泌是必需的。衰老细胞中,与脂肪酸合成 (例如FASN) 及氧化 (例如ACADS、ACADL、ACADSB、ACADVL) 相关的几种酶表达增加,而硬脂酰辅酶A去饱和酶 (将饱和脂肪酸转化为单不饱和脂肪酸 [monounsaturated fatty acids,MUFAs]) 则减少。这些数据表明,饱和脂肪酸可能是衰老细胞产生能量的重要底物。
除了提供和储存能量,脂肪酸在衰老中还发挥着额外的作用。值得注意的是,在某些衰老细胞中,脂滴会随着细胞衰老而累积。外源性脂质优先结合到甘油三酯中,从而在衰老细胞中形成脂滴。此外,衰老细胞中游离多不饱和脂肪酸 (free polyunsaturated fatty acid,PUFA) 水平增加,这可能是由于p38依赖性激活磷脂酶A2裂解细胞膜产生PUFAs。衰老细胞里更高浓度的PUFAs与甘油三酯结合,最终积聚在脂滴中。值得注意的是,在肥胖动物模型的大脑中衰老细胞数量增加的同时,这些衰老细胞中脂滴的数量也有所增加。重要的是,清除衰老细胞也降低了这些脂滴的积累。并且,降低细胞培养基中的外源性脂质的水平,可减少脂滴的积累和许多SASP因子的分泌。这些数据表明,脂滴 (或至少是脂质) 在细胞衰老和SASP的分泌中发挥着关键的作用。
从质膜释放的游离PUFAs与多种形式的细胞衰老有关。此外,在MiDAS中,二十碳五烯酸 (eicosapentanoic acid,EPA)、花生四烯酸 (arachidonic acid,AA) 、二高-γ-亚麻酸 (dihomo-γ-linolenic acid,DGLA) 和二十二碳六烯酸 (docosohexanoic acid,DHA) 等多种PUFAs的水平,高于其他形式的细胞衰老。这种升高反映了细胞可能试图通过利用PUFAs将NADH转化为NAD+,来维持NAD氧化还原平衡。除了在脂滴中以甘油三酯的形式积累外,游离PUFAs还会转化为含氧信号分子,统称为氧化脂类。白三烯、前列腺素和二高前列腺素等氧化脂类与细胞衰老息息相关。衰老相关的白三烯促进肺纤维化,而清除衰老细胞则可改善这种影响。前列腺素的合成对于促进衰老相关的细胞周期停滞至关重要,而诱导型前列腺素合酶2 (PTGS2或COX-2) 抑制剂处理则增加了培养细胞的传代次数,并且增加了响应基因毒性应激诱导和癌基因诱导衰老的分裂细胞数量。
令人惊讶的是,前列腺素似乎并不是通过与前列腺素受体的相互作用来促进衰老。相反,衰老细胞中前列腺素转运蛋白 (PGT/SLCO2A1) 的表达上调,但前列腺素脱氢酶 (prostaglandin dehydrogenase,PGDH) (通过将前列腺素转化为15-酮衍生物来使前列腺素失活) 的表达没有相应升高。这些代谢变化导致15-脱氧前列腺素的细胞内积累,尤其是15d-PGJ2以及衰老相关的dihomo-15d-PGJ2。这些亲电性的前列腺素在细胞内具有多种活性。首先,它们通过迈克尔加成反应与暴露的半胱氨酸反应,来改变蛋白质结构——将碳负离子或其他亲核反应物,加成到含有吸电子基团的α,β的不饱和羰基化合物上。Dihomo-15d-PGJ2在衰老细胞中的积累促进了内源性HRAS的激活,从而以类似于癌基因激活的方式促进了细胞衰老。值得注意的是,衰老细胞的这种特性使得研究人员能够检测衰老细胞的清除,因为dihomo-15d-PGJ2的大小仅为~343 kDa,因此在细胞凋亡过程中会从细胞质中释放。因此,研究人员可以在在培养基或生物体液中检测到dihomo-15d-PGJ2。总之,这些研究表明衰老和脂质代谢间有着错综复杂的联系 (图4),但也强调了未来工作的重要性,因为在衰老研究的背景下,脂质代谢的许多领域仍未得到充分探索。
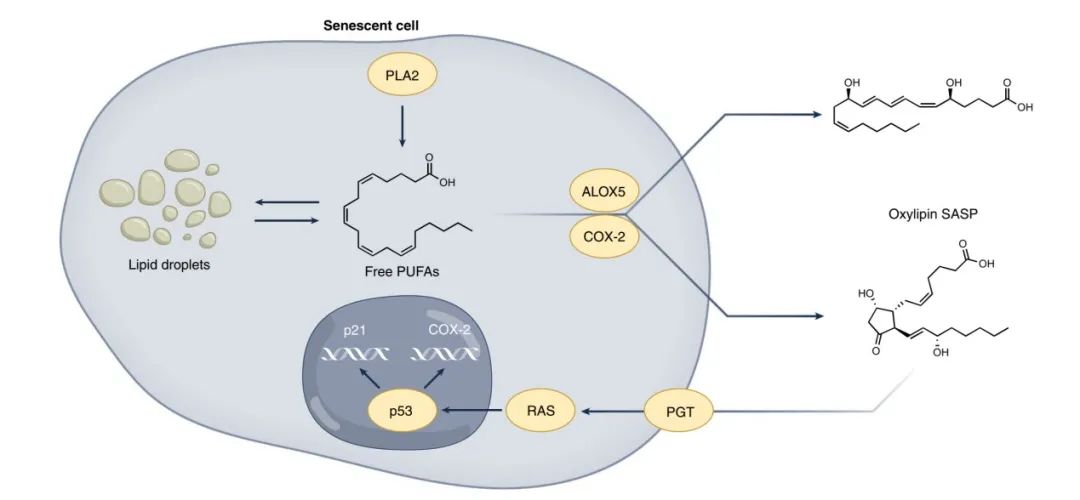
图4 衰老细胞中的脂质代谢
磷脂酶A2 (phospholipase A2,PLA2) 的激活导致PUFAs从质膜中释放出来,然后以甘油三酯的形式在脂滴中积累,但也作为花生四烯酸5-脂肪氧化酶 (arachidonate 5-lipoxygenase,ALOX5) 和环氧化酶2 (cyclooxygenase 2,COX-2) 等氧化脂合酶的底物,导致氧化脂类SASP的释放。前列腺素转运体将前列腺素运入细胞质,其中环戊烯酮前列腺素激活RAS进而导致p53激活,致使细胞周期停滞,p21和COX-2升高,增强氧化脂类的生物合成。
溶酶体与自噬 自噬是细胞分解其细胞器和大分子的过程,自噬过程在衰老细胞中会发生失调。衰老细胞中,特异性因子表现出选择性的微自噬降解,而巨自噬过程则不太活跃。细胞中的ATG7、ATG12或LAMP2能够抑制自噬诱导的衰老。这意味着衰老期间的自噬稳态失衡可能会促进细胞衰老并维持细胞衰老状态。然而,自噬的激活与癌基因诱导的衰老有关,过表达ULK3也会促进细胞衰老。衰老和自噬之间关系的复杂性是最近许多综述文章讨论的主题。
值得注意的是,许多衰老细胞出现溶酶体功能失调。SA-β-gal在衰老细胞中的上调可能是由于溶酶体功能障碍。最近的研究结果表明,衰老细胞中溶酶体的通透性增加,这种增加导致溶酶体酸度丧失,同时促进了细胞质酸化。为了抵抗溶酶体通透性的增加,衰老细胞往往会通过增加谷氨酰胺酶1 (glutaminase 1,GLS1) 的表达来上调谷氨酰胺分解,增加氨的产生并中和细胞质酸度。抑制GLS1可清除体外培养的或体内的衰老细胞,并改善与衰老相关的器官功能障碍指标。因此,衰老细胞中溶酶体功能障碍虽然有害,但却是衰老细胞可以被靶向清除的一个靶标。
过渡金属稳态失衡 过渡金属——占据元素周期表中心的二价阳离子——在细胞的生物学过程中发挥着关键作用。但是,研究人员才刚刚开始探究这些金属离子在细胞衰老中的作用。令人惊讶的是,研究人员发现衰老细胞中过渡金属的水平比非衰老细胞或永生化细胞中要高的多。这些过渡金属包括铁、锰和锌,其部分研究也发现了铜等过渡金属在衰老细胞中的累积。
铁 大多数细胞中的铁的浓度受到严格调控。铁离子是氧运输、呼吸和氧化磷酸化过程所必需的离子。然而,过多的未结合或“不稳定”的铁离子会催化ROS和过氧化脂质的产生,从而驱动细胞中有毒性的生物学过程,包括铁依赖性细胞死亡形式——铁死亡。过多的铁离子被铁蛋白拮抗,铁蛋白以非活性形式螯合铁离子。衰老细胞通过增加转铁蛋白受体来摄入更高水平的铁离子,然后将结合了铁离子的转铁蛋白内吞。衰老细胞中铁蛋白的水平增加,将大部分摄入的铁离子结合为非活性状态。由于铁通过靶向自噬(铁蛋白自噬小体)从铁蛋白中释放出来,而衰老细胞往往存在自噬受损和溶酶体功能障碍,因此衰老细胞中铁的积累至少部分是由于铁蛋白降解失败导致的。虽然铁代谢蛋白水平表明,在衰老过程中,不稳定的铁离子可能会减少,但是迄今为止还没有直接测量衰老细胞中不稳定铁离子的报道。如果在衰老期间不稳定铁离子减少,那么这可能解释了衰老细胞对铁死亡的抗性。因为缺乏不稳定的铁离子会抑制铁催化的脂质过氧化。然而,雷帕霉素对衰老细胞的铁死亡抗性没有影响,该领域还需要进行更多研究。
铜 铜是多种酶 (包括超氧化物歧化酶、神经递质合成酶、胺氧化酶、铜蓝蛋白和赖氨酰氧化酶) 活性所需的必需微量元素。过量的铜可以通过下调Bmi-1蛋白来促进人成纤维细胞和人胶质母细胞瘤细胞衰老 (这些研究中铜离子和氧浓度的水平都是超过正常生理水平的)。与铁相似,铜也会在衰老细胞中积累。这种积累是由于溶酶体对铜伴侣蛋白自噬降解缺陷所致,这一点与铁离子非常相似。然而,由于铜依赖性抗氧化酶 (例如,超氧化物歧化酶和谷胱甘肽还原酶) 在细胞衰老过程中增加,并且可以延缓细胞衰老。这种增加可能是抵抗衰老细胞中更高氧化水平环境的补偿机制。与铁离子非常相似,雷帕霉素消除了衰老细胞中部分铜离子的积累,表明该过程受自噬调节,但这种干预的后果尚不清楚。
锌 锌离子因其在生物体内有许多关键用途而著称。与铁和铜不同,锌不会催化脂质过氧化物形成自由基。因此,与铁和铜相比,锌的毒性更小,氧化还原活性更强。尽管如此,秀丽隐杆线虫中锌离子的浓度与其寿命成反比。衰老细胞中锌的含量也会增加,并且通常高于铁或铜的含量。并且,过量的锌会促进培养的血管平滑肌细胞、内皮细胞和成纤维细胞的衰老。尽管这些研究表明衰老过程中过渡金属水平会升高,但尚未将衰老细胞功能的改变归因于铁、铜或锌的积累。根据这些金属的过载会导致细胞衰老的现象,我们可以进一步推测,这些金属离子的积累可能会导致细胞周期的停滞,从而将衰老细胞维持在不可逆的生长停滞状态。
衰老和dNTP合成 由于衰老细胞不分裂,它们的脱氧核苷三磷酸 (deoxynucleoside triphosphates, dNTPs) 主要用于DNA修复和线粒体DNA合成。核糖相关的ATP、GTP和CTP通过核糖核酸还原酶 (ribonucleotide reductase,RRM2) 转化为dNTPs。在衰老过程中,RRM2水平下降。当致癌RAS诱发衰老时,会出现RRM2耗尽的情况,这一过程先于生长阻滞,发生在细胞周期阻滞之前的高增殖期。在缺乏dNTPs的情况下,细胞增殖会导致复制叉崩溃、DNA双链断裂和细胞周期阻滞。如果加入外源性dNTPs,可使该模型继续增殖。消除p53或p16使细胞通过磷酸戊糖途径处理代谢物,可以增加核苷酸合成,从而绕过致癌RAS诱导的细胞衰老。值得注意的是,RAS激活会拮抗hippo通路的转录因子YAP/TAZ。激活hippo通路可恢复RRM2的表达,进一步使细胞逃逸RAS诱导的衰老。这些发现表明,衰老细胞的DNA代谢受多种外部因素影响。
靶向衰老和代谢的干预
如上所述,衰老与新陈代谢有着错综复杂的联系。因此,针对代谢的干预可能会降低衰老细胞的积累或减弱衰老细胞的表型,如SASP。相对的,以衰老细胞为靶点进行干预将会延缓代谢紊乱的发生发展,例如使用senolytic(图1右图)。在本节中,我们将探索其中的一些关联。
作为代谢调节剂的Senolytics 对转基因小鼠使用选择性杀伤衰老细胞的药物 (senolysis/senolytic药物) 的研究表明,衰老细胞促进了许多与衰老相关的疾病,从而限制寿命和健康寿命。Senolysis可预防几种疾病,包括慢性肾脏疾病、骨质减少和骨关节炎。衰老细胞也促进肿瘤发生,包括癌症复发和抗癌化疗的几种副作用。因此,衰老细胞在某些方面促进代谢性疾病也就不足为奇了。
衰老细胞促进糖尿病和糖尿病的退行性并发症。糖尿病可由胰腺细胞衰老驱动,促进胰岛炎和I型糖尿病。肥胖小鼠体内的外周衰老细胞也可能导致胰岛素抵抗和2型糖尿病。令人惊讶的是,在小鼠胰腺β细胞中通过转基因过表达p16INK4a会增加衰老细胞的数量,同时使胰岛素分泌的增加,所以衰老过程可能反映了高血糖水平的代谢补偿。同样,胰岛素抵抗可以导致高胰岛素血症,促进β细胞衰老,这提示了外周血衰老细胞与胰腺衰老相互促进。就血糖水平或糖尿病引起的并发症而言,senolytic治疗均可改善健康状况。总之,这些研究表明,抑制衰老细胞产生是干预糖尿病及其相关疾病的重点。
饮食干预与衰老 多种饮食干预可以限制衰老细胞的积累。热量限制 (Calorie restriction,CR) 是最早被确定的延长寿命的干预措施之一。因此,当发现衰老细胞可以限制寿命时,CR和细胞衰老似乎被联系在一起。在小鼠和人类中,CR会降低结肠和腹股沟白色脂肪组织中的衰老标志物。CR可防止老年动物肾脏的衰老,而高热量饮食则可加速衰老。
其他饮食干预措施同样可以延长健康寿命,或者延长寿命中位数和最大寿命。这些干预措施包括蛋氨酸限制和生酮饮食。蛋氨酸限制可降低衰老标志物和SASP,而给小鼠注射β-羟基丁酸盐 (生酮饮食产生的主要酮体) 可降低血管平滑肌和内皮细胞的衰老标志物。这些结果表明,饮食干预可以创造一个有利的代谢状态,这种状态可以限制衰老细胞的积累。
影响衰老细胞的代谢干预 如上所述,高血糖会导致衰老。因此,糖尿病可能是衰老的前兆,通过降低血糖的干预方式可以拮抗衰老细胞的形成。事实上,在小鼠诱发糖尿病后的4周内,肾脏近端小管细胞就会衰老,而通过胰岛素降低葡萄糖水平或通过抑制钠-葡萄糖共转运体SGLT2的活性抑制葡萄糖进入细胞,能阻止衰老细胞数量的增加。与此类似,阿卡波糖能通过拮抗肠道碳水化合物吸收降低血糖,从而延长小鼠寿命,还可以在家兔模型上防止饮食引起的动脉粥样硬化。另一种抗糖尿病药物二甲双胍 (metformin) 可以延长小鼠的寿命和健康期,这种药物正在进行首次临床试验,监测衰老普遍特征的变化。二甲双胍可拮抗小鼠永生成肌细胞中神经酰胺引起的衰老,也可延长人成纤维细胞和间充质干细胞的复制寿命。此外,二甲双胍通过干扰NF-kB的激活,降低了多种SASP因子的水平 (包括许多促炎细胞因子)。在椎间盘退行性病变和慢性肾脏疾病的小鼠模型上,二甲双胍对细胞衰老具有保护作用。因此,二甲双胍可以在多个水平上干扰衰老,它可能是在衰老和SASP上最典型的代谢干预分子。
动脉粥样硬化,他汀类药物和衰老 他汀类药物,如辛伐他汀,在老年人中被广泛用于预防胆固醇水平升高和动脉粥样硬化相关并发症,如中风和心脏病。这些药物通过抑制β-羟基β-甲基戊二酰辅酶A (β-hydroxy β-methylglutaryl-coenzyme A,HMG-CoA) 还原酶来阻止胆固醇的合成,HMG-CoA还原酶是甲羟戊酸途径中胆固醇生物合成的限速酶。他汀类药物通过降低内皮祖细胞中的衰老标志物来防止细胞衰老过程中的生长停滞,这一过程依赖于法尼基焦磷酸盐和香叶基焦磷酸盐水平的降低。他汀类药物还能在衰老的成纤维细胞中,抑制促炎SASP在许多方面的影响,但与内皮祖细胞一样,这种作用与药物的降胆固醇特性无关。相反,抑制HMG-CoA还原酶会降低法尼基辅酶A和香叶酰辅酶A的水平。这两种辅酶A又是rho型GTP酶(包括SASP所需的RAS和RAC)在膜定位和激活过程中所必须的。由于p16阳性 (细胞衰老标志基因) 的泡沫样内膜细胞可以加重动脉粥样硬化的有害表型,因此他汀类药物可能具有除调节胆固醇外的抗动脉粥样硬化特性。然而,他汀类药物也可以作为辐射增敏剂,增加癌细胞在辐射下的衰老。因此,他汀类药物的效果很可能具有环境特异性。令人惊讶的是,在衰老过程中p53的激活限制了甲羟戊酸和胆固醇的合成途径,这一过程可能是p53激活抑制SASP的机制。因此,衰老、胆固醇和动脉粥样硬化之间的关系可能比以前认为的更加复杂。
衰老的运动干预 尽管许多研究都强调运动对健康的益处,以及随着年龄的增长,运动可以改善健康寿命,但迄今为止,很少有研究证明运动可以延长寿命 (小鼠模型);只有一项老年运动研究表明可以延长寿命。有证据表明,运动可以防止衰老以及老年小鼠血清和心脏中的部分促炎SASP因子的积累。更值得注意的是,运动可以抵消饮食引起的衰老和小鼠脂肪和肝脏组织中的SASP,这表明运动最有益的方面可能并不适用于健康的动物,而是那些可能发生代谢性疾病的动物。在人类中,运动和活动与内皮细胞和白细胞衰老标志物减少有关。这些数据表明,运动可以抵消不良饮食和久坐等生活方式带来的衰老相关的有害影响。
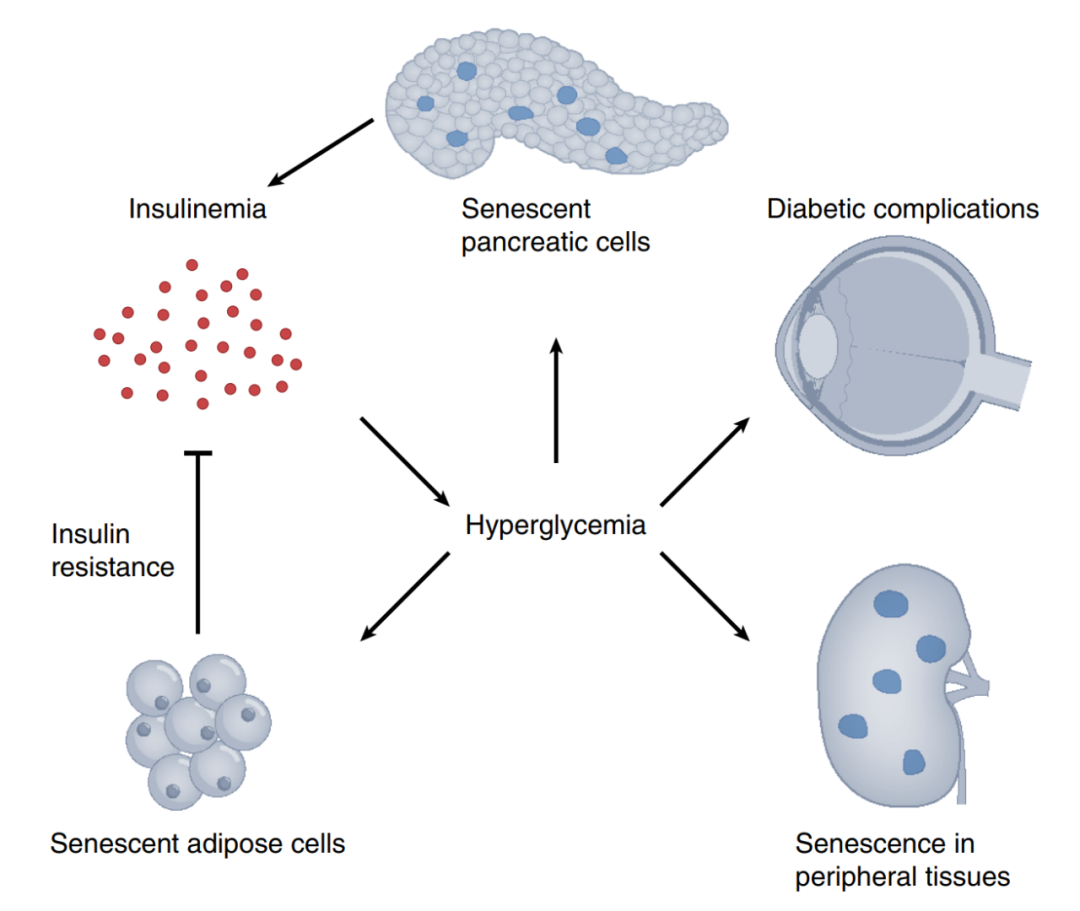
图5 衰老细胞在糖尿病及其并发症中的多种作用
衰老的脂肪细胞会导致胰岛素抵抗,从而导致高血糖,而高血糖反过来又会促进更多的脂肪组织衰老。高血糖还会迫使胰腺β细胞过度分泌胰岛素。这种压力导致β细胞衰老、胰岛素血症以及进一步的高血糖。高血糖还会导致视网膜和肾脏等周围组织的衰老,加重糖尿病并发症。
结 论
正如这篇文章所指出的,衰老细胞和全身代谢之间的相互作用是动态的。衰老细胞会破坏多种组织的代谢稳态,而这些变化反过来又会促进衰老,形成恶性循环,从而导致各种代谢疾病的发生。这个循环发生在NAD+的环境中,其中SASP促进CD38依赖的NAD+被免疫细胞分解,而降低的NAD+水平反过来可以促进衰老 (图2)。同样,外周细胞衰老会导致胰岛素抵抗,而胰岛素抵抗反过来又会导致胰腺β细胞的应激和衰老。这种恶性循环导致血糖升高,眼睛和肾脏衰老,最终导致糖尿病并发症 (图5)。这些反馈的恶性循环需要能打破循环的干预才能改善。
针对衰老细胞及其退行性疾病有三种类型的干预。首先,我们可以减缓衰老细胞的形成,就像在饮食限制和类似干预中观察到的那样。其次,我们可以允许衰老细胞积累,但防止它们造成伤害,正如在二甲双胍介导的SASP抑制或CD38抑制后所观察到的。最后,我们可以用senolysis去除衰老细胞。与前两种干预方法不同,senolysis可以间歇使用。采用一种“打了就跑”的使用方式,使senolysis更容易在人身上使用,而饮食和抑制药物疗法需要定期坚持,以保持疗效。
在衰老细胞中观察到的代谢变化也暗示了衰老相关疾病可能是由衰老细胞驱动的。例如,最近的研究表明,哺乳动物在出生前衰老细胞就存在于绒毛膜上,这些细胞发出信号促进分娩。考虑到前列腺素E2 (prostaglandins E2,PGE2) 和F2α (prostaglandins F2α,PGF2α) 会促进分娩,衰老相关的前列腺素可能是人类正常分娩 (或早产) 所需要的一部分。前列腺素也有其他作用,如PGD2在睡眠启动中的重要作用。考虑到许多人随着年龄的增长而经历睡眠中断,很容易推测衰老细胞可能产生额外的PGD2,从而导致与衰老相关的睡眠中断。
最后,衰老是人类营养摄入的一个主要后果,而营养干预可以预防许多与衰老相关的疾病。在长寿和衰老中常量营养元素的作用已经比较清楚,但对关键微量营养元素的营养不良如何诱导衰老过程却知之甚少。例如,胆碱缺乏常见于美国老年人中,是肝脂肪变性的一个驱动因素。然而这种情况也会在衰老过程中由衰老细胞引起。因此,营养与衰老之间的关系是未来探索的沃土,这无疑将是需要进一步研究的主题。
诚然,新陈代谢和细胞衰老之间相互作用的许多方面还需要进一步的研究。然而,令人鼓舞的是,现代生物学的新兴工具,包括单细胞技术,系统生物学和人工智能,使人们更容易深入了解这种复杂的相互作用,这无疑将在未来促进人们更有效地干预衰老相关的代谢疾病。



