乔梦医生:失败不是终点,动态监测ctDNA指导结直肠癌再挑战抗EGFR治疗
时间:2023-08-09 21:45:00 热度:37.1℃ 作者:网络
目前在所有瘤种中发病率第二的转移性结直肠癌(mCRC),其治疗主要依赖于化疗为基础的综合治疗。靶向药物的加入,如抗EGFR抗体西妥昔单抗和帕尼单抗,提高了患者的存活率。然而不幸的是,几乎所有使用EGFR阻滞剂治疗的患者会产生抗体耐药。从分子角度看,抗EGFR治疗的获得性耐药主要与两种机制有关:
- 第一种机制涉及EGFR下游效应器(KRAS、NRAS和BRAF)中出现激活突变,
- 第二种机制依赖于EGFR胞外域(ECD)的突变,这种突变影响抗体与其靶标的结合。
对于EGFR阻断药物治疗初始有反应后续复发耐药的患者,其后续治疗方案的选择仍然是一个需被解决的临床问题,基于两个原因:
首先,复发患者的分子基础有个体特异性,并且难以被定义,因为在这种情况下,患者缺乏系统的组织活检;
第二,KRAS和NRAS继发性突变,发生率大约30%-40%,目前缺乏有效的治疗,因为相应的蛋白质对药理阻断具有抵抗性。
因此,在化疗加抗EGFR治疗失败后,mCRC患者通常会接受额外的标准化疗(基于伊立替康和/或奥沙利铂的方案)联合抗血管生成药物。目前,所有这些治疗方法都不是基于分子特征进行选择的精准治疗。
在往期“肿瘤学年鉴”中,Parseghian等人提供证据表明:监测患者循环肿瘤DNA(ctDNA)中KRAS和EGFR 胞外域突变的水平与治疗疗效相关。具体地说,他们的研究表明,血液中耐药突变的跟踪动力学可以用来指导额外的抗EGFR治疗。
这项研究建立在目前测量实体瘤患者血液中肿瘤来源的体细胞变异的技术取得了非凡进展的基础上。ctDNA的分析,通常被称为液体活检,能够非侵入性地识别在治疗演变过程中出现的分子变化,从而能够实时地对整个疾病进行遗传图谱分析。
同时Parseghian等人的研究结果表明,依赖于先前的证据,即可以在ctDNA中检测到与抗EGFR治疗耐药相关的基因突变。此外,在2015年,有研究报告了在EGFR阻断治疗期间血液会监测到KRAS突变克隆,而停止抗EGFR抗体治疗后KRAS突变下降,表明在临床进展之外基因克隆进化仍在持续。
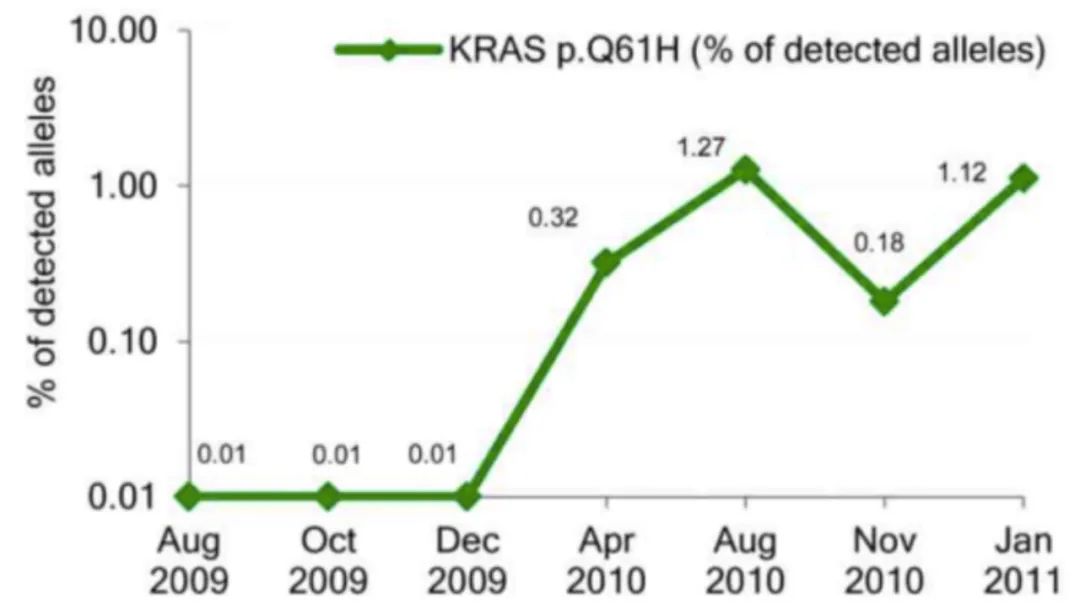
停止抗EGFR治疗时血液中KRAS突变的衰减表明在治疗过程中基因克隆性进化。然而,发生这一过程的分子基础尚未阐明。最直观的假设也得到了Parseghian等人的支持,即遵循达尔文进化理论,具有最高适应度的细胞(KRAS和EGFR突变体)能够存活,最终导致治疗失败。然而,这种抗性细胞的适应度可能天生有限,允许剩余(敏感/野生型)细胞群体的快速(重新)增长。虽然KRAS激活变体可能确实是这种情况(这使得CRC细胞不受上游EGFR抑制的影响),但EGFR 胞外域突变如何在没有EGFR阻断的情况下对CRC细胞的适合性产生负面影响,从而导致血液中的衰减,原因并不明朗。这些问题在未来需要进一步研究,因为它们可以揭示接受抗EGFR抗体治疗患者中,影响发生的基因克隆竞争和适合性改变的细胞机制。
目前研究中最重要的发现是对血液中KRAS和EGFR衰变动力学的准确测定,虽然到目前为止,这一动力学改变仍然没有明确的定义。为了解决这个问题,Parseghian等人分析了135例接受了EGFR阻断治疗,在治疗过程中获得RAS和/或EGFR突变的RAS/BRAF野生型mCRC患者的ctDNA样本。另外两个患者队列包括:(I)验证队列,73名患者包含ctDNA基因图谱数据,提示之前通过系列血液样本使用抗EGFR治疗;(II)单独的回顾性数据集,包括107例,以评估总体应答率和重新挑战抗EGFR治疗的中位时间。
结果显示,RAS和EGFR突变克隆的相应等位基因突变频率呈指数衰减,半衰期大约4.4个月 (图1)。有趣的是,当某个突变位点单独分析时,发现RAS基因突变克隆衰减更快(半衰期为3.7个月),而EGFR在4.7个月内下降。
最重要的是,在回顾性队列中,从停止抗EGFR治疗到再次挑战治疗的时间间隔越长,总体应答率就越高。这种相关性是存在的,表明在这种情况下,未来的研究应该着重于探索ctDNA动力学变化来指导治疗,在重新开始抗EGFR治疗之前最大限度地减少RAS/EGFR突变水平为目标。
此外,应仔细考虑两次接触EGFR阻滞剂之间的时间间隔,因为这会影响再激发抗EGFR治疗的疗效。这也与之前的证据一致,即在第二轮治疗中,血液中衰减的抗性克隆再次表达上升。
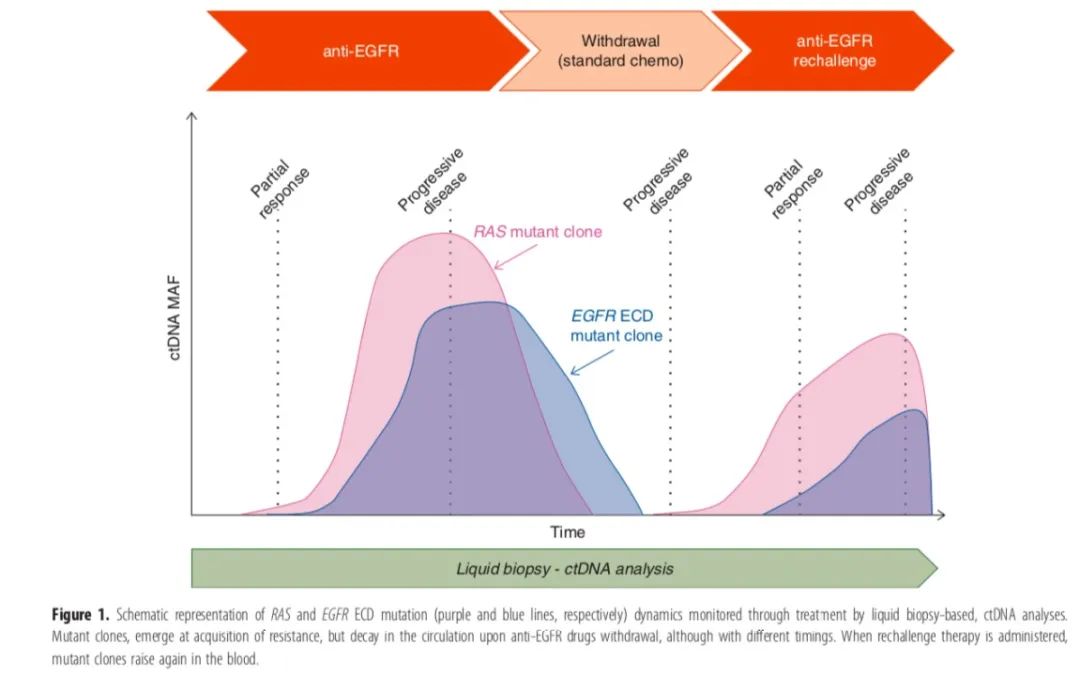
首先,衰减的抗性克隆进一步鼓励为最初对抗EGFR治疗有反应的mCRC病例提供多种抗EGFR再挑战疗法。其次,它们为液体活检(测量KRAS和EGFR突变克隆)的使用、监测肿瘤动力学(克隆的半衰期)和指导再挑战治疗的时机提供了额外的支持。
值得注意的是,建立在监测基因克隆动力学基础上的临床实验已经在进行中。例如,CHRONOS试验(NCT03227926)旨在应用液体活检来识别最初对抗EGFR治疗有反应的mCRC患者,再挑战治疗中获益的人群。在CHRONOS试验中,患者接受基于RAS/BRAF ctDNA动力学监测的第二轮抗EGFR药物治疗;具体地说,当RAS/BRAF水平从最初水平下降>50%时,患者可再次接受抗EGFR治疗。
基于Parseghian等人的研究结果,未来的研究很可能还需要找到合适的再挑战抗EGFR治疗的时间,例如,直到血液中突变的RAS表达水平降到最低(变得不可检测),再开始再挑战抗EGFR治疗。未来的研究还应该包括测量EGFR胞外域突变频率,因为正如目前研究结果显示的那样,当耐药后停止EGFR治疗,其突变频率也随之发生了衰退。
参考文献:
1. Parseghian CM, Loree JM, Morris VK et al. Anti-EGFR-resistant clones decay exponentially after progression: implications for anti-EGFR re-challenge. Ann Oncol 2019; 30(2): 243–249.
2. Misale S, Yaeger R, Hobor S et al. Emergence of KRAS mutations and acquired resistance to anti-EGFR therapy in colorectal cancer. Nature 2012; 486(7404): 532–536.


