Cir Res:空军军医大学韩骅教授团队发现TMEM215通过抑制线粒体相关内质网膜的钙离子流介导的凋亡调控血管修剪
时间:2023-10-05 17:18:20 热度:37.1℃ 作者:网络
在血管生成过程中,新生的初级血管网要经历修剪退化和成熟才能转变为具有最佳层级结构和完备功能的血管网络。同样,在某些病理条件下,一些成熟的血管网络也会发生血管闭塞和退化。针对血管修剪退化已经开发了不同的药物并应用于治疗肿瘤等病理性血管生成相关疾病。因此,更好地理解血管修剪退化的分子机制有望为病理性血管生成相关疾病提供新的治疗靶点和策略。
韩骅教授课题组前期研究发现,内质网定位的跨膜蛋白TMEM215在出生后血管新生活跃的组织如视网膜内表达较高,且在内皮细胞中的表达水平最高,敲低TMEM215可诱导内皮细胞死亡,表明TMEM215可维持内皮细胞存活(Liu Y et al, J Cell Physiol 2018;1–10)。然而,内皮细胞TMEM215在血管生成中的功能和具体机制尚不清楚。
2023年9月26日,空军军医大学基础医学院韩骅教授团队在Circulation Research杂志(IF=20.1)发表了题为“TMEM215 prevents endothelial cell apoptosis in vessel regression by blunting BIK-regulated ER-to-mitochondrial Ca influx”的研究成果。该研究首次报道了内皮细胞TMEM215在血管修剪过程中的保护作用, 详细揭示了内皮细胞TMEM215缺陷通过解离BiP/BIK复合物促进BIK介导的线粒体相关内质网膜钙流,进而导致线粒体途径细胞凋亡的分子机制及潜在转化价值。

首先,作者利用多种细胞死亡抑制剂筛选,发现只有抑制泛Caspase的凋亡抑制剂Z-VAD-FMK能有效阻断TMEM215敲低导致的内皮细胞死亡,并且tCasp9、aCasp9、aCasp3和Cyto C等蛋白水平在敲低组显著升高,明确了敲低TMEM215显著激活内皮细胞内源性凋亡信号通路。
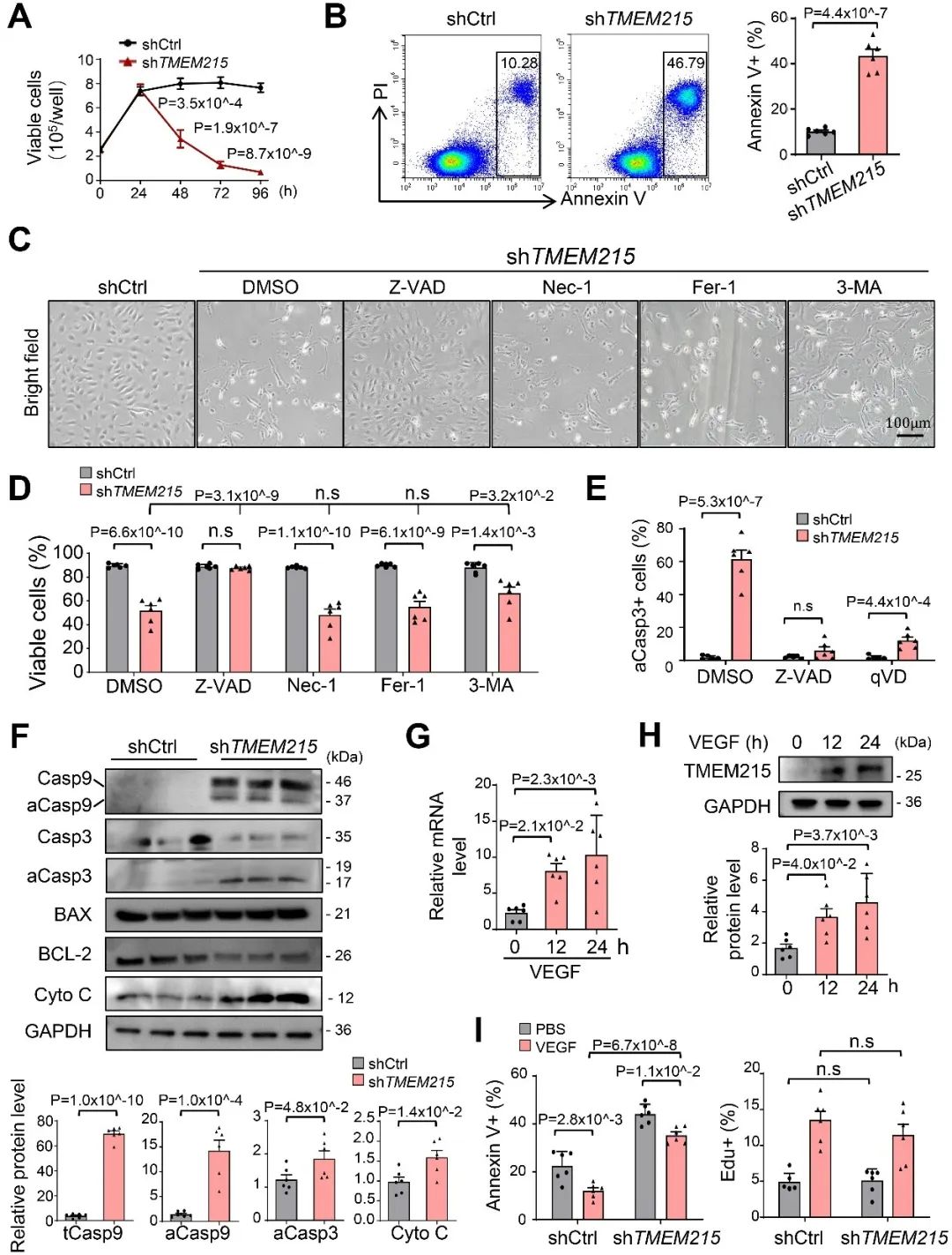
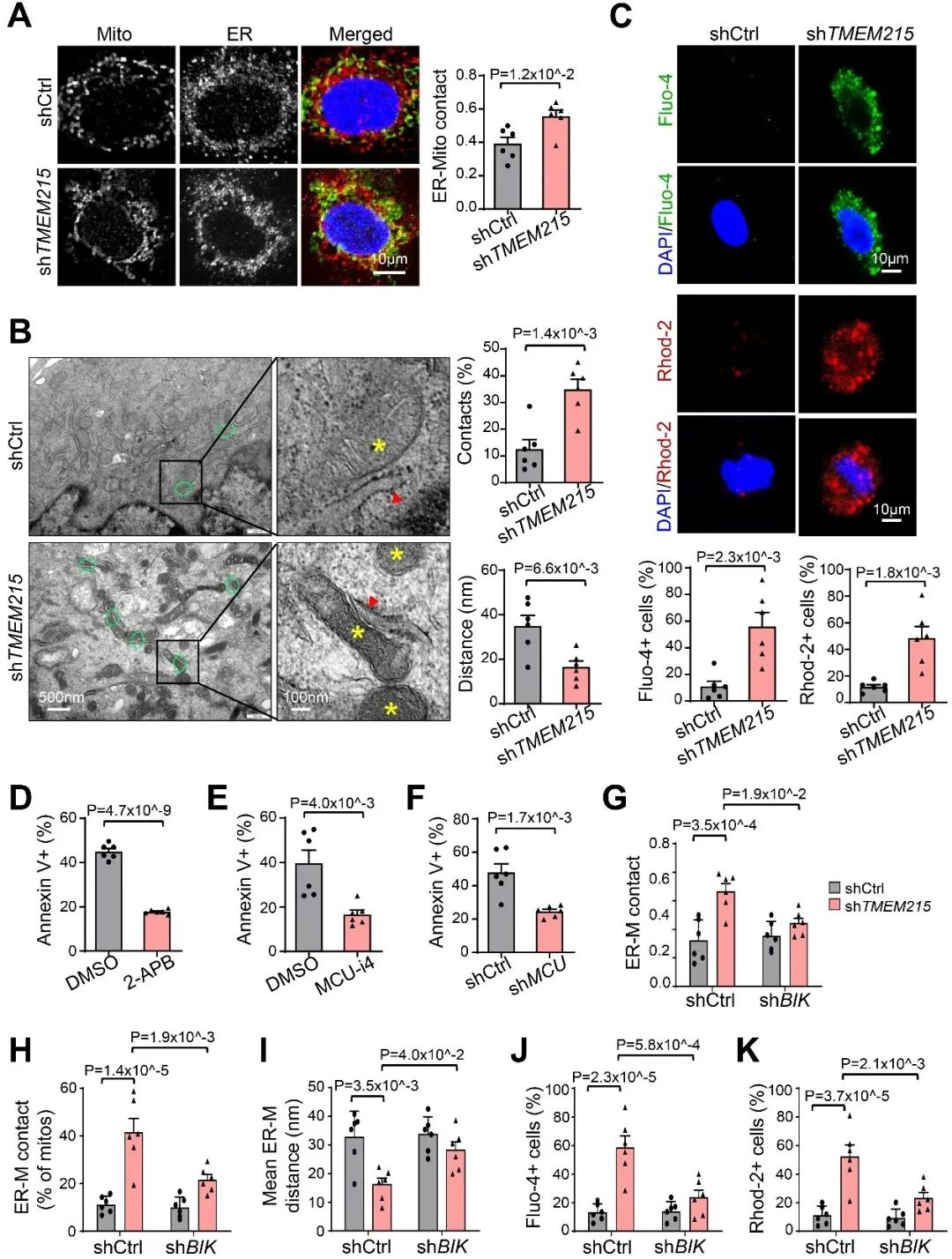
接着,为进一步探究敲低TMEM215导致内皮细胞内源性凋亡的具体机制,作者采用免疫共沉淀-质谱实验与超分辨率显微镜分析鉴定出与TMEM215相互作用的蛋白质,发现TMEM215通过促进BiP和BIK的相互作用抑制BIK保护内皮细胞免于凋亡。敲低TMEM215增加了线粒体相关内质网膜(mitochondria-associated endoplasmic reticulum membrane, MAMs)的数量,缩短了线粒体外膜与内质网膜间(ER-Mito)的距离,并伴随着线粒体钙离子和Cyto C水平的升高。
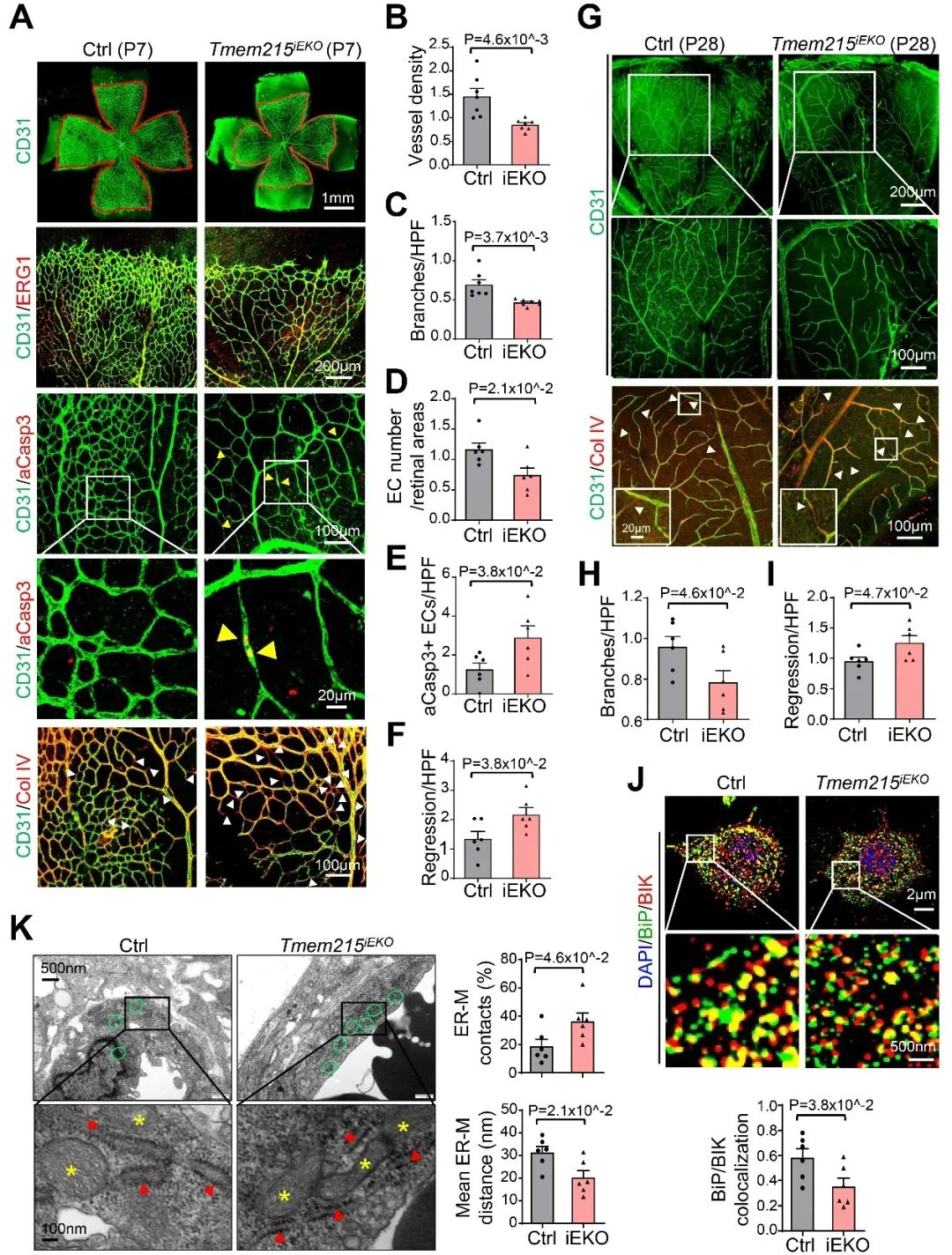
作者进一步探究内皮细胞TMEM215在血管生成中的功能。通过构建内皮细胞诱导性TMEM215敲除小鼠,作者发现TMEM215敲除后视网膜生理性新生血管和肿瘤病理性新生血管密度均显著降低,血管分支数和连接数减少,凋亡细胞和空基底膜套(empty basement membrane sheath, EBMS)增多,确定TMEM215敲除后新生血管过度修剪退化;同时,在TMEM215敲除小鼠也观察到了内皮细胞BiP/BIK解离、MAMs的数量增加、ER-Mito距离缩短。最后,针对这一发现,作者应用靶向抑制内皮细胞TMEM215的纳米材料,在不同疾病模型中成功缓解病理性血管生成,从而延缓病理性血管生成相关疾病的进展。
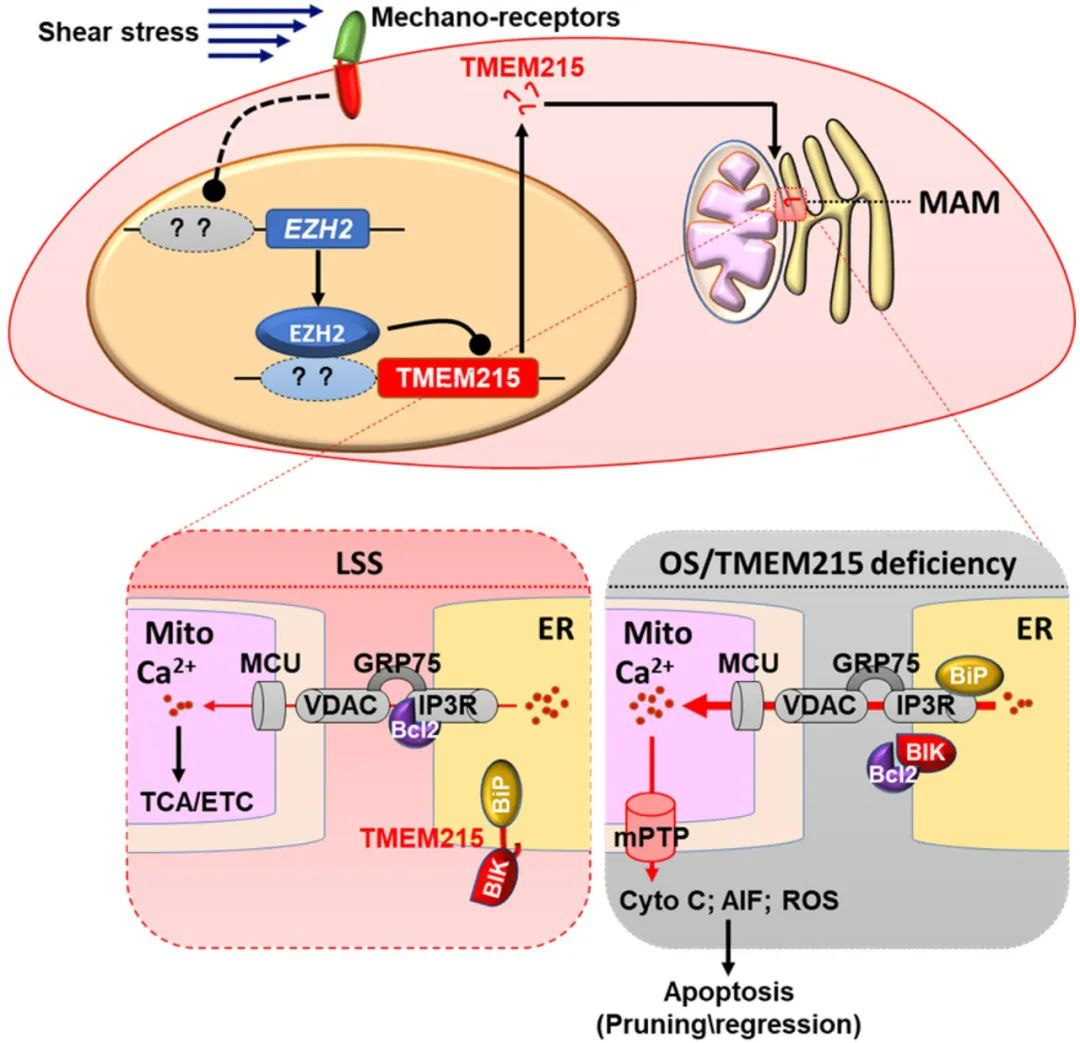
以往认为,血管修剪中内皮细胞凋亡的主要调控机制是BCL2-BAK/BAX通路。MAMs是内质网-线粒体互作的关键节点,广泛参与细胞稳态,但MAMs介导细胞凋亡在血管修剪中的作用尚未被报道。本研究首次发现内皮细胞TMEM215缺陷促进BIK调控的MAMs钙离子流,进而导致细胞发生线粒体途径凋亡。在血管修剪退化过程中,TMEM215维持内皮细胞生存,靶向抑制内皮细胞TMEM215可通过增加血管修剪抑制病理性新生血管形成,显著延缓病理性血管生成相关疾病的进展,有望成为病理性血管生成相关疾病治疗的新靶点,具有重要的潜在应用价值。
该研究由空军军医大学基础医学院生物化学与分子生物学教研室韩骅教授团队完成,韩骅教授、梁亮副教授和郑奇军教授为该论文的共同通讯作者。张沛然讲师、晏贤春副教授和张小燕硕士为该论文的共同第一作者。该研究获得国家自然科学基金重大研究计划“血管稳态与重构的调控机制”等项目资助。
原文链接:
https://doi.org/10.1161/CIRCRESAHA.123.322686


