三番四覆 | 从ETER701研究看安罗替尼在SCLC治疗中再创新高度!
时间:2023-10-16 17:29:30 热度:37.1℃ 作者:网络
今年的WCLC于9月10-12日在新加坡举办,本届WCLC内容可谓精彩纷呈,SCLC领域有多项中国研究登上Oral,其中包括安罗替尼联合Benmelstobart(贝莫苏拜单抗)和化疗一线治疗广泛期小细胞肺癌的III期研究(ETER701)。
安罗替尼是抗血管生成药物,大家都很熟悉了,在SCLC治疗中获批了三线适应症。贝莫苏拜单抗是正大天晴公司原研的PD-L1单抗(尚未获批)。
这种四药联合的模式在NSCLC中也做过探索,正在召开的WCLC会议中刚刚公布的IMpower151研究结果为这种模式泼上了一盆冷水,阿替利珠单抗+贝伐珠单抗+化疗相较于贝伐珠单抗+化疗无论PFS还是OS均未能取得显著获益(mOS 20.7 vs 18.7个月,HR=0.93[0.67-1.28])[1]。
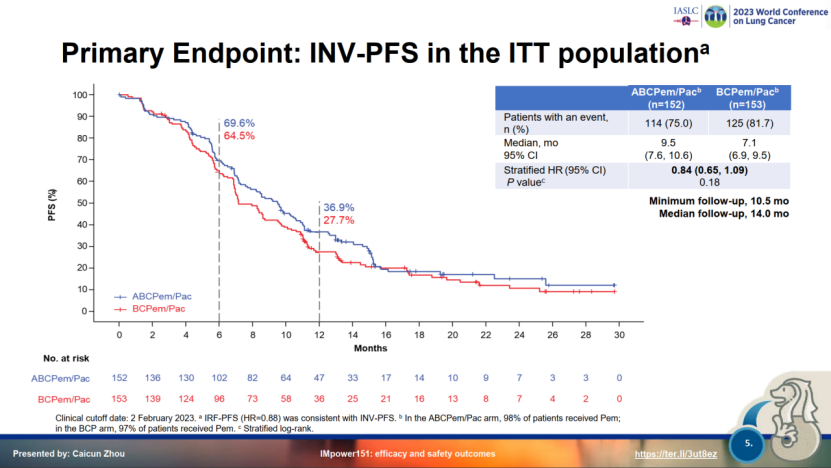
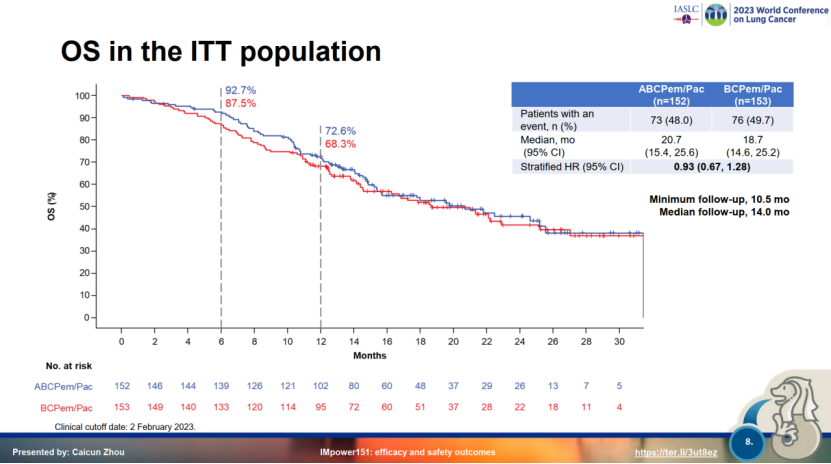
那么这次免疫+抗血管+化疗的四药模式能否在SCLC中为自己正名呢?
从研究设计上看,这是一个3臂的研究,A组是安罗替尼+贝莫苏拜单抗+化疗诱导治疗4周期,随后安罗替尼+莫苏拜单抗维持治疗;B组是安罗替尼+化疗诱导治疗4周期,随后安罗替尼维持治疗;C组是安慰剂+化疗诱导治疗4周期,随后安慰剂维持治疗。(本次公布的数据截止日期为2022年5月14日,中位随访14.0个月)。这是SCLC中第一个以四药模式一线治疗的III期临床研究,在9月10日WCLC的SCLC专场上公布了A组和C组的结果[2]。
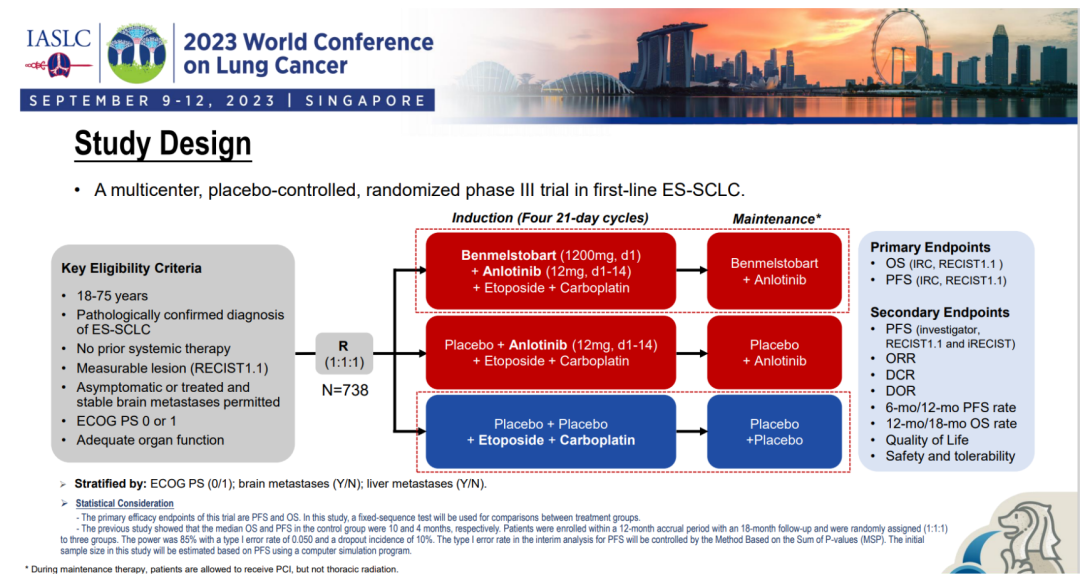
安罗替尼+贝莫苏拜单抗+化疗:mOS 19.32个月
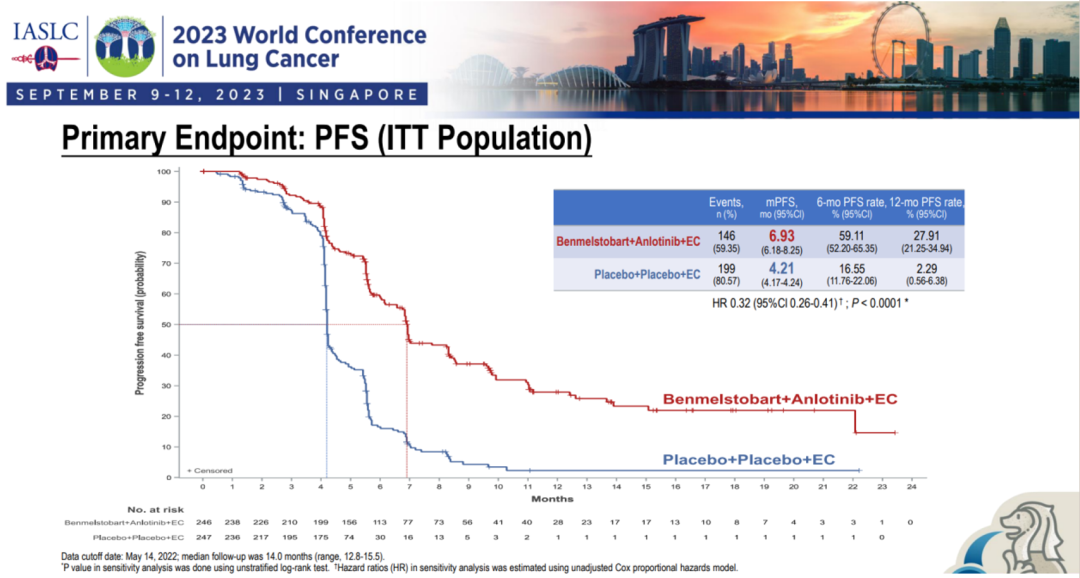
结果显示,安罗替尼+贝莫苏拜单抗+化疗(A组)的mOS为19.32个月,安慰剂+化疗(C组)的mOS为11.89个月,HR值为0.61(0.46-0.79),P=0.0002,达到显著性差异。mPFS也是显著获益:6.93个月(A组) vs 4.21个月(C组),HR值为0.32,P<0.0001。
此前,进口或国产PD-1/PD-L1联合化疗一线治疗SCLC的mOS均在12-15个月左右,这次安罗替尼+贝莫苏拜单抗+化疗将mOS提高到了19个月,让生存预后很差的广泛期SCLC彷佛又看到了一道曙光。
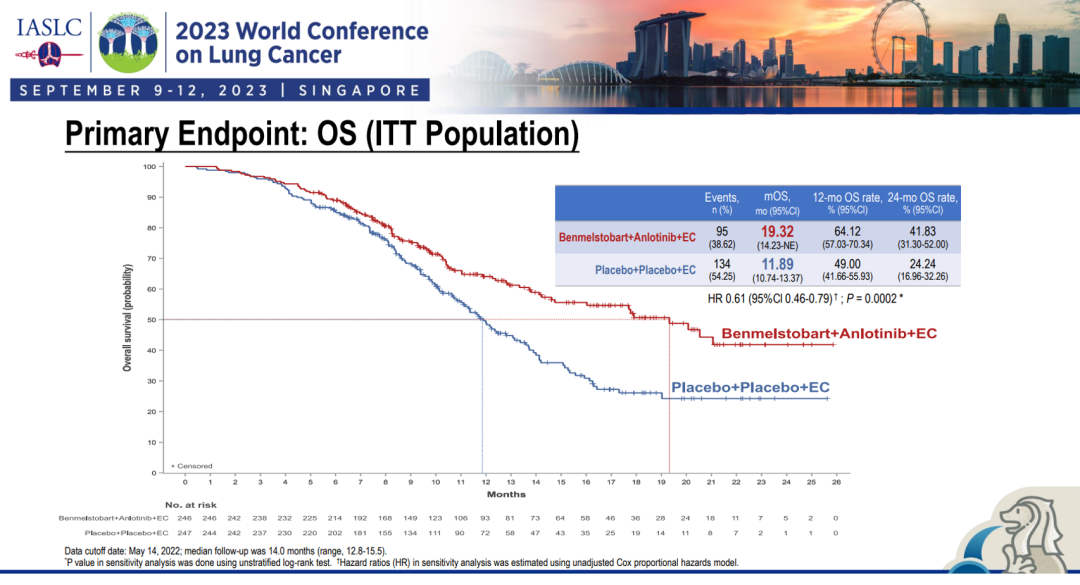
在看到结果激动之余也有遗憾,遗憾的是本次只公布了A组和C组的结果,
B组(安罗替尼+化疗)的数据未公布,所以还不能确定免疫和抗血管是谁对mOS的延长起了主要作用。
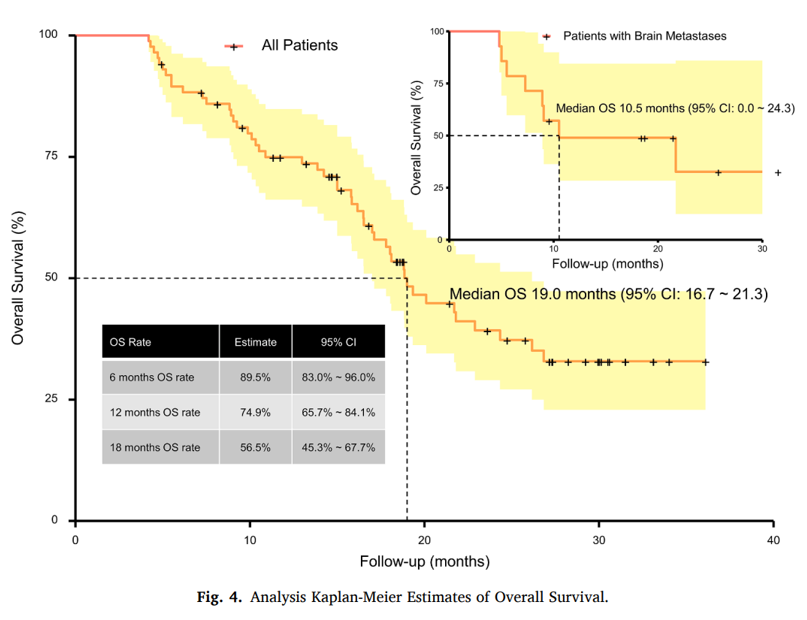
为什么B组结果没有公布?从Patients Disposition图上看A组到数据截止时间有54例病人在继续接受治疗,B组只有26个病人在继续接受治疗。按理说B组的数据应该比A组成熟度更高,已达到可以公布的程度,推测有可能是B组的mOS也较长(可能和A组不相上下),因为安罗替尼联合化疗(不加免疫)曾有过在SCLC一线的探索,OS也是19个月。这正是让人担忧的地方,究竟免疫的加入起到多大作用。

2022年韩宝惠教授团队发表过一篇安罗替尼+化疗一线治疗SCLC的多中心II期研究结果(86例),结果显示安罗替尼+化疗的mOS就已经达到了19.0个月,mPFS为9.0个月[3]。回看贝莫苏拜单抗+安罗替尼+化疗19.32个月的mOS,或许是抗血管一线的加入显著延长了mOS。
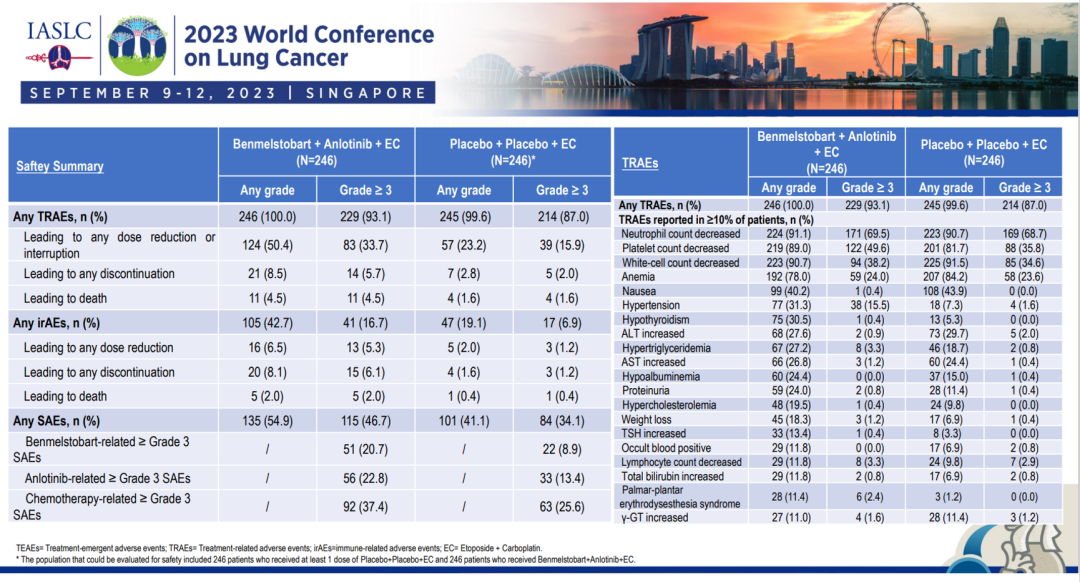
本次公布的安全性结果同样也只有A组和C组,安罗替尼+贝莫苏拜单抗+化疗(A组)对比单纯化疗(C组)总体不良反应(TRAE)发生率相当(100% vs 99.6%)。其中,导致剂量调整或治疗中断的不良反应A组要高于C组(50.4% vs 23.2%)。免疫相关不良反应,A组也要高于C组(42.7% vs 19.1%)。可以看出免疫联合抗血管毒性是有所增加的,不过这要结合mOS获益来看是否利大于弊。如果免疫+抗血管+化疗的生存获益与抗血管+化疗的相当,那毒性的增加就显得有点得不偿失了。
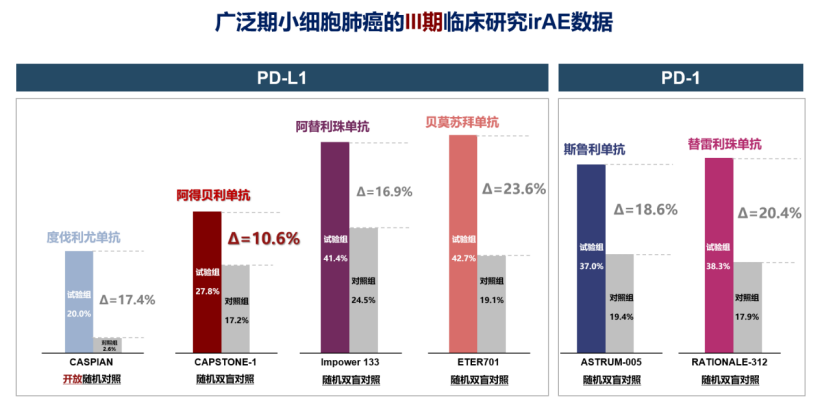
目前已经公布数据的6款PD-1/PD-L1在安全性上的表现是有较大差别的。从免疫相关不良反应(irAE)数据看,阿得贝利单抗更加优异。
CAPSTONE-1研究试验组irAE发生率为27.8%(vs 对照组17.2%),相较于对照组仅提升10.6%[5];CASPIAN是开放标签的研究,度伐利尤单抗组irAE发生率为20.0%(vs 对照组3.0%)相较于对照组提升17%[6];IMpower133研究中,阿替利珠单抗组irAE发生率为41.4%(vs 对照组24.5%),相较于对照组提升16.9%[7];ETER701研究中,贝莫苏拜单抗组irAE发生率为42.7%(vs对照组19.1%),相较对照组提升23.6%[2];2款PD-1抑制剂ΔirAE较高,ASTRUM-005研究中,斯鲁利单抗组irAE发生率为37.0%(vs对照组18.4%),相较于对照组提升18.6%[8];RATIONALE-312研究中,替雷利珠单抗组irAE发生率为38.3%(vs对照组17.9%),相较于对照组提升最高,达20.4%[9]。从irAE的Δ值看,阿得贝利单抗在所有PD-1/PD-L1中安全性更好。
阿得贝利单抗安全性更佳,究其原因是选择了IgG4抗体并且做了独特的抗体改造。既往人们认为PD-L1表达在肿瘤细胞上,而PD-1表达在T细胞表面,因此PD-L1抗体保留Fc段效应功能(ADCC,CDC,ADCP等效应),不仅可以阻断这一信号通路,同时也可以进一步杀伤肿瘤细胞,增强疗效。然而随着对于免疫微环境了解的不断深入,人们发现,PD-L1不仅仅表达在肿瘤细胞表面,在T细胞,树突细胞,巨噬细胞等表面均有表达,甚至某些细胞的表达量还高于肿瘤细胞[4]。如果抗体具有Fc段效应功能,甚至有目的的增强效应功能,可能会导致免疫微环境中的免疫细胞被杀伤,导致不可控的疗效损失和不良反应。
IgG4型抗体本身无补体依赖的细胞毒性作用(CDC),同时阿得贝利单抗进一步通过Fc段234A/235A定点突变改造,进一步降低了和免疫效应细胞表面FcγR结合的能力,从而消除了抗体依赖的细胞介导的细胞毒性作用(ADCC)、抗体依赖的细胞介导的吞噬作用(ADCP),同时也降低了抗体依赖性细胞因子释放(ADCR)效应,抗体功能更加纯净。此外,其Fab段采用S228P突变改造,避免lgG4抗体的Fab臂交换,抗体更加稳定。
不管怎么说,ETER701研究的成功值得骄傲,中国研究再次引领世界,再次刷新了ES-SCLC的mOS。但是,我们仍需思考数据背后的启示。目前能得到的结论是抗血管+免疫+化疗对比单纯化疗能够带来显著OS获益,但抗血管+免疫+化疗是否优于抗血管+化疗?我们仍要等待B组结果的公布。联合治疗不是简单做加法,SCLC治疗是一条荆棘之路,仍有许多难点和问题亟待我们去探索。
参考文献:
[1] Caicun zhou. 2023WCLC. OA09.06
[2] Ying Cheng. 2023WCLC. OA01.03
[3] Baohui Han. Lung Cancer. 2022 Nov 10;13:1035323.
[4] Peng Q, et al., Nat Commun. 2020 Sep 24;11(1):4835
[5] Ying Cheng. 2022 AACR. CT038
[6] Luis Paz-Ares, et al. 2021ESMO. LBA61
[7] Liu SV et al., ESMO 2020 No.1781MO
[8] Ying Cheng. 2022ESMO ASIA. LBA9.
[9] Ying Cheng. 2023WCLC. OA01.06











