【协和医学杂志】细菌性阴道炎实验室诊断研究进展
时间:2023-11-18 21:34:46 热度:37.1℃ 作者:网络
综 述
细菌性阴道炎(BV)是由阴道内正常产生过氧化氢的乳杆菌减少或消失、厌氧菌(动弯杆菌、普雷沃氏菌)和兼性厌氧菌(阴道加德纳菌、阴道阿托波菌)过度繁殖导致的阴道微生态平衡失调,表现为混合感染,影响全球8%~23%的女性健康,多发生在性活跃期[1]。
BV不仅与盆腔炎、不孕症、性传播病原体(人乳头瘤病毒、人类免疫缺陷病毒、淋病奈瑟菌、沙眼衣原体等)感染风险增加相关,妊娠期合并BV还可能导致早期流产、早产、产后子宫内膜炎和新生儿低出生体重等不良妊娠结局[2-3]。导致BV的病原体多样,且经治疗后复发率高(治疗后12个月复发率高达60%)。研究表明,不同地区、种族、就诊人群的BV感染率存在差异,健康体检女性占比约2%~11%,而因阴道炎相关症状就诊的患者占比约为36%~60%[4]。
然而,约10%~50%的BV患者无临床症状,易漏诊[5],快速、准确的检测方法能够对BV患者进行及时诊断和治疗、避免不良结局的发生。因此,本文就BV的诊断标准、阴道微生态评价以及新型检测方法等研究进展作一综述,以期为BV的临床诊断和治疗提供借鉴与参考。
1 BV诊断标准
1.1 Amsel诊断标准
该诊断标准由Amsel等学者于1983年提出,是BV临床诊断的金标准,即符合下列4项标准中的3项可诊断为BV:(1)均质、稀薄、灰白色的阴道分泌物;(2)胺试验阳性;(3)阴道分泌物pH值>4.5;(4)线索细胞阳性(线索细胞数量>20%阴道上皮细胞总数)[6]。
中华医学会妇产科学分会感染性疾病协作组发布的《细菌性阴道病诊治指南(2021修订版)》将上述“标准(4)”列为BV诊断的必要条件。2021年美国疾病控制和预防中心(CDC)公布的《性传播疾病治疗指南》和2020年美国妇产科医师协会(ACOG)公布的《非妊娠期阴道炎管理指南》中不再将其作为必要条件[4,7-8]。
该方法操作简便、成本较低,能够在实验室条件有限的医疗机构中开展,其灵敏度为37%~70%,特异度为94%~99%,可重复性较低,且由于评估基于不可量化的临床症状进行,易受到潜在的观察者间偏差影响[9]。
1.2 Nugent评分标准
该评分标准最早由Nugent等于1991年提出,目前已成为BV实验室诊断的金标准[10]。
该方法将阴道分泌物进行革兰染色,并在10×100倍油镜下观察不同细菌的形态类型:乳杆菌(革兰染色阳性,细长弯曲或杆状、球杆状)、加德纳菌(革兰染色阴性,短杆状或小变形杆状)、普雷沃氏菌(革兰染色阴性)和动弯杆菌(革兰染色阴性、弯曲杆状;革兰染色不定、弯曲或弧形小杆状),根据每10个视野下的平均细菌数量进行评分:0~3分为正常,4~6分为BV中间态,≥7分诊断为BV,评分标准见表1[4]。
表1 Nugent评分标准
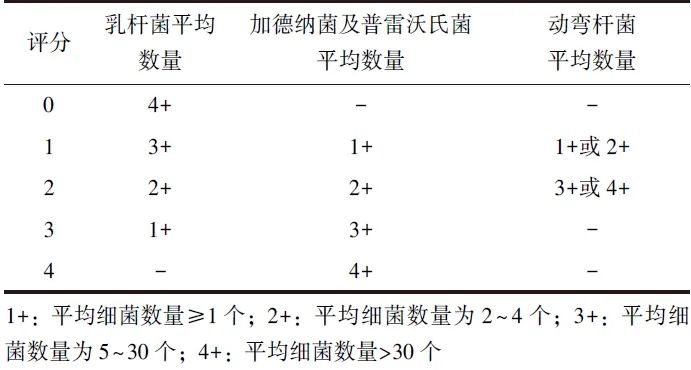
该方法经济、省时,玻片可长期存放,但制片和阅片过程尚未标准化,且表现为中至重度阴道炎症状的绝经后BV患者阴道细菌群落与绝经前BV患者不同,无法通过Nugent评分进行诊断[11]。如将镜检与阴道细菌代谢产物检测结果相结合,能够更客观、精准地诊断BV。
1.3 Hay-Ison评分标准
Hay-Ison评分是《2018 欧洲国际性病控制联盟/世界卫生组织关于阴道分泌物(阴道炎症)管理指南》推荐的BV诊断最佳方法[12]。
对阴道分泌物的革兰染色涂片进行定性分级:
(1)0级为正常,仅见上皮细胞,未见细菌,提示近期使用过抗生素;
(2)1级为正常,乳杆菌为优势菌群;
(3)2级为BV中间态,乳杆菌减少,混合其他菌群,可见阴道加德纳菌或动弯杆菌;
(4)3级诊断为BV,乳杆菌显著减少或消失,以阴道加德纳菌和(或)动弯杆菌为主,可见线索细胞;
(5)4级与BV无关,无乳杆菌存在,仅可见革兰阳性球菌。
与Nugent评分标准比较,Hay-Ison评分对阴道微生物群的评估更全面,定量过程简化,仅进行定性分类,缩短了评估时间[13]。
2 阴道微生态评价
阴道微生态系统由阴道解剖结构、阴道微生物群、机体内分泌系统和局部免疫系统共同组成。正常阴道微生态具有以下特点:阴道菌群密集度为Ⅱ~Ⅲ级、多样性为Ⅱ~Ⅲ级、以革兰阳性杆菌为优势菌、pH值为3.8~4.5、乳杆菌功能正常、白细胞酯酶(LE)阴性,任意一项指标异常,则判定为阴道微生态失调,阴道对病原微生物抵抗力降低,可继发感染。中华医学会妇产科学分会感染性疾病协作组建议将形态学检测与功能学检测相结合,如二者检测结果不一致,则以形态学检测结果为准[14]。
2.1 形态学检测
与BV诊断相关的形态学检测指标包括阴道菌群密集度、阴道菌群多样性、优势菌群。阴道菌群密集度通过10×100油镜下每个视野的平均细菌数反映阴道分泌物菌群总生物量:Ⅰ级即平均细菌数为1~9个,Ⅱ级为10~99个,Ⅲ级为100个及以上且光镜下细菌满视野,Ⅳ级为细菌聚集成团或密集覆盖于上皮细胞[14]。阴道菌群多样性反映微生态中细菌种类的丰富程度,Ⅰ级为1~3种,Ⅱ级为4~6种,Ⅲ级为7~9种,Ⅳ级为10种及以上[14]。优势菌群是对宿主生理病理影响最大的细菌,包括革兰阳性杆菌、革兰阳性球菌/弧菌、革兰阴性短杆菌/弧菌[14]。
2.2 功能学检测
与BV相关的功能学检测指标包括pH值、过氧化氢浓度、唾液酸苷酶(SLD)、LE。
2.2.1 pH值
采用干棉签刮取阴道分泌物,用精密pH试纸(pH值正常范围3.8~4.5)检测pH值。该方法快速、经济、简便,尤其适用于无显微镜设备的医疗机构,但易受到与BV无关的因素如近期性交、阴道灌洗、合并其他阴道感染的影响。
2.2.2 过氧化氢浓度
由于过氧化氢在酶的催化作用下可与底物发生显色反应[15-16],且阴道中的过氧化氢来源于乳杆菌。因此,可使用试剂盒或改良的MRS肉汤培养基检测过氧化氢浓度,从而判断阴道内乳杆菌含量。
2.2.3 SLD
SLD是阴道加德纳菌、普雷沃氏菌、拟杆菌、动弯杆菌等合成的一种特异性酶,其活性与病原菌数量成正比,以阴道上皮细胞表面的唾液酸聚糖为底物,在生物膜的形成中发挥重要作用。
BV患者阴道分泌物标本SLD活性高于正常女性,且高水平SLD活性与早产风险相关[17]。目前,临床普遍采用人工合成的外源性底物与SLD发生显色反应,对BV诊断具有很高的预测价值。
OSOM BV Blue(Sekisui Diagnostics公司,美国)是一种测定阴道分泌物中SLD水平的快速检测试纸,10 min内即可获取结果,以Nugent评分和Amsel评分作为金标准,其灵敏度均为88%,特异度分别为95%和91%[18]。
Liu等[19]报道四价唾液酸包被的四苯乙烯发光剂亲水性及稳定性优良,对SLD具有独特选择性,结合力较传统单糖显色底物提高,最大荧光增强约40倍。
Wu等[20]研究发现基于生物化学发光原理的实时定量检测法qBV,底物唾液酸经荧光素酶催化产生光信号,预期信号强度与SLD活性成正比。
以Amsel评分为金标准,qBV法的灵敏度和特异度分别为95.40%和94.94%,该方法可根据SLD活性水平对BV患者进行分层,具有评估早产风险、监测抗生素治疗效果的潜力。
2.2.4 LE
LE主要存在于中性粒细胞中,阴道黏膜受损时,因趋化作用聚集在病灶周围的中性粒细胞被大量破坏并释放LE。LE与5-溴4-氯-3-吲哚乙酸盐反应,产物呈绿色或蓝色。研究表明,BV、外阴阴道假丝酵母菌病、滴虫性阴道炎的LE检测阳性率为95%[21]。
目前,干化学酶法因可同时测定阴道分泌物标本中的pH值、过氧化氢浓度、SLD及LE而被广泛应用,虽然该方法较为简便,搭配自动检测系统可降低人工成本,但以Amsel评分为金标准,该方法的阳性符合率为69.45%,阴性符合率为88.55%,总符合率为86.40%,一致性中等(κ=0.461)[22]。因此,其仍无法取代形态学检测在BV诊断中的重要作用。
综上,阴道微生态评价可作为BV诊断的有效手段。何亮等[23]研究表明,阴道微生态评价诊断阳性率为29.29%,优于Amsel诊断(23.43%)和Nugent诊断(24.27%)。
吴秀珍等[24]将Amsel诊断作为金标准,阴道微生态评价诊断BV的灵敏度为93.02%,特异度为88.23%,准确度为91.67%,阳性预测值为95.24%,阴性预测值为83.33%。
蔡斌等[25]采用阴道微生态评价检测48名健康体检女性及304例因阴道炎相关症状而就诊的患者标本,在提高BV诊断率的同时(阴道微生态评价诊断56例,白带常规诊断50例),发现乳杆菌减少者220例(比例<70%),乳杆菌消失者148例,为临床诊治提供了传统阴道分泌物检测无法获得的证据。
因此,阴道微生态评价在诊断BV的同时,能够识别外阴阴道假丝酵母菌病、滴虫性阴道炎、需氧菌性阴道炎和各种混合性阴道感染。对于仅有阴道不适症状而传统阴道分泌物常规检测正常的患者,能够提高临床诊断率,指导对因治疗。
3 分子诊断技术
3.1 直接探针杂交
Affirm VP Ⅲ检测试剂盒(Becton Dickinson公司,美国)是人工合成的DNA单链寡核苷酸探针,特异性捕获阴道分泌物中阴道加德纳菌核酸,形成的双链复合物可与显色探针结合,并且通过酶的催化作用将指示物底物转化为蓝色产物。该方法可在30 min内检测阴道分泌物中浓度≥5×105 CFU/mL的阴道加德纳菌,被美国CDC和ACOG指南推荐为临床无法进行显微镜检查时的替代方法,与显微镜检查相比,该方法的灵敏度和特异度分别为90%和97%[9]。
魏冰等[26]采用Affirm VP Ⅲ检测经Nugent评分标准诊断为BV的182例患者的阴道分泌物标本,灵敏度为95.1%,特异度为83.8%,κ值为0.80,两种方法一致性良好。
Thompson等[27]报道,对于200例出现阴道炎症状的患者,Affirm VP Ⅲ诊断BV的灵敏度和特异度分别为96.2%和81.6%。由于部分无BV症状的女性阴道分泌物中也能检出阴道加德纳菌,该试剂盒对于检测有临床症状、阴道分泌物有氨味且pH值发生改变的患者更有意义。
3.2 基于聚合酶链反应(PCR)的检测
PCR法能够直接对阴道分泌物进行检测,由于部分健康女性阴道内加德纳菌可能呈阳性,甚至以厌氧菌为优势菌群,针对单一细菌的检测可能无法反映阴道菌群是否失衡[28-29]。扩增多个病原体特异基因,能够提高检测效率、降低成本,全面系统且准确地实现多种病原体的同时鉴定。
Max Vaginal Panel试剂盒(Becton Dickinson公司,美国)能够对卷曲乳杆菌、詹氏乳杆菌、阴道加德纳菌、阴道阿托波菌、BV相关菌2(BVAB2)和1型巨球形菌进行检测,被美国食品药品监督管理局(FDA)批准用于有症状的BV的诊断,该方法的灵敏度和特异度分别为96.2%和96.1%,与Affirm VP Ⅲ(灵敏度96.2%,特异度81.6%)比较有所提高[27]。
Niu等[29]报道了扩增16S rRNA的长度异质性PCR技术,产物采用毛细管电泳分析并与焦磷酸测序文库比对,结果显示,健康女性标本扩增产物主要来源于乳杆菌;未处理和治疗失败组中,解脲支原体或人型支原体、纤毛菌属、阴道阿托波菌、阴道加德纳菌、动弯杆菌属、普雷沃氏菌属、放线菌属、厌氧球菌属和巨球形菌属来源的片段具有更高的相对峰面积,可作为BV诊断的标志物。
Li等[30]设计了针对惰性乳杆菌、卷曲乳杆菌、詹氏乳杆菌、加氏乳杆菌、阴道加德纳菌和阴道阿托波菌16S rRNA基因的6对特异性引物并对75份BV患者标本进行检测,结果显示,50份菌群平衡的标本中惰性乳杆菌、卷曲乳杆菌、詹氏乳杆菌、加氏乳杆菌的检出率分别为66%、64%、48%、8%,25份菌群失衡的标本中阴道加德纳菌和阴道阿托波菌的检出率分别为92%和80%。
Deng等[28]报道,log(卷曲乳杆菌/阴道加德纳菌)< 0是诊断BV的可靠指标,灵敏度、特异性、阳性预测值和阴性预测值分别为93.5%、97.2%、96.6%和94.6%。然而,多重PCR也存在扩增的偏好性、引物二聚体、非特异性扩增等问题。为减少PCR法的靶基因数量、避免绝对定量不准确的影响,仍需开发新的诊断指标。
3.3 转录介导扩增技术
Aptima BV试剂盒(Hologic公司,美国)被FDA批准用于有症状BV的诊断,该方法的原理是以阴道加德纳菌、阴道阿托波菌、卷曲乳杆菌、詹氏乳杆菌和加氏乳杆菌的核糖体RNA为模板,经MMLV逆转录酶作用生成DNA拷贝,在T7 RNA聚合酶的作用下转录,扩增子与带有荧光基团和淬灭基团的单链核酸杂交,产生特定荧光信号。
以Nugent评分为金标准,该方法的灵敏度为91.1%,特异度为94.4%,阳性预测值为83.7%,阴性预测值为97.1%[31]。据报道,阴道菌群中惰性乳杆菌占优势是健康与疾病的过渡状态,与BV发生及复发相关[32]。对于Nugent评分鉴定为BV中间态或采用益生菌阴道栓剂治疗的患者,Aptima BV检测能够反映卷曲乳杆菌、詹氏乳杆菌和加氏乳杆菌数量与阴道细菌总量的相关性,为该类患者的诊疗提供参考。
3.4 荧光原位杂交技术
吕治等[32]设计了阴道加德纳菌、阴道阿托波菌、普雷沃氏菌、乳杆菌的特异性荧光探针,对33例BV患者及28名健康女性的标本进行检测,灵敏度和特异度分别为93.9%和96.4%,阳性和阴性预测值分别为96.9%和93.1%,整体符合率为95.1%,均优于Nugent评分。
与传统革兰染色相比,荧光标记的特异性探针能够更准确地鉴定细菌种类,但其荧光信号较弱,而肽核酸(PNA)探针是合成的核酸类似物,使用不带电荷的聚酰胺骨架取代带负电荷的DNA结构特征,具有高稳定性、高亲和力、高渗透效率和更快速的杂交动力学。
Sousa等[33]研发出一种针对阴道阿托波菌的PNA探针,经24种分离株和40种阴道微生物培养物验证,灵敏度和特异度均为100%。荧光原位杂交技术检测BV相关病原体的灵敏度和特异度高,但仅可获得反映部分生物膜状态的图像,结果受采样过程和标本异质性影响较大。与该技术相比,直接探针杂交、基于PCR检测和转录介导扩增技术通过核酸提取过程使标本均一化,在定量方面可能更为准确。
3.5 宏基因组高通量测序(mNGS)技术
该技术是对标本中的全部核酸进行测序,通过生物信息分析去除人源序列,其余序列与特定的病原数据库比对,从而获得疑似致病微生物的种属信息。Bostwick等[34]报道,与细菌培养和部分病原体靶向核酸检测方法相比,mNGS具有更高的敏感性和特异性,在以下类型的BV检测中:
(1)经验性治疗失败的复发性BV;(2)具有阴道不适症状、Amsel标准呈假阳性、测序结果显示无BV的病例;(3)阴道加德纳菌阴性、合并白色念珠菌感染的BV,能够完整、准确地反映阴道微生态菌群的构成及抗生素耐药基因的参与,显示出在BV个性化诊断和指导合理治疗方面应用潜力巨大。但BV属于轻症感染,从成本效益考虑,传统检测方法能够明确诊断时,不推荐使用mNGS进行检测[35-36]。
mNGS的临床应用目前仍存在以下问题:标本采集、核酸提取、文库构建和生物信息分析等缺乏标准化过程;标本前处理过程复杂、耗时长、易被污染;阳性结果仅表明标本中存在病原体核酸片段,不代表该病原体是导致感染的病因,还需其他检测方法进一步加以验证。
4 其他检测方法
4.1 细菌培养法
Rodríguez-Nava等[37]研究表明,可采用含5%绵羊血的哥伦比亚血琼脂、巧克力琼脂、含血晶素和维生素 K的布氏琼脂作为培养基培养厌氧菌,Rogosa琼脂可选择性培养乳杆菌,人血双层吐温琼脂可选择性培养阴道加德纳菌,卡那霉素溶解的含血晶素和维生素 K的布氏琼脂可选择性培养普雷沃氏菌。然而,BV是由多种厌氧菌协同作用导致的阴道菌群失调,单独对某种细菌进行分离培养的意义较小,且培养时间较长,一般需3~7 d,因此不推荐作为BV的实验室诊断方法。
4.2 生物传感器
该方法的原理是将特定分析物或其引起的生化反应转换为成比例的可测量信号。
Srinivasan等[38]研发了纳米荧光探针修饰的抗SLD单克隆抗体和氧化石墨烯涂层微孔免疫传感系统,其灵敏度和特异度均为96.29%,阳性和阴性预测值分别为92.86%和98.11%。
Liu等[39]研制的碳纳米管场效应晶体管生物传感器对pH值变化表现出良好的线性(线性相关系数为0.99),放置1个月其传感性仍保持稳定,还可采用不同的测试策略和算法及机器学习检测标本生物胺,准确率在87.5%以上。
该方法具有快速响应、高灵敏度、高选择性和可重复使用等优点,但目前大多应用于科研领域,未来需突破制备技术和成本限制才能在BV诊断中得以应用。
4.3 机器学习及人工智能
Song等[40]采用马尔可夫随机场模型对经整体评估后的细菌图像进行分割,利用Hessian矩阵将重叠的细菌分解为标记,并将像素与标记关联,然后使用AdaBoost机器学习框架表征细菌类型,最后基于Nugent评分标准诊断BV。该方法的灵敏度、特异度和准确度分别为58.3%、87.1%和79.1%。
Wang等[41]开发的卷积神经网络模型可通过最小化交叉熵损失函数训练,并使用动量优化器优化。该模型检测5815张验证集图像的灵敏度和特异度分别为82.4%和96.6%,对1082张测试集图像的准确度为75.1%,比人工阅片高6.6%,但这一方法需要大量训练数据,标记成本极高,且受注释数据大小影响。
为此,Hao等[42]提出数据高效框架,即选择最小的训练子集,并对预训练的卷积神经网络进行微调,能够在保持竞争性能的同时节省37.5%的标注成本。
王瑶等[43]采用基于深度卷积神经网络搭建的Comet-60au高倍镜检阴道分泌物形态学分析系统(仕达思生物产业有限公司,中国)和人工智能自动判读阴道分泌物涂片,对乳杆菌样革兰阳性杆菌、 阴道加德纳菌及拟杆菌样革兰阴性杆菌、革兰染色不定的弯曲杆菌等细菌的检测完全一致率和基本一致率分别为82.8%~99.5%和93.3%~100%,对Nugent评分≥7分、分类为BV的涂片诊断准确度为90.8%,与人工镜检一致性良好。
人工智能技术可自动识别标本中的有形成分并分类计数,再将图像和形态学参数提交给检验人员审核,可显著缩短阅片时间,提高诊断效率,具有良好的应用前景。
5 小结
BV对女性日常生活和生殖健康造成不利影响,快速准确的诊断对合理有效的治疗极为重要。Amsel标准和Nugent评分已被广泛接受和应用,是临床和实验室诊断BV的金标准。Hay-Ison评分则简化了Nugent评分定量细菌的过程,但仍强调显微镜下形态学检测的重要性。阴道微生态评价将功能学检测作为形态学检测的补充,能够更加全面地反映微生态菌群状况。分子诊断技术可作为显微镜诊断不可用时的替代方法,但其对有临床症状的BV患者意义更大,不能作为BV的临床诊断或排除标准。
传统诊断方法涉及显微镜下的形态观察和判断,不仅需大量人力,且对检验人员的能力和经验要求较高。近年来,机器学习和人工智能在提高阴道分泌物形态学和功能学检测准确性的同时,显著降低了检验人员劳动负荷,展现出良好的应用前景。实验室人员应全面了解不同诊断方法的优势及局限性,根据诊疗实际需要合理选择功能学及分子诊断作为补充或参考,制订科学、规范的诊断流程和操作规范,提高标准化操作水平。
参考文献
[1]Marrazzo JM, Martin DH, Watts DH, et al. Bacterial vaginosis: Identifying research gaps proceedings of a workshop sponsored by DHHS/NIH/NIAID[J]. Sex Transm Dis, 2010, 37: 732-744.
[2]Ravel J, Moreno I, Simón C. Bacterial vaginosis and its association with infertility, endometritis, and pelvic inflammatory disease[J]. Am J Obstet Gynecol, 2021, 224: 251-257.
[3]Force UPST, Owens DK, Davidson KW, et al. Screening for bacterial vaginosis in pregnant persons to prevent preterm delivery: US Preventive Services Task Force Recommendation Statement[J]. JAMA, 2020, 323: 1286-1292.
[4]中华医学会妇产科学分会感染性疾病协作组. 细菌性阴道病诊治指南(2021修订版)[J]. 中华妇产科杂志, 2021, 56: 3-6.
[5]Coudray MS, Madhivanan P. Bacterial vaginosis-A brief synopsis of the literature[J]. Eur J Obstet Gynecol Reprod Biol, 2020, 245: 143-148.
[6]Amsel R, Totten PA, Spiegel CA, et al. Nonspecific vaginitis. Diagnostic criteria and microbial and epidemiologic associations[J]. Am J Med, 1983, 74: 14-22.
[7]Workowski KA, Bachmann LH, Chan PA, et al. Sexually Transmitted Infections Treatment Guidelines, 2021[J]. MMWR Recomm Rep, 2021, 70: 1-187.
[8]American College of Obstetricians and Gynecologists. Vaginitis in nonpregnant patients. ACOG Practice Bulletin No.215[J]. Obstet Gynecol, 2020, 135: 243-245.
[9]Coleman JS, Gaydos CA. Molecular Diagnosis of Bacterial Vaginosis: an Update[J]. J Clin Microbiol, 2018, 56: e00342-18.
[10]Nugent RP, Krohn MA, Hillier SL. Reliability of diagnosing bacterial vaginosis is improved by a standardized method of gram stain interpretation[J]. J Clin Microbiol, 1991, 29:297-301.
[11]Mitchell CM, Srinivasan S, Ma N, et al. Bacterial Communities Associated With Abnormal Nugent Score in Postmenopausal Versus Premenopausal Women[J]. J Infect Dis, 2021, 223: 2048-2052.
[12]王辰, 王慧慧, 李焕荣, 等.《2018欧洲国际性病控制联盟/世界卫生组织关于阴道分泌物(阴道炎症)管理指南》解读[J]. 中国实用妇科与产科杂志, 2018, 34: 1360-1365.
[13]Jung H, Ehlers MM, Peters RPH, et al. Growth Forms of Gardnerella spp. and Lactobacillus spp. on Vaginal Cells[J]. Front Cell Infect Microbiol, 2020, 10: 71.
[14]中华医学会妇产科学分会感染性疾病协作组. 阴道微生态评价的临床应用专家共识[J]. 中华妇产科杂志, 2016, 51: 721-723.
[15]杨文方, 李旭, 王翔,等. 阴道微生态的临床研究及意义[J].实用妇产科杂志, 2012, 28:205-209.
[16]王敏, 宋磊, 姚立红, 等. 223例健康育龄妇女阴道内乳酸杆菌菌群的鉴定[J].中国妇产科临床杂志, 2009:200-203.
[17]Ng S, Chen M, Kundu S, et al. Large-scale characterisation of the pregnancy vaginal microbiome and sialidase activity in a low-risk Chinese population[J]. NPJ Biofilms Microbiomes, 2021, 7: 89.
[18]Word Health Organization. Laboratory diagnosis of sexually transmitted infections, including human immunodeficiency virus[EB/OL].(2013-01-01)[2023-08-01].https://apps.who.int/iris/bitstream/handle/10665/85343/9789241 505840_eng.pdf.
[19]Liu GJ, Wang B, Zhang Y, et al. A tetravalent sialic acid-coated tetraphenylethene luminogen with aggregation-induced emission characteristics: design, synthesis and application for sialidase activity assay, high-throughput screening of sialidase inhibitors and diagnosis of bacterial vaginosis[J]. Chem Commun (Camb), 2018, 54: 10691-10694.
[20]Wu S, Lin X, Hui KM, et al. A Biochemiluminescent Sialidase Assay for Diagnosis of Bacterial Vaginosis[J]. Sci Rep, 2019, 9: 20024.
[21]袁丽莉,袁丽艳.阴道分泌物BV3项及常规检测结果分析[J].检验医学与临床, 2011, 8:1372-1373.
[22]经先振, 王齐, 牛国平. 阴道分泌物干化学酶法与传统方法检测结果的比较[J].医学理论与实践, 2015, 28:3267-3268,3283.
[23]何亮, 尹洪莉, 林维佳, 等. 三种检测方法对细菌性阴道病诊断价值的比较[J]. 昆明医科大学学报, 2020, 41:72-76.
[24]吴秀珍, 马菲菲, 林丽华, 等. 阴道微生态评价系统检测阴道分泌物诊断细菌性阴道病的价值[J]. 医疗装备, 2021, 34:32-33.
[25]蔡斌, 马洁, 吴晓梅, 等. 阴道微生态评价在妇科门诊中的应用价值[J]. 中国微生态学杂志, 2022,34:711-713.
[26]魏冰, 陆庭嫣, 沈俐, 等. BD Affirm VP芯片检测技术在阴道分泌物常规检测中的应用[J]. 检验医学, 2017, 32: 1134-1136.
[27]Thompson A, Timm K, Borders N, et al. Diagnostic performance of two molecular assays for the detection of vaginitis in symptomatic women[J]. Eur J Clin Microbiol Infect Dis, 2020, 39: 39-44.
[28]Deng T, Shang A, Zheng Y, et al. Log (Lactobacillus crispatus/ Gardnerella vaginalis): a new indicator of diagnosing bacterial vaginosis[J]. Bioengineered, 2022, 13: 2981-2991.
[29]Niu XX, Sun RH, Liu ZH, et al. Length-Heterogeneity Polymerase Chain Reaction as a Diagnostic Tool for Bacterial Vaginosis[J]. Chin Med J (Engl), 2018, 131: 2242-2243.
[30]Lai L, Wu Y, Li Y, et al. A Capillary Electrophoresis Method for Analyzing the Diversity of Vaginal Microbiome[J]. Clin Lab, 2022, 68: 523-531.
[31]Ruffier d'Epenoux L, Tessier E, Guillouzouic A, et al. Assessment of the Performance of the Aptima Bacterial Vaginosis Assay Over a 3-Month Period in a French Hospital[J]. Microbiol Spectr, 2022, 10: e0130122.
[32]吕治, 彭国丽, 王克迪, 等. 荧光原位杂交技术诊断细菌性阴道病的方法学研究[J]. 临床和实验医学杂志, 2015: 1139-1142.
[33]Sousa LGV, Castro J, França A, et al. A New PNA-FISH Probe Targeting Fannyhessea vaginae[J]. Front Cell Infect Microbiol, 2021, 11: 779376.
[34]Bostwick GD, Hunt CA. Utility of Next-generation sequencing in Managing Bacterial Vaginosis: Examples from Clinical Practice [EB/OL]. (2016-08-10)[2023-08-01]. https://www.longdom.org/open-access/utility-of-nextgener-ation-sequencing-in-manag-ing-bacterial-vaginosis-examples-from-clinical-practice-2167-0420-1000322.pdf.
[35]戴媛媛, 马筱玲. 宏基因组二代测序技术在临床病原学诊断中的应用[J]. 临床检验杂志, 2021, 39: 1-5.
[36]《中华传染病杂志》编辑委员会. 中国宏基因组学第二代测序技术检测感染病原体的临床应用专家共识 [J]. 中华传染病杂志, 2020, 38: 681-689.
[37]Rodríguez-Nava C, Cortés-Sarabia K, Avila-Huerta MD, et al. Nanophotonic Sialidase Immunoassay for Bacterial Vaginosis Diagnosis[J]. ACS Pharmacol Transl Sci, 2021, 4: 365-371.
[38]Srinivasan S, Munch MM, Sizova MV, et al. More Easily Cultivated Than Identified: Classical Isolation With Molecular Identification of Vaginal Bacteria[J]. J Infect Dis, 2016, 214 Suppl 1: S21-S28.
[39]Liu Z, Bian L, Yeoman CJ, et al. Bacterial Vaginosis Monitoring with Carbon Nanotube Field-Effect Transistors[J]. Anal Chem, 2022, 94: 3849-3857.
[40]Song Y, He L, Zhou F, et al. Segmentation, Splitting, and Classification of Overlapping Bacteria in Microscope Images for Automatic Bacterial Vaginosis Diagnosis[J]. IEEE J Biomed Health Inform, 2017, 21: 1095-1104.
[41]Wang Z, Zhang L, Zhao M, et al. Deep Neural Networks Offer Morphologic Classification and Diagnosis of Bacterial Vaginosis[J]. J Clin Microbiol, 2021, 59: e02236-20.
[42]Hao R, Liu L, Zhang J, et al. A Data-Efficient Framework for the Identification of Vaginitis Based on Deep Learning[J]. J Healthc Eng, 2022, 2022: 1929371.
[43]王瑶, 孙宏莉, 赵颖, 等. 自动化镜检结合人工智能分析系统对阴道分泌物革兰氏染色涂片形态学的准确性评价[J]. 协和医学杂志, 2021, 12: 503-509.


