CCR揭晓:宫颈癌进行基因检测有什么意义?
时间:2023-11-20 21:22:39 热度:37.1℃ 作者:网络

肿瘤基因检测越来越多地用于指导癌症患者的治疗策略。本研究整合了肿瘤基因、临床人口统计学和治疗反应数据,评估前瞻性肿瘤+正常配对样本测序如何影响宫颈癌患者的治疗选择。使用MSK-IMPACT NGS panel对宫颈癌进行了前瞻性分析。从病历中获取临床数据,包括组织学、诊断分期、治疗史、临床试验入组和结局、最后一次随访日期和生存状态。177例宫颈癌患者(鳞癌,69例;腺癌,50例;胃型,22例;腺鳞癌,21例;其他,15例)进行了MSK-IMPACT检测。最常见的基因变异是PIK3CA(25%),ERBB2(12%),KMT2C(10%)和KMT2D(9%)体细胞突变或扩增。此外,13%的患者TMB-H(>10 mut/Mb),其中3例同时MSI-H。根据FDA认可的OncoKB®肿瘤突变数据库和治疗分类系统,37%的患者至少有一个3B级潜在可治疗变异。30例患者(17%)参加了治疗性临床试验,包括18例患者(10%)基于其MSK-IMPACT结果与研究相匹配。20例患者(11%)参加了免疫检查点抑制剂研究,2例在>5年随访时保持无进展。肿瘤基因检测有助于宫颈癌患者靶向/免疫疗法的选择和临床试验入组。
研究背景
宫颈癌仍然是美国女性较常见的癌症,预计到2023年将有13960例新诊断病例和4310例死亡病例。局部晚期和转移性宫颈癌患者的治疗选择有限,含铂化疗是全身治疗的主要手段。在既往接受过治疗的程序性死亡配体1(PD-L1)阳性疾病患者中,帕博利珠单抗单药治疗的客观缓解率(ORR)仅为14.6%。在一线化疗中加用帕博利珠单抗,联合或不联合贝伐珠单抗,可轻微改善中位无进展生存期(PFS;10.4个月,而单接受化疗的患者为8.2个月)。复发性和转移性宫颈癌患者迫切需要新的治疗方法。
世界卫生组织(WHO)分类系统识别了宫颈癌的几种组织学亚型。鳞癌(SCC)是主要的组织学亚型,约占所有宫颈癌的75%。腺癌和腺鳞癌占10-15%,其余10-15%为“其他”或未指明的组织学。根据监测、流行病学和最终结果(SEER)数据库的临床数据,小细胞癌和腺癌是与最差生存率相关的组织学亚型。与其他常见的实体瘤相比,宫颈癌基因数据的预测和预后价值仍不明确。癌症基因图谱(TCGA)鉴定了宫颈癌中显著突变的14个基因,包括PIK3CA、ARID1A和KRAS,以及APOBEC突变特征。虽然这是一个重要的里程碑,但TCGA分析中包含的肿瘤样本主要收集自早期SCC患者(n = 144),很少有肿瘤表现出腺鳞癌(n = 3)或腺癌(n = 31)组织学。之前分析的其他队列包括来自挪威和墨西哥的115例女性,以及来自乌干达的118例女性,这些队列也主要为SCC。因此,关于非鳞状宫颈癌(包括宫颈胃型腺癌(GEA)和宫颈小细胞癌)基因图谱的数据有限。此外,没有研究评估晚期宫颈癌患者对肿瘤+正常配对样本进行前瞻性分子检测的可行性,以及肿瘤基因检测指导临床治疗的潜在效用。
本研究旨在利用前瞻性真实世界宫颈癌基因检测数据,分析临床可治疗基因变异的频率,以及明确原发性和复发性宫颈癌的前瞻性分子检测是否揭示组织学特异性差异,指导患者入组治疗性临床试验。
研究结果
宫颈癌基因图谱
为了确定前瞻性肿瘤基因检测的临床效用,整合了在纪念斯隆凯特琳癌症中心(MSK)接受治疗的177例宫颈癌患者的临床数据与前瞻性肿瘤测序项目背景下的肿瘤基因数据(MSK宫颈癌队列)。患者人口统计数据汇总于表1。MSK宫颈癌队列中80%的肿瘤(n = 142)高危HPV阳性。最常见的组织学亚型是SCC(n=69,39%),普通型宫颈腺癌(UEA;n=50,28%)和宫颈腺鳞癌(CAS;n=21,12%),所有这些都是典型的HPV相关。少见的组织学亚型(包括GEA)占队列的21%(n=37)(图1)。值得注意的是,这些少见的组织学亚型未纳入宫颈癌特异性TCGA分析(图1A)。
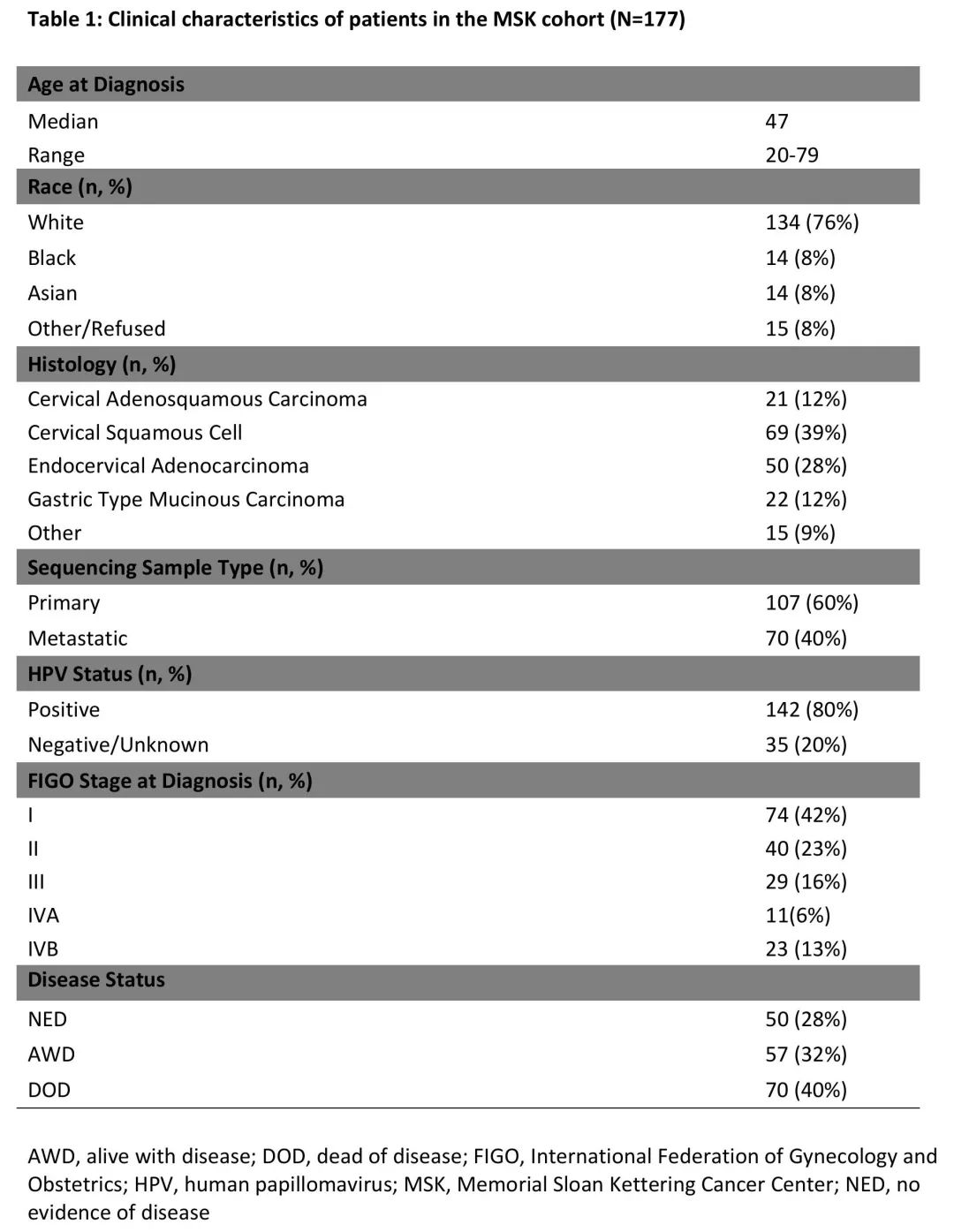
表1. MSK队列患者的临床特征(N=177)
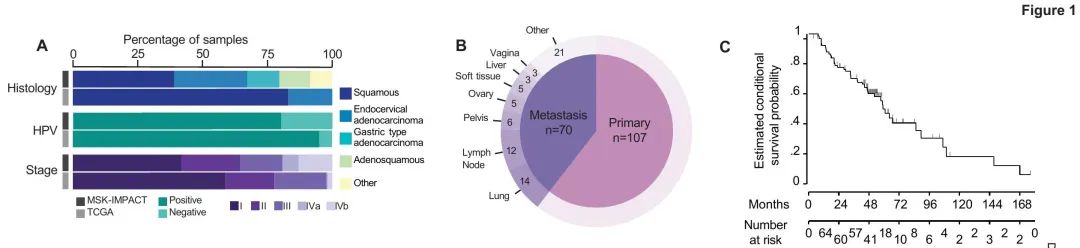

图1. 患者的病理特征
MSK队列中35%(n = 63)的患者初始诊断为III期(n = 29),IVA期(n = 11)或IVB期(n = 23),而TCGA队列中这些分期的患者占19%(n = 63)(P = 0.008)。此外,不像TCGA只关注原发性疾病,在我们的研究中,进行MSK-IMPACT测序的肿瘤样本中有40%(n = 70)是从远处部位获得的,最常见的是肺(n = 14)和淋巴结(n = 12)(图1A-B)。MSK-IMPACT测序使用原发性或转移性肿瘤样本,具体取决于组织的可及性。在对原发性肿瘤进行MSK-IMPACT测序的108例患者中,数据库锁定时,40例(37%)存活且没有疾病迹象,32例(30%)带病存活,34例(31%)死亡。比较原发部位和远处部位样本测序结果,未发现驱动基因突变存在显著差异。
为了尽量减少转诊偏倚的影响,对初始诊断在我院进行的患者亚群计算OS(MSK生存队列)。该队列的中位OS(n=97)为59.2个月(95%CI:46.7-89.4),中位随访时间为50.9个月(范围为3.9-176.4个月)(图1C)。比较不同组织学亚型,SCC vs UEA vs其他亚型的OS没有显著差异(P=0.099)。然而,比较不同诊断分期时,观察到显著的OS差异(I期,106.8个月[95%CI:52.3-NE];II期,59.2个月[95%CI:23-89.4];III期,57.5个月[95%CI:10.1-NE];IV期,18个月[95%CI:7.5-66.7];P=0.027)。
然后,探索了MSK宫颈癌队列与TCGA队列的临床差异是否伴随着基因图谱的差异。总体而言,两个队列的癌症相关基因体细胞变异分布相似,观察到几个差异。具体而言,MSK宫颈癌队列相比TCGA队列,TP53、KRAS和ERBB2致病性体细胞突变富集,尽管只有KRAS达到统计学意义(TP53:11% [19/177] vs 8% [25/297],P=0.51;KRAS:12% [21/177] vs 5% [15/297],P=0.019;ERBB2:12% [22/177] vs 8% [24/297],P=0.2;PIK3CA:25% [44/177] vs 37% [111/298],P=0.052;PTEN:7% [12/177] vs 11% [34/297],P=0.14)。这些差异主要归因于这些队列中组织学亚型的差异,包括纳入GEA肿瘤方面,TCGA队列的组织学亚型较少。与MSK泛癌症队列相比,在MSK宫颈癌队列中观察到高频热点突变。未发现与宫颈癌相关的新突变。
最常见的基因变异是PIK3CA(44/177,25%),ERBB2(22/177,12%),KMT2C(17/177,10%),KMT2D(16/177,9%)和KRAS(21/177,12%)突变或扩增(图2A)。与已发表的文献一致,在46%的SCC、30%的UEA、9%的GEA和33%的CAS中观察到APOBEC突变特征(图 2A)。不同组织学亚型的基因驱动突变率存在显著差异。在CAS样本中,未观察到TP53、ARD1A和ERBB2突变,而STK11变异在CAS中(n = 7/21,33%)的发生率高于SCC(n = 3/69,4%)和UEA(n = 5/50,10%)。ERBB2扩增和致癌错义突变在UEA(amps=2/50,muts=12/50,28%)和SCC(amps=4/69,muts=2/69,9%)中均较为常见。值得注意的是,在这些组织学亚型中,ERBB2和KRAS变异相互排斥。MYC扩增(n=2/50,4%)仅见于UEA(图2A-B)。
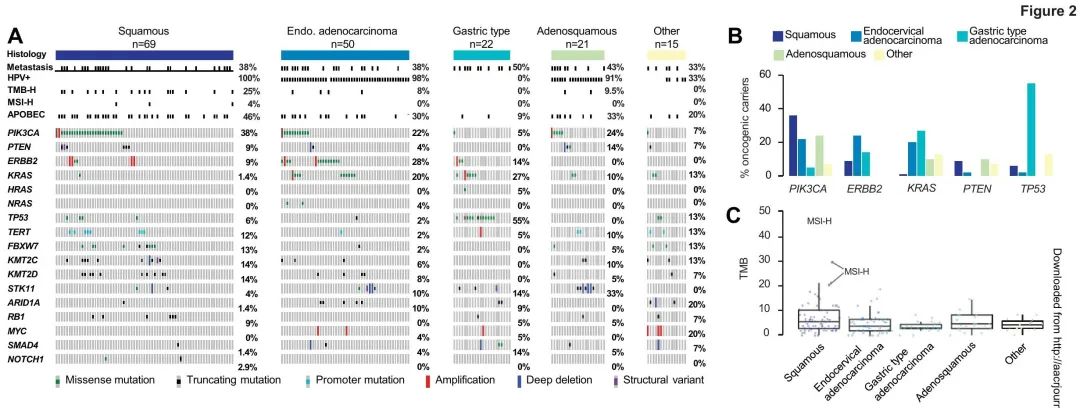

图2. 按组织学亚型分类的基因变异
先前有关于致癌TP53变异与HPV阳性相互排斥的报道,在我们的队列中也观察到这一点。在非HPV相关GEA中致癌TP53变异的发生率较高,在其他亚型中也观察到致癌TP53/HPV阳性的相互排斥性,只有3.5%(5/142)的HPV阳性患者携带致癌TP53变异(4例SCC和1例小细胞癌)。这与53.8%(7/13)的HPV阴性非GEA患者伴有TP53致癌突变形成鲜明对比(p=0.00007)。
当比较我们队列中原发性(P)(n = 107)与转移性(M)(n = 70)样本的测序结果时,发现转移性肿瘤中以下基因致癌突变富集,包括PIK3CA(P 23% vs M 27%),ERBB2(P 12% vs M 13%),TP53(P 8% vs M 14%),KRAS(P 8% vs M 17%),KMT2C(P 7% vs M 13%)和KMT2D(P 7% vs M 14%)。尽管观察到这些差异,但均未达到统计学意义。然后,比较了诊断为I-IVA期(n = 154)与IVB期(n = 23)患者的测序结果。PIK3CA(I-IVA 22% vs IVB 43%)和KMT2C(I-IVA 8% vs IVB 22%)等基因致癌突变在IVB期患者中富集。相比之下,KRAS(I-IVA 12% vs IVB 9%)和TP53(I-IVA 11% vs IVB 9%)等基因致癌突变率在不同分期患者间相似。尽管观察到这些趋势,但均未达到统计学意义,并且可能受到不同分期患者各组织学亚型占比的影响。
HPV检测和基因分型
使用多种方法来分析HPV阳性。58例肿瘤样本进行了HPV ISH检测,其中53例为阳性,包括23例SCC,17例UEA和10例CAS。还查看了HPV DNA NGS数据。为了了解NGS HPV检测的相关性,对于所有亚型中有HPV ISH结果的患者,计算了NGS检测的准确率和召回率(即阳性预测值和灵敏度)。总体而言,68%(36/53)的ISH阳性患者MSK-IMPACT off target reads显示HPV reads阳性。在5例ISH阴性患者中,HPV reads均为阴性,准确率为100%。此外,66例SCC患者(临床上均被认为是HPV阳性)通过NGS检测了HPV reads的存在,召回率为71%(47/66)。与临床(非NGS)HPV检测相比,CAS和UEA的召回率分别为57%(8/14)和72%(26/36),准确率为100%。观察NGS显示HPV阳性的最常见的HPV相关组织学亚型(SCC,UEA,CAS),包括没有正交临床检测的样本,HPV-16和-18分别在52%(51/98)和32%(32/98)的样本中被鉴定。在另外15%的肿瘤中(15/98)发现了其他高危HPV亚型。一例肿瘤HPV-53阳性,被认为中危。
罕见宫颈癌组织学亚型的基因图谱
与TCGA相比,MSK宫颈癌队列包括22例GEA患者,GEA是一种罕见的宫颈腺癌组织学亚型,与HPV无关。在22例GEA中,12例(55%)携带TP53,6例(27%)携带KRAS,3例(14%)携带ERBB2(amps=1,muts=2),3例(14%)携带STK11体细胞突变。RAF/RAS和PI3K/AKT通路基因变异分别见于10例(45%)和4例(18%)GEA。所有GEA患者MSK-IMPACT或HPV-ISH(如果检测)显示高危HPV阴性。41%在诊断时为I期,23%为II期,23%为III期,14%为IV期(IVA 5%,IVB 9%)。MSK宫颈癌队列还包括15例其他罕见组织学亚型的患者,包括中肾管癌(n = 3),宫颈透明细胞癌(n = 3),宫颈小细胞癌(n = 5),混合性神经内分泌癌(n = 3;2例混合性腺癌和神经内分泌癌,1个混合性中肾管癌和小细胞癌)和宫颈子宫内膜样癌(n = 1)。3例中肾管癌患者中,2例携带KRAS变异,2例携带ARID1A突变。所有3例患者均被诊断为IBI期疾病,均为HPV阴性,其中2例带病存活。在纯小细胞癌患者中,2/5例同时具有TP53突变和MYC扩增。ERBB2和STK11热点变异在其他亚型中常见,在该罕见亚组中不存在。数据库锁定时,所有纯小细胞癌或混合性神经内分泌癌患者带病存活或死于疾病,5/8例患者(63%)IMPACT或HPV-ISH显示HPV阳性。
临床可治疗性
目前还没有FDA批准的专门针对宫颈癌的靶向疗法。选择性NTRK和RET融合以及BRAF V600E突变激酶抑制剂已获得与泛癌种FDA批准,但在我们的肿瘤样本中未发现致癌NTRK或RET融合以及BRAF V600E突变。在MSK宫颈癌队列中,23/177例患者(13%)TMB-H(>10 mut/Mb)/MSI-H(n = 3)或TMB-H/MSS(n = 20),TMB-H和MSI-H均是FDA批准的可预测对帕博利珠单抗反应的生物标志物(图2C)。值得注意的是,所有3例MSI-H肿瘤均为SCC,且均TMB-H。1例MSI-H宫颈癌患者接受帕博利珠单抗治疗,未取得临床获益,有趣的是,尽管同时TMB-H(19.3 mut/Mb),但免疫组化(IHC)显示MLH1、MSH2、MSH6和PMS2蛋白均表达正常,ISH显示HPV阳性。第二例MSI-H患者在FDA批准帕博利珠单抗用于治疗MSI-H肿瘤之前死于疾病,第三例患者根治性一线治疗治愈。20例患者TMB-H/MSS,大多为SCC(14/20,70%)。9/20例(45%)接受了免疫检查点抑制标准治疗,其中2例(10%)帕博利珠单抗带来持久临床获益(定义为>1年治疗)。GEA或罕见组织学亚型中没有患者MSI-H或TMB-H。
临床试验入组
37%的患者(66/177)至少有一个OncoKB® 3B级潜在可治疗变异(图3A),最常见的是PIK3CA(45,25%)和ERBB2(17,9.6%)。值得注意的是,3例患者携带致病性体细胞BRCA1(n = 1,无杂合性缺失)或BRCA2(n = 2,1例杂合性丧失)变异。数据锁定时,30例患者(17%)参加了治疗性临床试验,其中11例患者参加了不止一项研究。18/177例患者(10%)基于其MSK-IMPACT肿瘤基因检测结果与临床试验相匹配,包括6例基于ERBB2变异,6例基于PIK3CA变异(4例接受GDC-0032治疗),2例基于FGFR变异,以及各种其他靶标,包括ERK和TP53(图3B,表2)。值得注意的是,一例ERBB2 D769N突变的患者参加了人表皮生长因子受体(HER)激酶抑制剂临床试验,获益显著,已在试验中超过5年(图3B)。
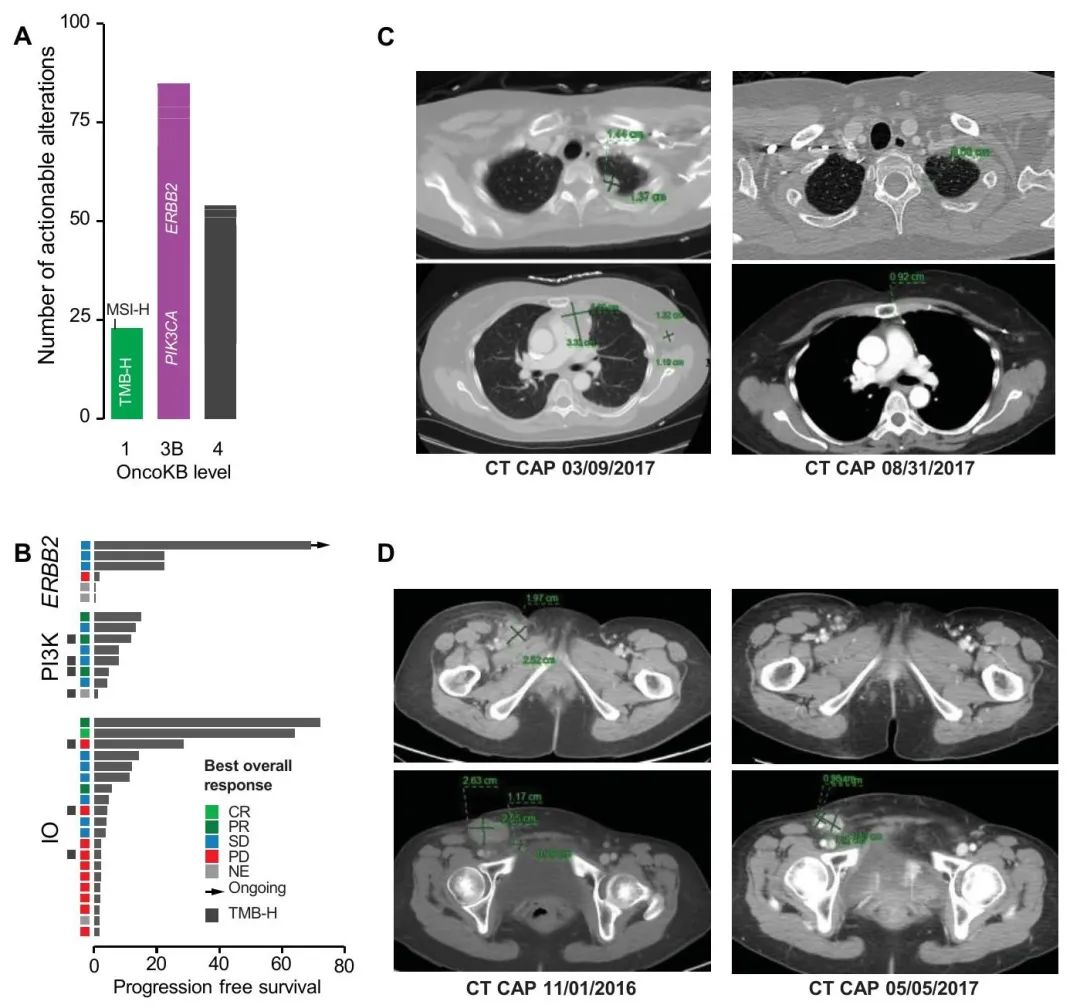

图3. MSK-IMPACT检测的临床结果
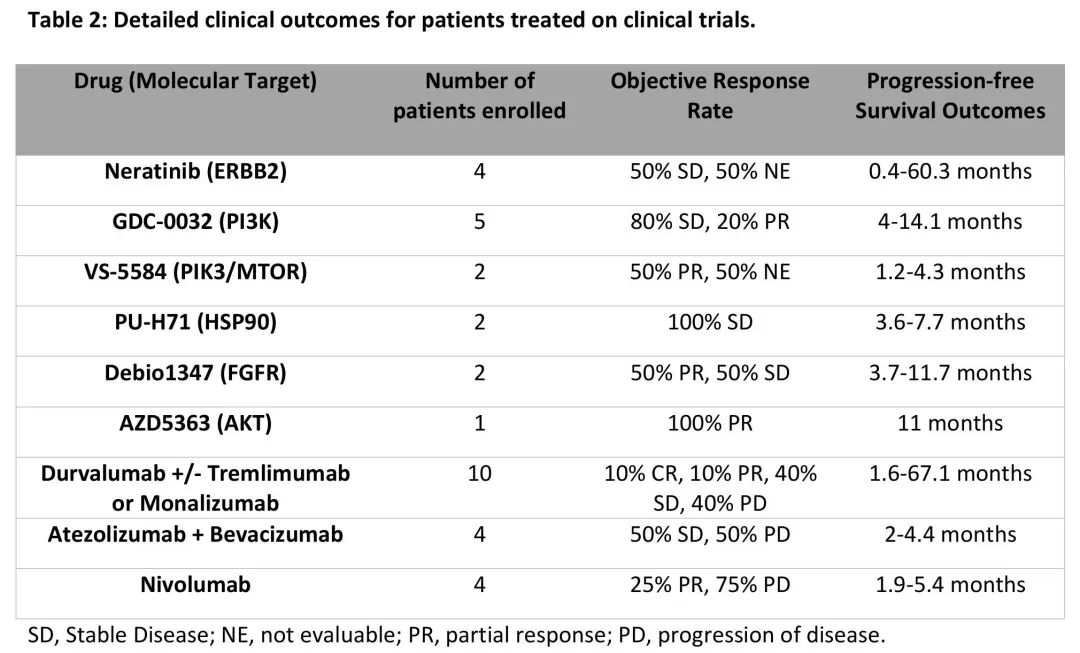
表2. 参加临床试验的患者的临床结局
MSK宫颈癌队列中有20例患者参加了免疫检查点抑制剂研究,其中1例患者参加了两项此类研究。根据RECIST标准,3例患者经免疫治疗获得缓解,其中2例患者随访至少5年,保持无进展(图3B-D)。值得注意的是,这2例获益显著的患者为MSS/TMB-L,但PD-L1 IHC阳性,HPV阳性(HPV-16和HPV-18各1例)。2例患者都接受了双重检查点阻断疗法。
讨 论
肿瘤学专家越来越多地使用肿瘤基因检测来指导晚期癌症患者FDA批准的和研究性疗法的选择。虽然探索NGS在晚期宫颈癌中的临床应用的研究较少,但最近FDA批准帕博利珠单抗和多塔利单抗用于TMB-H/dMMR的晚期实体瘤,为临床基因检测提供了合理性,这些晚期患者缺乏治疗选择。NTRK和RET融合以及BRAF V600E突变现在也分别被认为是预测NRTK和RAF抑制剂疗效的泛癌种生物标志物,但MSK宫颈癌队列中没有患者携带这些致癌激酶变异。MSK生存队列的中位OS为59个月,诊断分期不同的患者存在显著差异。与先前的SEER数据库研究相比,我们没有观察到不同组织学亚型的生存率存在显著差异,然而,这可能是由于样本量小以及小细胞癌和GEA患者的绝对数量有限。为了促进未来结合我们数据与其他研究数据的荟萃分析,所有临床和基因数据都可通过cBioPortal 和AACR GENIE获得。
鉴于复发性宫颈癌对化疗的反应率较低,值得注意的是,MSK宫颈癌队列中有13%的患者具有OncoKB® 1级可治疗变异,定义为FDA批准的治疗反应生物标志物;在该队列中,这些变异都是MSI-H或TMB-H。不幸的是,晚期宫颈癌单药PD-1抑制剂治疗的ORR不高,约为10-15%。这与我们的数据一致,只有10%的患者对作为标准治疗或临床试验提供的免疫检查点抑制有持久的反应。值得注意的是,试验中显著获益于免疫检查点抑制剂治疗的两例患者均为TMB-L/MSS,这引发了关于TMB作为晚期宫颈癌患者免疫治疗反应生物标志物的效用的问题。
汇总数据支持宫颈癌需要额外的生物标志物研究,以识别最有可能获益于单药PD-1抑制剂治疗的患者,以及开发联合策略和新型免疫疗法。其中可能包括双重检查点阻断疗法,例如抗CTLA-4与抗PD-1药物联合使用,ORR范围为22%至46%,具体取决于药物、剂量和时间安排。在Naumann等人和O'Malley等人的研究中,应答者PD-L1表达富集,但在PD-L1阴性患者中也观察到应答。有希望的新型免疫疗法包括双特异性抗体,如AK104(一种抗PD-1和抗CTLA-4双特异性抗体),与标准化疗联合使用作为宫颈癌患者的一线治疗,显示出令人印象深刻的临床活性和合理的安全性。另一种双特异性抗体bintrafusp alfa靶向TGF-β和PD-L1,用于HPV相关恶性肿瘤的ORR为30.5%。
MSK宫颈癌队列中13%的患者有ERBB2变异(4%扩增,9%致癌突变)。ERBB2突变在UEA中富集(28%),也见于SCC和GEA。这一发现提示,HER2可能是这组需求未得到满足的患者的重要治疗靶点。泛HER酪氨酸激酶抑制剂奈拉替尼在HER2突变宫颈癌患者中显示出临床疗效,ORR为25%,中位PFS为7.0个月。在MSK宫颈癌队列中,1例患者接受奈拉替尼治疗超过5年。最近,抗体药物偶联物德曲妥珠单抗(T-DXd)在HER2突变的非小细胞肺癌中显示出临床活性,ORR为51%,在HER2扩增的乳腺癌和胃癌中也表现出临床疗效。目前正探索T-DXd用于HER2过表达的宫颈癌(NCT04482309),我们的数据提示,临床医生应强烈考虑在晚期/复发性宫颈癌中检测HER2过表达,特别是在UEA和GEA中,以促进HER2靶向治疗临床试验的入组。
最近开发的KRAS抑制剂也可能对宫颈癌具有治疗意义。我们队列中大约12%的患者有KRAS突变,包括1例G12C热点突变的患者。阿达格拉西布和索托雷塞最近获得了FDA批准用于KRAS G12C突变的非小细胞肺癌,还有其他泛KRAS G12X抑制剂正在开发中,可能与宫颈癌患者有关。
本研究的优势之一是纳入了罕见的组织学亚型,包括GEA,一种罕见且具有侵袭性的宫颈腺癌组织学亚型,其发病机制与先前HPV感染无关。一部分GEA具有在胰胆肿瘤中常见的驱动基因变异,包括 KRAS、TP53、SMAD4和CDKN2A变异。一部分GEA更类似肠型胃腺癌,具有KMT2D、ERBB3和RNF43变异,与预后不良有关。观察到具有临床意义的ERBB2和PIK3CA变异,为临床试验入组提供了潜在靶点。
NGS已被证明是一种高度灵敏的HPV检测方法,能够在低拷贝数时检测HPV的存在,提示与传统的基于PCR的方法相比,我们能够更好地表明HPV在宫颈癌发生发展中的作用。在MSK宫颈癌队列中,我们在大多数预计为HPV阳性的肿瘤样本中鉴定了HPV,与目前HPV鉴定金标准HPV-ISH具有良好的一致性。MSK-IMPACT等临床大 panel NGS平台检测病毒的能力为识别癌症相关HPV亚型开辟了潜力,新疗法如治疗性疫苗和T细胞受体或嵌合抗原受体(CAR)T细胞疗法可能靶向这些HPV亚型。最近,对MSK-IMPACT检测进行了调整,包括了用于捕获在高危HPV亚型中发现的DNA序列的探针。与本研究HPV检测使用的off-target reads相比,这可能会提高检测灵敏度。
本研究也有局限性。虽然我们的结果与TCGA类似,但由于整体样本量小和分析的回顾性,存在局限。此外,本研究是在一家拥有大量转诊基础的三级癌症中心进行的,导致罕见组织学亚型患者以及晚期或复发性疾病患者的比例过高。最后,虽然该队列中18%的患者入组了临床试验,但这不仅受到测序结果的影响,还受到多样和活跃的临床试验的影响,这可能取决于地点。尽管存在这些局限,我们对MSK宫颈癌队列的分析为宫颈癌患者中不同组织学亚型的基因特征多样性提供了额外的证据,表明基因检测可以为临床决策提供信息,为部分宫颈癌患者新型治疗选择提供依据。
参考文献:
Friedman CF, Ravichandran V, Miller K, Vanderbilt C, Zhou Q, Iasonos A, Vivek M, Mishra P, Leitao MM, Broach VA, Sonoda Y, Kyi C, Zamarin D, O'Cearbhaill RE, Konner J, Berger MF, Weigelt B, Momeni Boroujeni A, Park KJ, Aghajanian C, Solit DB, Donoghue MTA. Assessing the Genomic Landscape of Cervical Cancers: Clinical Opportunities and Therapeutic Targets. Clin Cancer Res. 2023 Aug 29:CCR-23-1078. doi: 10.1158/1078-0432.CCR-23-1078. Epub ahead of print. PMID: 37643132.



