好文推荐|颈部血管超声与高分辨率磁共振成像评估单侧颅外段椎动脉夹层的一致性研究
时间:2023-12-16 15:40:53 热度:37.1℃ 作者:网络
摘要
目的 探讨颈部血管超声(CDU)与高分辨率磁共振成像(HRMRI)评估单侧颅外段椎动脉夹层(VAD)的一致性。方法 连续性回顾纳入2017年1月—2023年3月在苏州大学附一院卒中中心就诊,因突发颈部或后枕部疼痛、有颈部按摩史、出现神经功能障碍等临床疑似颈部动脉夹层的患者132例,同期行CDU与三维HRMRI检查,并以三维HRMRI检查结果作为参考标准,采用Kappa一致性检验分析CDU评估单侧颅外段VAD的敏感度、特异度及准确性;通过CDU与HRMRI分别观察并记录颅外段VAD夹层病变部位及影像征象,即内膜撕裂征、壁内血肿、双腔征、腔内血栓、夹层动脉瘤、管腔不规则,采用北美症状性颈动脉内膜切除试验(NASCET)方法计算血管狭窄程度,并将二者检查结果进行Kappa一致性分析。 结果(1)一致性分析:CDU评估单侧颅外段VAD的阳性率为93.2%(123/132),HRMRI为93.9%(124/132),二者一致性很强(Kappa为0.87);CDU检查颅外段VAD的敏感度为99.2%,特异度为87.5%,准确率为86.7%。(2)CDU与HRMRI影像征象:两者评估双腔征、夹层动脉瘤、管腔不规则、病变部位及血管狭窄程度均一致性很强,Kappa值分别1.00、0.85、0.88、0.94、0.89;两者评估壁内血肿及腔内血栓一致性较强,Kappa值分别为0.79及0.80,且HRMRI观察强化壁内血肿为17.7%;两者评估内膜撕裂征一致性中等,Kappa值为0.58。结论 CDU能够有效地评估颅外段VAD的不同影像征象和血管狭窄程度,为颅外段VAD早期诊治及定期随访提供可靠的影像学依据。
颅外段椎动脉夹层(vertebral artery disp,VAD)是中青年人后循环缺血性卒中的重要原因之一,早期确诊、及时进行规范化干预可有效提高椎动脉管腔再通率,并显著改善患者预后[1]。VAD患者临床表现各异,可仅有后枕部疼痛,或出现肢体感觉、运动障碍等神经系统临床表现。VAD病灶部位、造成管腔的狭窄程度和累及范围等影像学征象亦呈多样性。颈部血管超声(cervical vascular Doppler ultrasound,CDU)经济、无创,可实时观察血管管壁及管腔的形态学及血流动力学改变,但能否早期有效评估VAD是临床关注的焦点。随着影像学技术、后处理软件的快速发展和提升,高分辨率磁共振成像(high-resolution magnetic resonance imaging,HRMRI)的三维成像技术逐渐替代数字减影血管造影(digital subtraction angiography,DSA),成为诊断VAD的可靠方法。鉴此,本研究回顾性分析颅外段VAD患者的临床及影像学检查资料,探讨CDU与三维HRMRI评估单侧颅外段VAD的一致性。
1 资料与方法
1.1 研究对象
连续纳入2017年1月—2023年3月至苏州大学附属第一医院卒中中心就诊,因突发颈部、后枕部疼痛,有颈部按摩史,出现神经功能障碍等临床怀疑颈部动脉夹层的患者132例,入院时均行头部CT以排除脑出血,同期分别行CDU与HRMRI检查(间隔时间≤48 h),部分患者入院行多模式CT包括弓上CT血管成像(CTA)和头部CT灌注成像(CTP),和/或进一步行DSA检查。
纳入标准:(1)患者首次出现症状距CDU和HRMRI检查均≤72 h;(2)临床资料、实验室检查及影像学资料完整者。排除标准;(1)颈内动脉夹层、颅内动脉夹层及双侧椎动脉夹层;(2)颈内动脉、大脑中动脉狭窄或闭塞性病变;(3)大动脉炎;(4)锁骨下动脉、基底动脉及大脑后动脉等狭窄或闭塞性病变;(5)房颤脑栓塞;(6)烟雾病;(7)动静脉瘘及动静脉畸形;(8)入院CT示脑出血。
该研究经本院伦理委员会审核批准[No.(2021)241]。收集患者入院24 h内信息,包括性别、年龄、体质量指数(BMI)、入院时改良Rankin评分(mRS)和美国国立卫生研究院卒中量表评分(NIHSS);既往脑血管病相关危险因素史包括高血压、糖尿病、高脂血症、冠心病(均依照中国国家卒中登记研究标准);吸烟为当前或既往吸烟≥1支/d;发病性质:根据是否有外伤史,分为自发性和创伤性;以及发病前1周内是否感染:临床表现、实验室和/或影像学检查证实。
1.2 影像学检查设备及方法
1.2.1 CDU检查
采用Philips CX50型超声诊断仪,选择3~12 MHz线阵探头及1~5 MHz凸阵探头,按照《中国脑卒中血管超声检查指导规范》,常规检测双侧颈部动脉包括颈总动脉、颈内动脉、颈外动脉、锁骨下动脉、椎动脉及无名动脉,观察管壁和管腔的二维形态学改变及回声特点,彩色多普勒血流显像(CDFI)动态观察管腔内血流充盈情况,频谱多普勒分析并记录血流动力学参数包括收缩期峰值流速(PSV)、舒张期末流速(EDV)及阻力指数(RI)。
CDU评估颅外段VAD的标准,包括探头可视范围内以下直接征象:(1)内膜撕裂征;(2)双腔征;(3)壁内血肿;(4)腔内血栓;(5)夹层动脉瘤。间接征象包括管腔不规则狭窄、或不规则狭窄直至远段管腔闭塞。测量病变处最大外径、最狭窄处内径以及正常部位的管径,根据北美症状性颈动脉内膜切除试验(NASCET)方法计算狭窄程度,分为:正常或轻度狭窄(<50%),中度狭窄(50%~69%),重度狭窄(70%~99%)以及闭塞。尤其,CDU观察颈段(V1)、椎间段(V2)、寰椎段(V3)(见图1),并结合颈椎横突孔将病灶进行定位,为后期随访提供参考依据。
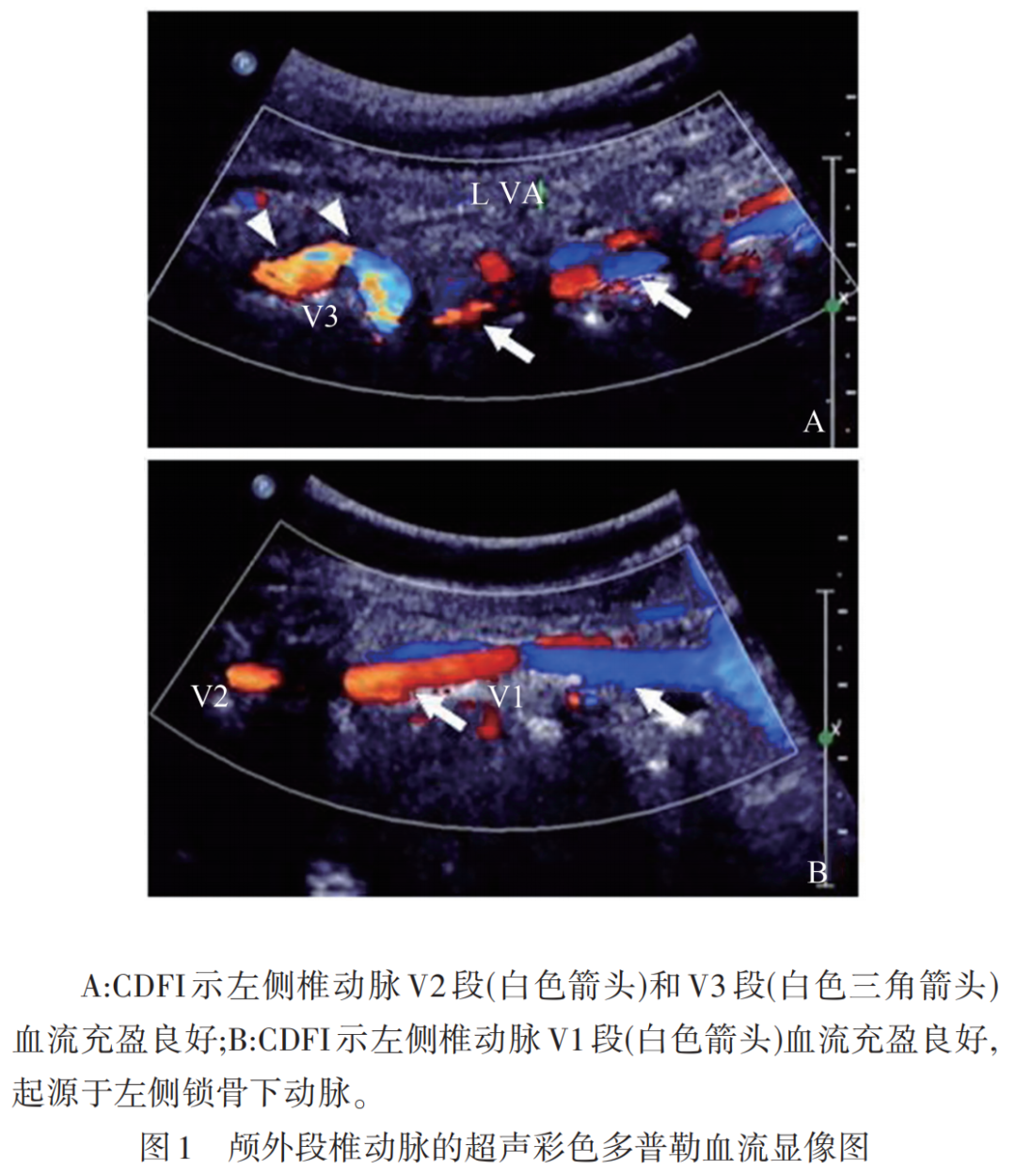
1.2.2 磁共振检查设备
3.0 T磁共振仪器(Ingenia, Philips Healthcare, Netherlands),头颈联合线圈。设置扫描序列组套,并将各序列参数进行标准化,包括颈部轴位T1加权成像(T1)、对比增强T1加权成像(T1+C)、对比增强T1加权脂肪抑制序列(T1+C-FS)、T2加权脂肪抑制序列(T2-FS);三维质子密度加权体积各向同性自旋回波序列(PDW VISTA);标准头部MRI检查:包括T1、T2加权成像(T2)、弥散加权成像(DWI),具体扫描参数同既往研究。在IntelliSpace Portal v6.0工作站对各序列图像进行后处理及分析:包括重建三维时间飞跃血管成像(TOF MRA);测量病变处最大外径、狭窄最严重点位内径以及正常部位的内径,亦根据NASCET方法计算狭窄程度;并采用Spine line曲线勾勒VAD病变累及长度。
HRMRI诊断颅外段椎动脉夹层的标准,包括以下征象:(1)内膜撕裂征;(2)双腔征;(3)壁内血肿;(4)腔内血栓;(5)夹层动脉瘤,以及管腔不规则狭窄或闭塞。通过脑部DWI结果评估后循环急性卒中预后早期CT(pc-ASPECT)评分。
1.3 治疗方法
神经内科医师根据患者发病时程、临床表现、实验室及影像学检查结果,选择溶栓、抗凝和/或抗血小板治疗。
1.4 统计学处理
采用SPSS 19.0(IBM, Armonk, New York, USA)统计学软件进行分析。采用Kolmogorov-Smirnov方法对计量资料进行正态性检验,符合正态分布的计量资料采用x±s表示,偏态分布的计量资料以中位数和四分位数[M(P25,P75)]表示。CDU与HRMRI检查结果一致性分析采用Kappa一致性检验,Kappa值大于0.81表示一致性很强,Kappa值介于0.61~0.80表示一致性较强,Kappa值介于0.4~0.6表示一致性中等,Kappa值小于0.4表示一致性较差。若两组计量资料参数符合正态分布,且方差齐同,组间比较采用配对t检验,否则采用Wilcoxon秩和非参数检验。P<0.05为差异有统计学意义。
2 结果
2.1 患者基线资料
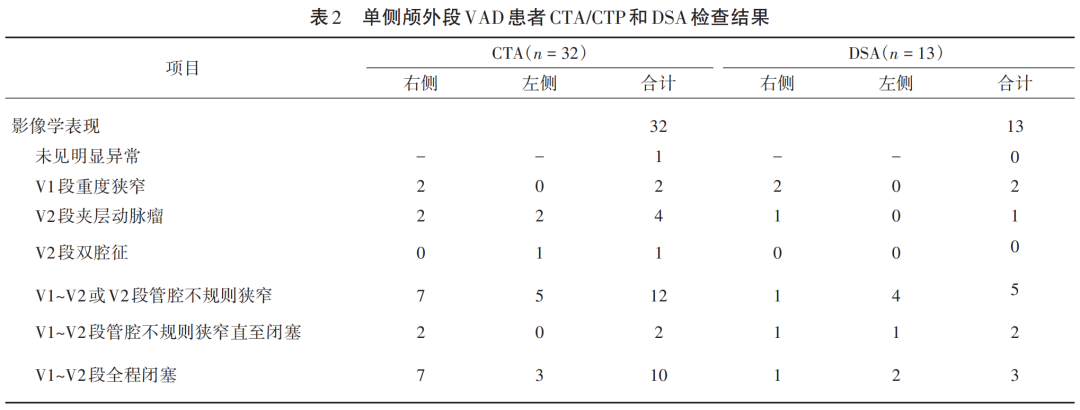
以HRMRI为参考标准确诊为单侧颅外段VAD患者124例,年龄中位数为38岁,其中男性46.0%,自发性发病占91.9%,外伤性占8.1%;39.5%的患者因短暂性脑缺血发作(TIA)或神经功能障碍就诊,包括视物旋转、行走不稳、一侧肢体乏力和/或麻木等症状(见表1)。入院行多模式CT者中32例经HRMRI确诊为单侧颅外段VAD,其CTA结果见表2;而CTP发现17例后循环缺血灌注异常,其中12例右侧小脑半球低灌注、5例左侧小脑半球低灌注[灌注参数脑血流量(CBF)下降、平均通过时间(MTT)延长],其余15例CTP未见明显异常。13例行DSA检查者结果见表2。

2.2 一致性分析
CDU评估单侧颅外段VAD的阳性率为93.2%(123/132);HRMRI诊断单侧颅外段VAD为93.9%(124/132),其中右侧病变占54.8%(68/124)。两者评估颅外段VAD一致性很强(Kappa=0.87,P<0.001)(见表3)。以HRMRI结果为参考标准,CDU评估颅外段VAD的敏感度为99.2%,特异度为87.5%,准确率为86.7%。全部患者中,7例经CDU与HRMRI分析均排除颅外段VAD,包括:4例颈部血管未见明显异常;1例动脉粥样硬化斑块致右侧椎动脉起始部重度狭窄;2例CDU根据椎动脉血流动力学改变包括血流充盈不佳、RI>0.75提示颅内段狭窄,而HRMRI诊断为颅内段VAD。再者,1例CDU判断为左侧VAD者(位于V1段),而HRMRI则诊断为动脉粥样硬化斑块形成。

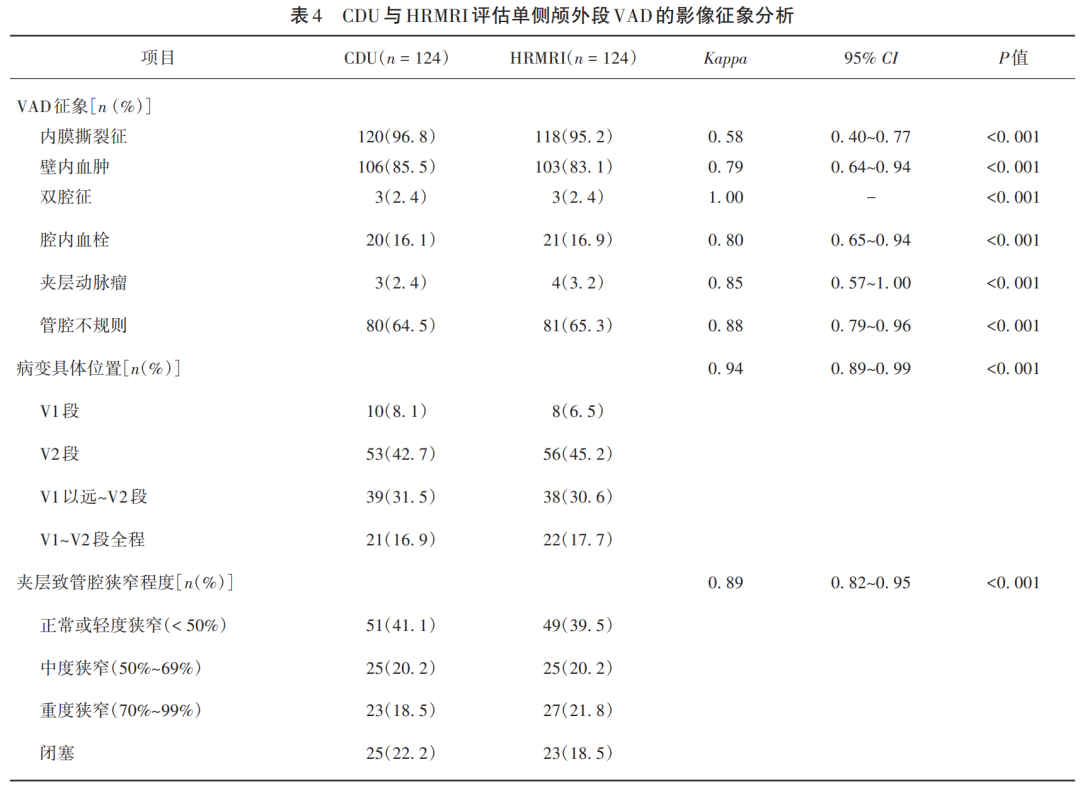
2.3 CDU与HRMRI影像征象
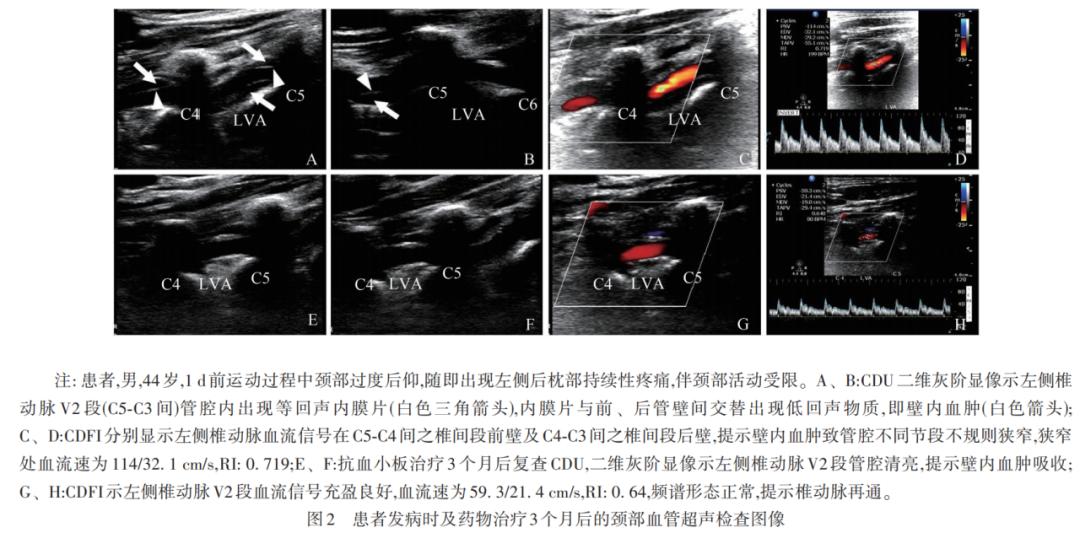
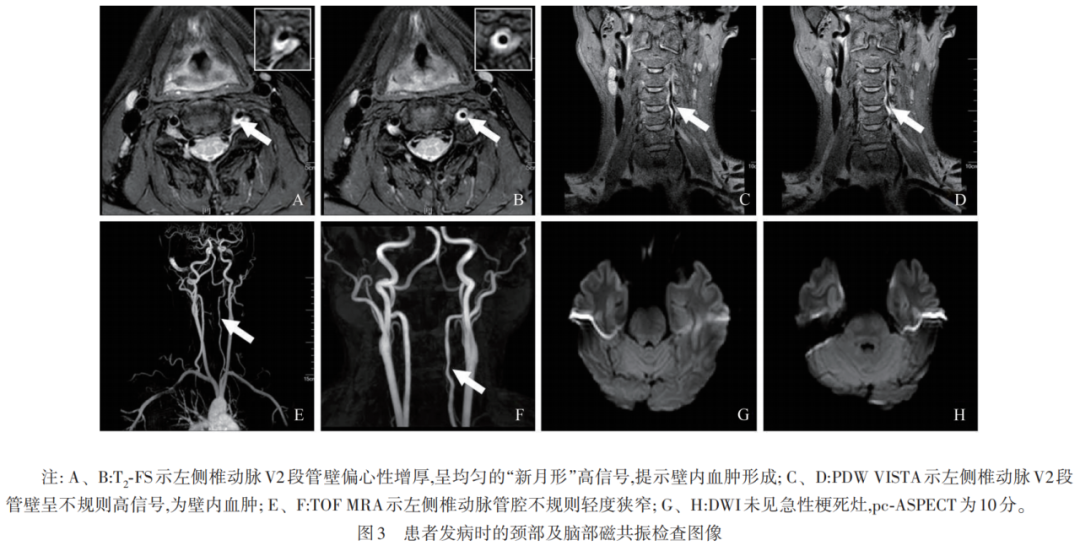
两者检查结果一致性分析(见表4),其中1例壁内血肿形成患者CDU和HRMRI图像分别见图2和图3。典型的双腔征并不多见,CDU与HMMRI检出率均为2.4%(3/124),CDU显示真腔内径大于假腔,且真腔内血流速较假腔内增快。
本研究中,VAD最常见的发病部位为V2段。CDU显示为阴性1例而HRMRI提示为夹层动脉瘤形成,其病灶位于第三颈椎横突孔内。CDU测量病变处最大外径[mm]与HRMRI测量结果[mm]相比较,差异有统计学意义(P<0.001)。再者,HRMRI通过T1、T1+C、T1+C-FS序列进行综合分析,发现17.7%(22/124)患者存在壁内血肿强化;HRMRI测量病变累及长度为(71.5±34.7)mm。通过DWI计算pc-ASPECT评分的中位值为10(9,10)。
3 讨论
VAD是引起中青年人后循环缺血性卒中的重要原因之一,其发生机制包括动脉源性栓塞和/或椎动脉管腔不同程度狭窄甚至闭塞引起的颅内低灌注,早期发现、及时治疗是降低VAD引发后循环缺血性卒中的关键,而精准评估颅外段VAD是选择规范化治疗方式及改善临床预后的前提。以往研究显示,VAD夹层患者以中青年男性为主,本研究患者中位年龄38岁,但男性患者比例为46.0%。且VAD患者缺血性卒中或TIA的发生率为39.5%,其余60.5%的患者主要以颈部或枕部疼痛就诊,考虑与病变处管壁增厚、管径明显增粗压迫周围神经有关,与既往报道相一致。
早期Rodallec等学者认为DSA是诊断VAD的“金标准”,但其价格昂贵,为有创性检查,操作过程本身具有诱发动脉夹层形成的风险,且对于椎动脉闭塞的病变,难以评估管壁增厚情况和管腔内成分等限制其广泛应用。对于椎动脉管腔狭窄或闭塞者,CTA同样难以鉴别粥样硬化斑块、壁内血肿或腔内血栓等性质。根据美国心脏协会和卒中协会的联合声明,没有任何一种影像学检查能够完全优于其他所有检查而成为评估颈部动脉夹层的“金标准”。近年来,随着临床对神经系统疾病病因学诊断的重视,学者们逐渐加深对VAD的关注和认识。CDU可以动态观察管壁及管腔的形态学及血流动力学改变,但其与HRMRI检查的一致性研究鲜见报道。
Luo等研究发现,HRMRI诊断VAD呈不同征象均能提示夹层形成,包括内膜片、壁内血肿、双腔征、腔内血栓、夹层动脉瘤或不规则狭窄。值得关注的是,临床需要评估VAD的受累范围、管腔狭窄程度、是否有腔内血栓形成等影像征象,进而采取个体化治疗,并且通过影像学检查定期随访,客观评估疗效。Nebelsieck等2009年报道,CDU能够诊断颈部动脉夹层,但当壁内血肿位于CDU探头可视范围之外,则可能会被漏诊。随着近几年影像技术的快速发展,HRMRI能通过三维重建观察管壁及管腔。本研究中,以HRMRI为参考标准,CDU诊断颅外段VAD的敏感度可达99.2%,特异度为87.5%,且二者在评估VAD不同征象及血管狭窄程度方面具有很强的一致性,与纳入研究的病例进行两项检查的时间间隔严格控制在48 h内有关。再者,CDU与HRMRI结果均提示,椎动脉走行较长,多种征象通常可并发于同1例颅外段VAD患者中。
本研究CDU与HRMRI结果均表明,颅外段VAD最好发的部位是V2段,与以往报道相符。HRMRI测量病变处最大外径值与CDU相比则更大,差异有统计学意义,一方面考虑HRMRI空间分辨率更高、测量更精确;另一方面可能是壁内血肿短期内动态进展的体现。尽管双腔征是VAD的典型征象,但本研究中其发生率却不高,CDU与HRMRI均仅有2.4%的检出率,结合询问患者是否有突发颈部疼痛等临床症状有助于早期诊断。综上所述,与HRMRI相比,CDU能可靠、有效评估颅外段VAD。
CDU能够实时动态、多切面、多角度显示椎动脉管壁形态及管腔的血流动力学改变,可有效评估颅外段VAD,与Yang等和Traenka等学者研究一致,其不足之处是椎动脉椎间段部分管腔被横突处骨质遮挡,难以显示病变全貌,这也正是本研究中CDU漏诊1例VAD患者的局限性所在。当病变位于椎动脉颅内段时,CDU仅能通过血流动力学改变判断管腔是否存在狭窄,但对于造成狭窄的病变性质则无法明确。HRMRI分辨率高,亦能同时观察管壁和管腔内结构,可以直观显示病灶全貌,且能直接测量病变累及的长度,但HRMRI扫描时间长,体内有金属或假牙、有幽闭恐惧症的患者不适用。二者联合应用,则可优势互补,为颅外段VAD的精准评估和诊疗提供更为全面的客观依据。
本研究表明,CDU与HRMRI评估颅外段VAD一致性很强,但尚存在一定的局限性,此为单中心回顾性研究,样本量较小,且未对颅外段VAD所致管腔重度狭窄或闭塞的颅内侧支循环情况进行分析。课题组后续会进一步总结颅外段VAD的疗效及随访等。
参考文献
[1]Janquli M,Selvarajah L,Moloney MA,et al. Long-term outcome of cervical artery disp[J]. J Vasc Surg,2023,78(1):158-165.
[2]McNally JS,Hinckley PJ,Sakata A,et al. Magnetic resonance imaging and clinical factors associated with ischemic stroke in patients suspected of cervical artery disp[J]. Stroke,2018,49(10):2337-2344.
[3]Wu Y,Wu F,Liu Y,et al. High-resolution magnetic resonance imaging of cervicocranial artery disp:imaging features associated with stroke[J]. Stroke,2019,50(11):3101-3107.
[4]Engelter ST,Grond-Ginsbach C,Metso TM,et al. Cervical artery disp:trauma and other potential mechanical trigger events[J]. Neurology,2013,80(21):1950-1957.
[5]华扬,惠品晶,邢英琦. 中国脑卒中血管超声检查指导规范[J]. 中华医学超声杂志(电子版),2015,12(8):599-610.
[6]Arning C. Ultrasound criteria for diagnosing spontaneous cervical artery disps[J]. Ultraschall Med,2023,44(2):126-150.
[7]North American Symptomatic Carotid Endarterectomy Trial Collaborators,Barnett HJM,Taylor DW,et al. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. N Engl J Med,1991,325(7):445-453.
[8]Yan Y,Lu Z,Ding Y,et al. Predictors of ischemic events in patients with unilateral extracranial vertebral artery disp:a single-center exploratory study[J]. Front Neurol,2022,13:939001.
[9]Tei H,Uchiyama S,Usui T,et al. Posterior circulation ASPECTS on diffusion-weighted MRI can be a powerful marker for predicting functional outcome[J]. J Neurol,2010,257(5):767-773.
[10]Debette S,Mazighi M,Bijlenga P,et al. ESO guideline for the management of extracranial and intracranial artery disp[J]. Eur Stroke J,2021,6(3):ⅩⅩⅩⅨ-LⅩⅩⅩⅧ.
[11]中华医学会神经病学分会,中华医学会神经病学分会脑血管病学组. 中国颈部动脉夹层诊治指南2015[J]. 中华神经科杂志,2015,48(8):644-651.
[12]丁亚芳,惠品晶,仲伟花,等. 颈部血管超声评估椎动脉颅内段狭窄的可行性分析[J]. 中国脑血管病杂志,2016,13(12):638-643.
[13]Markus HS,Levi C,King A,et al. Antiplatelet therapy vs anticoagulation therapy in cervical artery disp:the cervical artery disp in stroke study (CADISS) randomized clinical trial final results[J]. JAMA Neurol,2019,76(6):657-664.
[14]刘西银,卜祎,靳凯辉,等. 颈部动脉夹层患者的影像学、临床特点及预后影响因素分析[J]. 中风与神经疾病杂志,2021,38(7):602-605.
[15]Debette S,Grond-Ginsbach C,Bodenant M,et al. Differential features of carotid and vertebral artery disps:the CADISP study[J]. Neurology,2011,77(12):1174-1181.
[16]Arning C,Hanke-Arning K,Eckert B. The clinical features of disp of the cervical brain-supplying arteries[J]. Dtsch Arztebl Int,2022,119(35-36):581-587.
[17]Robertson JJ,Koyfman A. Cervical artery disps:a review[J]. J Emerg Med,2016,51(5):508-518.
[18]Rodallec MH,Marteau V,Gerber S,et al. Craniocervical arterial disp:spectrum of imaging findings and differential diagnosis[J]. Radiographics,2008,28(6):1711-1728.
[19]Biller J,Sacco RL,Albuquerque FC,et al. Cervical arterial disps and association with cervical manipulative therapy:a statement for healthcare professionals from the American heart association/american stroke association[J]. Stroke,2014,45(10):3155-3174.
[20]Luo Y,Guo ZN,Niu PP,et al. 3D T1-weighted black blood sequence at 3.0 Tesla for the diagnosis of cervical artery disp[J]. Stroke Vasc Neurol,2016,1(3):140-146.
[21]Nebelsieck J,Sengelhoff C,Nassenstein I,et al. Sensitivity of neurovascular ultrasound for the detection of spontaneous cervical artery disp[J]. J Clin Neurosci,2009,16(1):79-82.
[22]Heldner MR,Nedelcheva M,Yan X,et al. Dynamic changes of intramural hematoma in patients with acute spontaneous internal carotid artery disp[J]. Int J Stroke,2015,10(6):887-892.
[23]Yang L,Ran H. Extracranial vertebral artery disp:findings and advantages of ultrasonography[J]. Medicine (Baltimore),2018,97(9):e0067.
[24]Traenka C,Streifler J,Lyrer P,et al. Clinical usefulness of serial duplex ultrasound in cervical artery disp patients[J]. Cerebrovasc Dis,2020,49(2):206-215.
[25]Li Q,Wang J,Chen H,et al. Characterization of craniocervical artery disp by simultaneous MR noncontrast angiography and intraplaque hemorrhage imaging at 3T[J]. AJNR Am J Neuroradiol,2015,36(9):1769-1775.
作者信息
基金项目:苏州市民生科技项目(SS202061);苏州大学技术合作项目(H211064)
作者单位:1.苏州大学附属第一医院颈脑血管超声科,江苏 苏州 215006;2.苏州大学附属第一医院放射科,江苏 苏州 215006;3.苏州大学附属第一医院神经内科,江苏 苏州 215006
通信作者:惠品晶, E-mail:[email protected]
引证本文
颜燕红,惠品晶,陆紫微,等.颈部血管超声与高分辨率磁共振成像评估单侧颅外段椎动脉夹层的一致性研究[J].中风与神经疾病杂志,2023,40(10):877-882.



