Circ Res 浙江大学余路阳团队揭示内皮细胞中HEY1的SUMO化修饰对血管生成的调控作用与机制
时间:2024-01-12 20:42:10 热度:37.1℃ 作者:网络
血管生成在胚胎发育和成体组织损伤后修复中起关键作用,而这一复杂过程的完成离不开多种信号通路对血管生成的调控,以及各个信号通路之间的相互调控与平衡。出芽式血管生成过程中,内皮细胞特化为具有伪足、感应VEGF-A信号且具有迁移能力的尖端细胞(Tip cell)和不断增殖以延长血管的柄细胞(Stalk cell)。尖端细胞与柄细胞在基因表达谱上并不具有本质的区别,而是由相同来源的内皮细胞受到不同信号通路的调节而特化来的,在此过程中起到最重要调节作用的就是VEGF和NOTCH信号通路。VEGF与NOTCH通路的交互调节与平衡对于出芽式血管生成而言至关重要,但是目前对于这两个重要的信号通路交互调节的具体机制的研究仍不完善,有待进一步探索。
NOTCH信号通路激活后,可以促进下游两类效应转录因子(HES和HEY)的表达。这两类转录因子分别在不同的细胞以及不同的发育过程中起作用,而在心血管发育过程中,NOTCH的主要下游效应基因为HEY家族转录因子。HEY家族有3个成员,分别是HEY1、HEY2以及HEYL。这三个蛋白具有不同的时空表达,而HEY1由于被发现可以在转录水平上抑制VEGF信号通路中关键的受体VEGFR2,从而与血管生成的调节联系起来。在内皮细胞管形成过程中,HEY1会发生表达量下降的现象。HEY1的持续表达则会抑制内皮细胞的增殖、迁移以及管形成。然而,目前关于HEY1在血管生成中的作用和机制还不清楚。
SUMO化修饰对于定位于细胞核的蛋白(尤其是转录因子)是一种较常见的翻译后修饰,可以改变被修饰蛋白的细胞定位、稳定性以及与其他蛋白的互作。与泛素化过程类似,SUMO化修饰经历由活化酶E1、交联酶E2和连接酶E3所介导的级联酶促反应。E1活化酶是由SAE1和SAE2组成的异源二聚体,可以激活并装载SUMO蛋白至其内部的半胱氨酸残基上(Cys593),形成硫酯键。随后,SUMO从E1转移到E2,E2可以直接把SUMO连接到目标蛋白的一个或者多个赖氨酸上,形成单SUMO化(即一个蛋白只有一个SUMO化修饰位点)、多SUMO化(一个蛋白具有多个SUMO化修饰位点)或者聚SUMO化(一个SUMO化修饰位点上连接多个SUMO蛋白)。此外,E2还可以被E3激活,从而成倍地提高将SUMO转移到底物上的效率。
2024年1月3日,浙江大学生命科学学院余路阳团队在心血管领域顶尖杂志Circulation Research上发表题为“SUMOylation Fine-Tunes Endothelial HEY1 in the Regulation of Angiogenesis”的研究论文,首次发现内皮细胞中HEY1蛋白能够发生可逆的SUMO化修饰,并阐明SUMO化修饰促进HEY1对VEGFR2、VEGFR3、FGFR1等酪氨酸激酶受体(RTKs)和NOTCH信号元件的转录抑制作用,协调正/负向血管生成通路,在生理性及病理性血管生成中起重要调控作用。该研究进一步完善了血管生成调控系统,为血管生成相关疾病的诊疗提供了新思路。这是余路阳团队有关SUMO化调控血管生成工作(调控NOTCH信号Circ Res 2017、调控FGFR信号PNAS 2022)的新发现。这些发现揭示了血管生成信号网络未知的协调机制,阐明了SUMO化修饰在血管发育和血管生成疾病中的重要作用。

首先,研究者发现内皮细胞中HEY1蛋白可以与SUMO1结合,找到了HEY1的SUMO化修饰位点K82、K90和K292,并且进一步发现TRIM28可以作为E3连接酶,与E2交联酶UBC9协同促进HEY1的SUMO化修饰。同时,内皮细胞中HEY1的SUMO化修饰受到低氧及VEGF-A的调控,也进一步揭示其可能在血管生成过程中发挥功能。
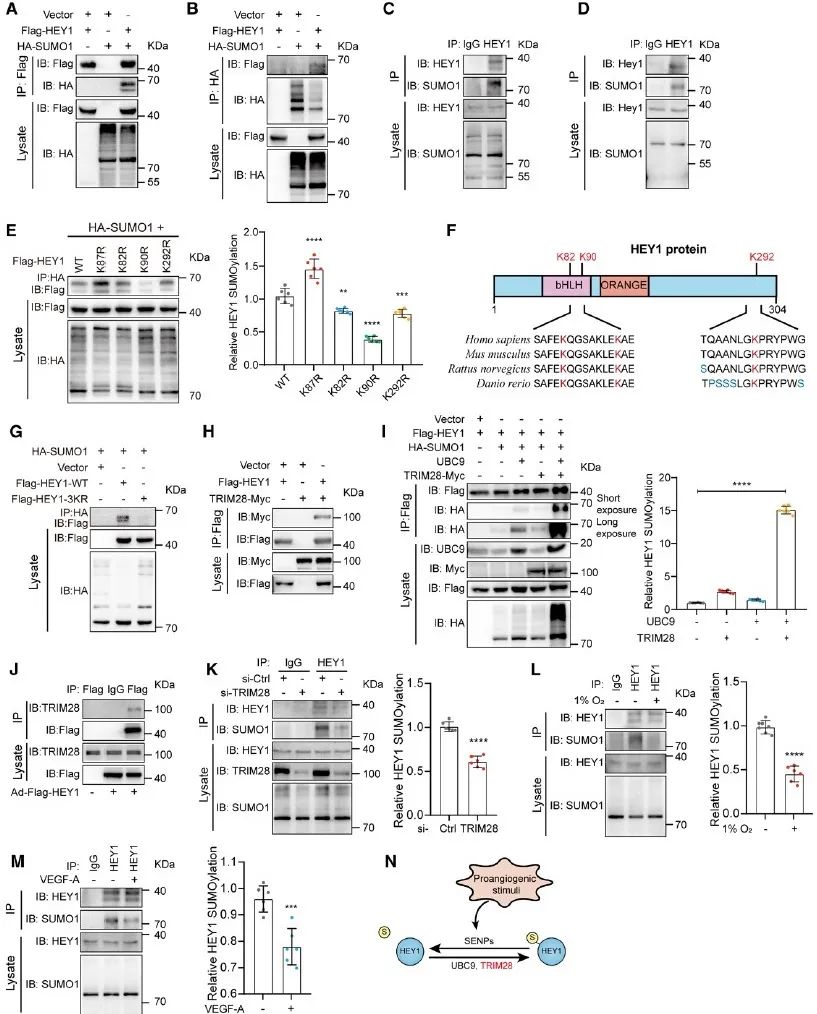
图1. 内皮细胞中的HEY1可以发生SUMO化修饰
为了进一步探究HEY1的SUMO化修饰在内皮细胞中的功能,研究者在内皮细胞中分别过表达HEY1-WT及不能发生SUMO化修饰的突变体HEY1-3KR,发现SUMO化修饰可以促进HEY1对内皮细胞增殖、迁移、出芽及成管等血管生成相关功能的抑制。转录组测序数据进一步揭示,SUMO化修饰可以促进HEY1对VEGFR2、VEGFR3、FGFR1等血管生成相关RTKs的抑制,并通过对DLL4、JAG2、NOTCH1、RBPJ等的抑制,实现对NOTCH通路的负反馈调控。为了能更深入地了解HEY1 SUMOylation调控VEGFR2等RTK的具体机制,研究者借助IP-MS、ChIP-seq及co-IP等实验手段,发现SUMO化修饰促进HEY1形成同源二聚体,而该同源二聚体可以有效识别并结合靶基因启动子上的E-box序列,从而发挥抑制靶基因转录的功能。
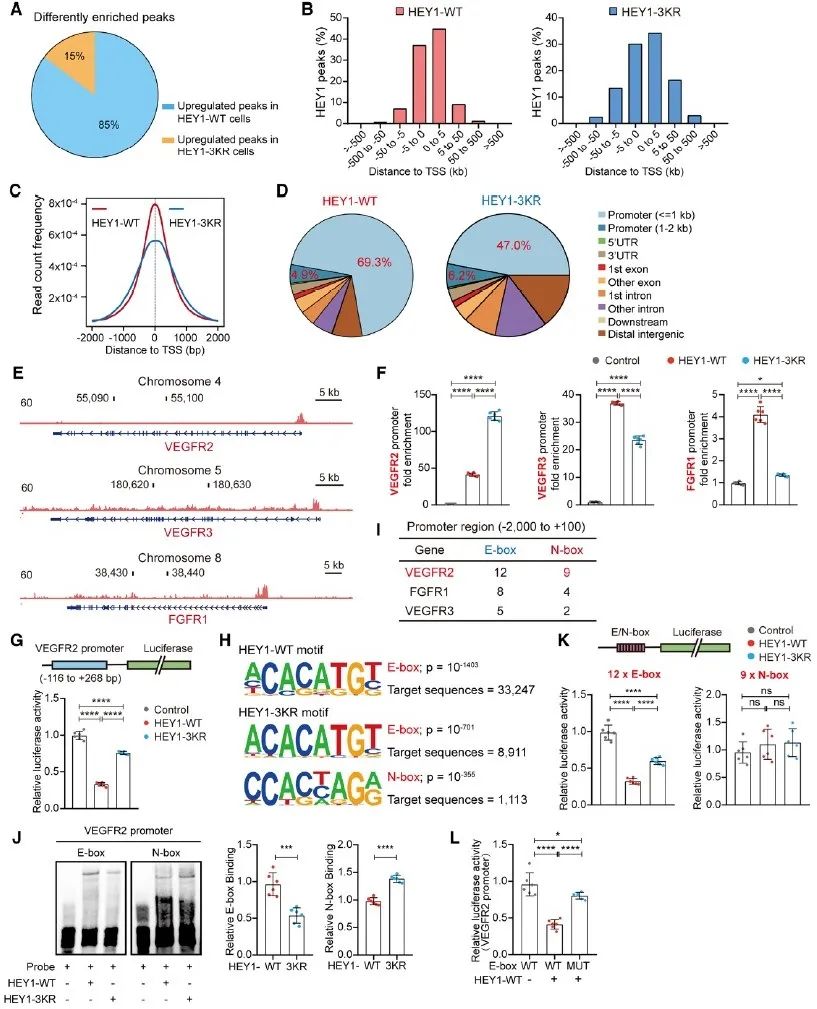
图2. SUMO化修饰促进HEY1对靶基因启动子的识别与结合
最后,研究者构建了HEY1-WT/3KR内皮特异性敲入的小鼠,观察到SUMO化修饰可以通过促进HEY1对内皮细胞增殖的抑制,进而促进其对新生小鼠视网膜血管生成的抑制。而在这一过程中,HEY1 SUMOylation/VEGFR2轴起到重要作用,当研究者用SKLB610腹腔注射新生小鼠抑制VEGFR通路之后,HEY1的SUMO化修饰就不能再发挥出较强的血管生成抑制功能。此外,研究者构建了早产儿视网膜病变模型(OIR model)及肿瘤血管模型等疾病模型小鼠,发现在血管生成相关的疾病中,SUMO化修饰可以促进HEY1对血管生成的抑制,进而为此类疾病的治疗提供了新的思路。
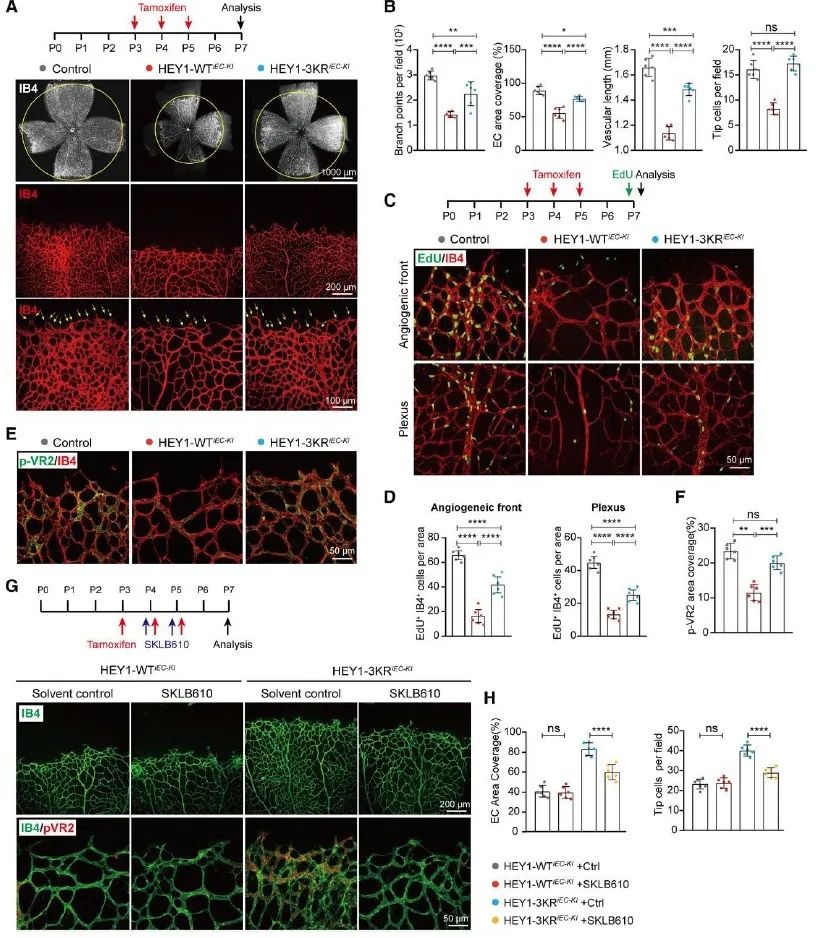
图3. SUMO化修饰促进HEY1对血管生成的抑制
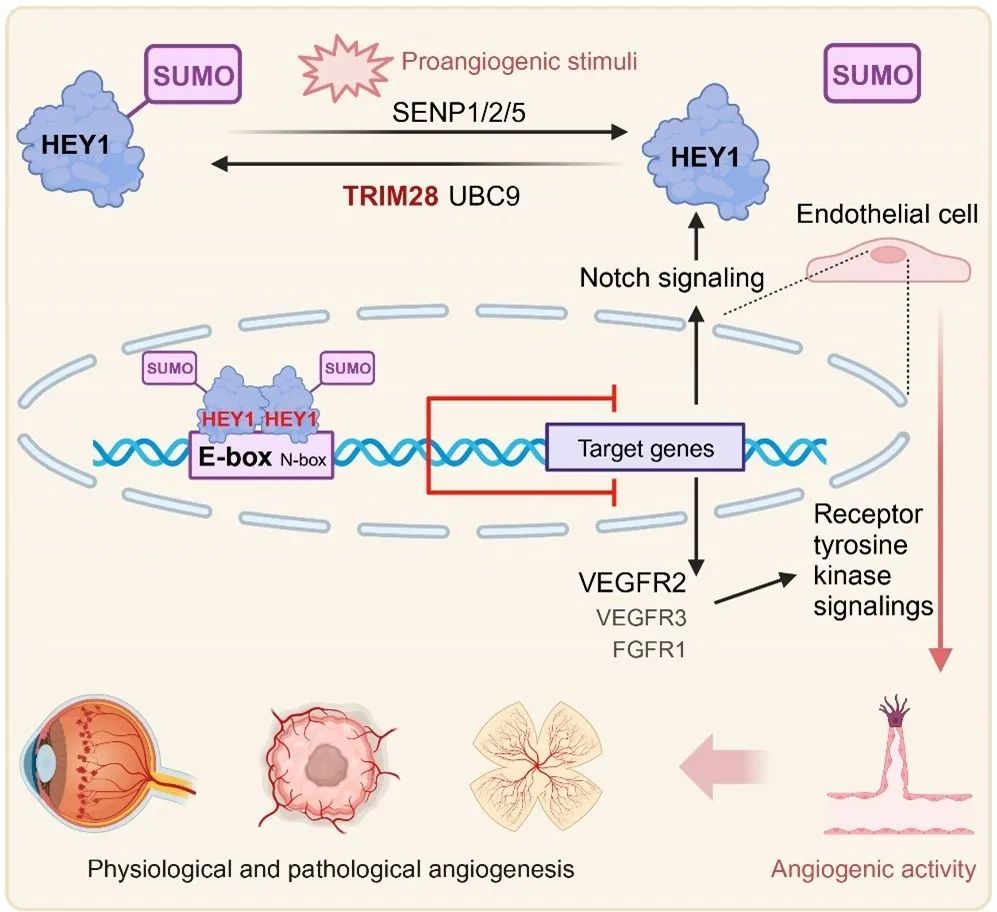
综上,该研究阐明了内皮细胞中的HEY1在促血管生成信号的调控下可以发生可逆的SUMO化/去SUMO化修饰,SUMO化修饰通过促进HEY1形成同源二聚体,从而增强其与靶基因启动子序列的识别与结合,增强其对VEGFR2等RTKs的转录抑制功能,进而促进HEY1对体内血管生成的抑制。
本研究由浙江大学生命科学学院余路阳教授团队完成,同时得到了耶鲁大学医学院等团队的协助与支持。浙江大学生命科学学院博士后任瑞哲为本文第一作者,余路阳教授和位熙旸博士为共同通讯作者。本研究受到国家重点研发专项、国家自然科学基金项目、浙江省自然科学基金项目、浙江省卫生健康委医药卫生科技计划、中央高校基础研究专项资金以及美国国立卫生研究院(NIH)等的资助。
原文链接:
https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.123.323398


