【ASCO教育文集】霍奇金淋巴瘤的治疗:从一线到复发/难治到特殊人群
时间:2024-05-27 16:00:57 热度:37.1℃ 作者:网络
霍奇金淋巴瘤
几十年来,多柔比星、博来霉素、长春碱和达卡巴嗪 (ABVD) 或博来霉素、依托泊苷、多柔比星、长春新碱、泼尼松和丙卡巴肼 (BEACOPP)化疗联合或不联合放疗一直是经典型霍奇金淋巴瘤 (cHL) 治疗的基石,大多数早期和晚期 cHL 患者获得持久缓解。儿科患者接受其改良版本,更频繁地使用放疗。使用中期正电子发射断层扫描 (PET) 结果调整治疗,可根据动态影像学反应重新调整治疗,但其治疗工具(化疗和放疗)仍相同。复发/难治性 (R/R)cHL 患者也仍有第二次机会通过挽救性化疗和自体干细胞移植 (ASCT) 获得持久缓解。
维布妥昔单抗 (BV) 和 PD-1 抑制剂等新药重塑了 cHL 的治疗格局,它们也在治疗早期进行探索,包括作为高危 cHL ASCT 后的巩固治疗,作为 ASCT 前挽救治疗的一部分,以及作为早期和晚期患者初始治疗的一部分。随机研究目前支持在 cHL 一线治疗中使用新药,并且有大量数据支持其用作R/R cHL 挽救治疗的基石。此外新药耐受性良好,是老年患者或伴有合并症的患者的可用选择。
《American Society of Clinical Oncology educational book》近日发表综述,描述了既往未经治疗、R/R和具有挑战性的 cHL 人群的当前治疗策略,包括如何纳入新药。

实际应用
随机研究支持使用新药维布妥昔单抗(BV)和PD-1抑制剂作为经典型霍奇金淋巴瘤(cHL)初始治疗的一部分。
在晚期cHL中,与BV相比,纳武利尤单抗与阿霉素、长春花碱和达卡巴嗪联合使用可改善无进展生存期。
PD-1抑制剂已成为自体干细胞移植前复发/难治性cHL挽救治疗的基石,与化疗联用时可观察到目前最佳结果。
fit、老年cHL患者适合治愈为目的治疗,可能包括BV或PD-1抑制剂,而unfit患者也有有效的新药治疗,可带来持久缓解。
治愈为目的的治疗在妊娠期间(妊娠中期及以后)是安全的,不需要终止妊娠。
随机研究支持使用新药维布妥昔单抗(BV)和PD-1抑制剂作为经典型霍奇金淋巴瘤(cHL)初始治疗的一部分。
在晚期cHL中,与BV相比,纳武单抗与阿霉素、长春花碱和达卡巴嗪联合使用可改善无进展生存期。
PD-1抑制剂已成为自体干细胞移植前复发/难治性cHL挽救治疗的基石,与化疗联用时可观察到目前最佳结果。
fit、老年cHL患者适合治愈为目的治疗,可能包括BV或PD-1抑制剂,而unfit患者也有有效的新药治疗,可带来持久缓解。
治愈为目的的治疗在妊娠期间(妊娠中期及以后)是安全的,不需要终止妊娠。
新诊断霍奇金淋巴瘤的范式转变
新诊断cHL的初始治疗取决于分期。早期cHL(I-II期)患者接受多药化疗联合放疗(CMT)或单纯化疗;晚期 cHL 患者接受完整疗程的全身治疗,很少使用放疗,但儿科患者除外(大多数患者接受巩固放疗)。采用现代化疗方案,绝大多数 cHL 患者可在初始治疗后治愈,早期 cHL 患者的长期缓解率≥85%,晚期 cHL 患者的持续缓解率≥75%。下文将讨论早期和晚期 cHL 纳入新药的近期试验结果,以及如何改变 cHL 治疗模式。
早期患者
早期 cHL 的标准治疗继续为多药化疗联合或不联合放疗,且根据临床风险因素确定化疗持续时间和放疗剂量。低危早期 cHL 患者接受 CMT 时多接受较少的化疗周期(例如ABVD x 2-4)和可能较低剂量的放疗(例如20-30 Gy),而高危早期 cHL 患者在接受 CMT 时接受较长的化疗疗程(例如ABVD 4-6)和较高的放疗剂量(例如30 Gy)。已有多项(大部分是单臂)研究评价 BV 和/或 PD-1 抑制剂纳入早期 cHL 治疗。评价 BV 或 PD-1 抑制剂序贯或联合多柔比星、长春碱和达卡巴嗪 (AVD)(伴或不伴放疗)的研究显示,耐受性普遍良好且疗效良好。但BV联合 AVD(BV-AVD)确实导致周围神经病变 (PN) 和发热性中性粒细胞减少症/败血症的发生率高于早期 cHL 治疗中的发生率。后续研究剔除长春碱(例如BV-AD、BV-纳武利尤单抗-AD),显示耐受性改善且疗效相似。纳入 PD-1 抑制剂治疗早期 cHL 的研究获得好的结局,无进展生存期 (PFS) 可达96%-100%。几项随机研究正在评价纳入 BV 和/或 PD-1 抑制剂与 PET 调适(PET-adapted)化疗或 CMT 相比是否可改善结局,旨在确定一种新的标准治疗。尽管目前仅有小型研究证实较好疗效,但其改变早期 cHL 标准治疗的成功率较高。鉴于缺乏支持使用 BV 和/或 PD-1抑制剂的随机数据,目前仍认为PET调适化疗或 CMT的历史治疗模式作为早期 cHL 的标准治疗。
晚期患者
晚期 cHL 患者的标准治疗为2个疗程全身多药化疗后基于PET 调整治疗组成或总治疗周期数。例如,中期 PET 扫描结果为阴性时,RATHL研究确定在两个 ABVD 周期后省略博来霉素具有非劣效性,而 HD18 研究证实减少BEACOPP周期数的疗效相似。在成人和儿童患者中,在 ECHELON-1 和 AHOD1331 研究的基础上,将 BV 纳入晚期 cHL 的初始治疗可改善疗效。与6个周期非 PET调适 ABVD 相比,接受6个周期 BV-AVD 治疗的成人患者具有更优的改良PFS、PFS和总生存期 (OS)。成人患者的疗效更佳但毒性增加,BV-AVD可导致PN、发热性中性粒细胞减少症和脓毒症增加,且需要预防性使用粒细胞集落刺激因子 (G-CSF)。对于儿童患者,BV联合多柔比星、长春新碱、依托泊苷、泼尼松和环磷酰胺可改善IIB 期伴大包块、IIIB期和 IVA-B期cHL 患者的无事件生存期,且与标准治疗相比毒性无差异。然而,大多数合并 BV的儿童患者 (53.4%)也接受了巩固放疗,可能与晚期毒性作用相关。
随机 HD21 研究评价了将 BV 纳入 BEACOPP 基础治疗联合额外化疗的疗效,旨在确定非劣效性,同时降低急性和长期毒性(如不育和继发性恶性肿瘤)。BV、依托泊苷、多柔比星、环磷酰胺、达卡巴嗪和地塞米松 (BrECADD) 与BEACOPP 方案之间的差异包括依托泊苷剂量减少、用 BV 替代长春新碱、省略博来霉素、用达卡巴嗪替代丙卡巴嗪以及用较短疗程的地塞米松替代泼尼松。BrECADD达到主要安全性终点,即降低治疗相关发病率,3-4级器官毒性或4级贫血、血小板减少症或感染较少(BEACOPP为42% vs 59%;P<0.0001)。BrECADD组需要的输血(红细胞输血8% vs 22%,血小板输血6% vs 13%)少于BEACOPP组,感觉性 PN(38% vs 49%) 也更少。值得注意的是,BrECADD后残余卵巢功能似乎更好,治疗后女性和男性患者的治疗平均促卵泡激素 (FSH) 水平在正常范围内,而BEACOPP治疗后平均 FSH 水平为异常。接受 BrECADD 治疗的晚期 cHL 患者的3年PFS(94.9%) 极佳且不劣于 BEACOPP (92.3%)。由于急性毒性降低、疗效非劣效且早期信号表明长期毒性较低,因此当需要强化治疗时,BrECADD可替代 BEACOPP 作为晚期 cHL 的标准治疗。
S1826 研究是评估 PD-1 抑制剂作为晚期 (III-IV期)cHL 初始治疗的第一项随机 III 期研究,旨在在儿童和成人不同年龄范围内评估统一的 cHL 治疗方案。年龄≥12岁的患者按1:1随机分配接受6个周期的纳武利尤单抗联合 AVD 化疗 (N-AVD) 或标准 BV-AVD 治疗,治疗结束 (EOT)时PET残留代谢活动性病变可接受放疗。根据年龄、国际预后评分 (IPS) 和使用 EOT 巩固放疗的意图对患者进行分层评估。接受 BV-AVD 的患者需要接受G-CSF,而接受 N-AVD 的患者可选择生长因子支持。研究共入组994例患者,人群具有多样性;近1/4的患者年龄小于18岁,10%的患者年龄大于60岁,约1/4的患者来自较少见的种族。不到1%的患者接受符合方案的 EOT 放疗。在第二次计划的中期分析时达到其主要终点,中位随访时间12.1个月时,N-AVD的 PFS 优于BV-AVD(HR=0.48。单侧P=0.0005),1年 PFS 分别为94%和86%;无论年龄、IPS评分和分期如何,纳武利尤单抗在各患者亚组中的 PFS 获益均一致。BV组有11例死亡,而纳武利尤单抗组有4例死亡。N-AVD的耐受性优于BV-AVD,BV组的治疗中止率较高,纳武利尤单抗组免疫相关不良事件的发生率较低。由于缺乏强制性 G-CSF 预防,纳武利尤单抗组中性粒细胞减少症更常见;但发热性中性粒细胞减少症、败血症和感染的发生率未增加。基于优越的疗效、改善的耐受性和较低的放疗使用率,S1826研究改变了晚期 cHL 患者的治疗模式。N-AVD是一种新的标准治疗,确立了 PD-1抑制剂在 cHL 初始治疗中的关键作用(表1)。
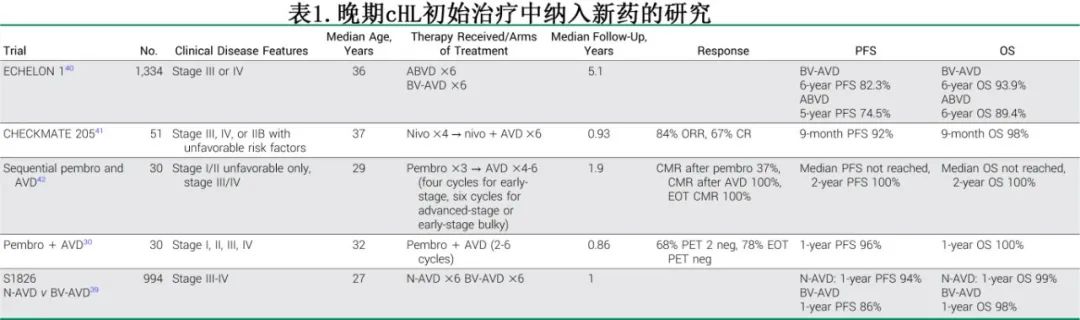
复发性霍奇金淋巴瘤的范式转变
既往,复发性/难治性 (R/R) cHL 患者通常先接受非交叉耐药的细胞毒化疗方案,然后在化疗敏感患者中进行ASCT。最常见的治疗方案包括铂类为基础的异环磷酰胺、卡铂和依托泊苷 (ICE) 化疗或含吉西他滨的治疗方案,如吉西他滨、长春瑞滨和多柔比星脂质体 (GVD)。这些方案联合ASCT 时高度有效,长期治愈率约为50%。BV和抗 PD-1 抗体的引入显著改善了复发患者的结局,ASCT后2年和5年 OS 率分别达到75%和59%。然而,现在 BV 和 PD-1 抑制剂已常规用于一线治疗,导致传统化疗相对于抗 PD-1 和 BV 对复发患者的作用尚不清楚。新药在挽救治疗中的显著疗效进一步挑战了移植的作用。尽管数据正在不断发展,但移植仍是适合移植的初始复发患者治疗的基石。目前多项研究表明,无论既往治疗如何,含 PD-1 抑制剂挽救治疗后继续移植患者的结局均改善(表2)。
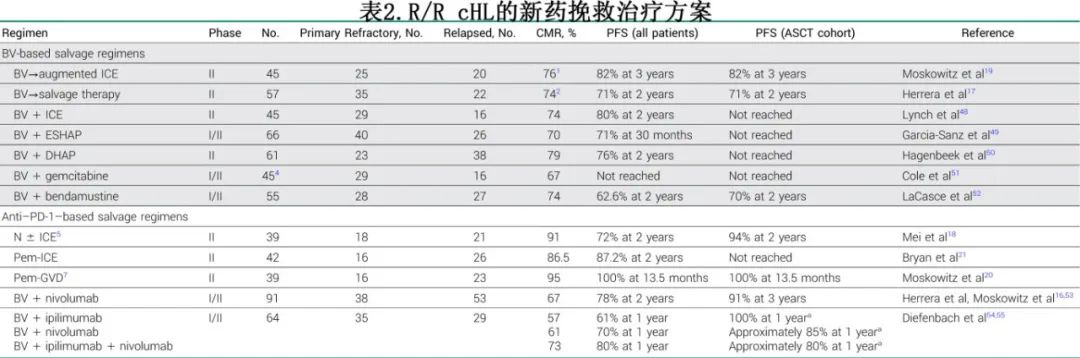
BV在复发治疗中的作用
BV单药治疗多线复发cHL 患者的总缓解率 (ORR) 为75%,完全缓解率(CR)为34%,中位 PFS 为9.3个月。随后研究了 BV 单药和BV联合化疗作为ASCT桥接治疗。BV单药作为ASCT桥接治疗的 ORR 为75%,CR率为43%,与 ASCT 后几乎相同。BV单独给药后未达到CR(Deaville评分1-3)的患者接受序贯化疗,约半数患者可进行 ASCT 而未接受挽救化疗;移植患者的结局良好,2年 PFS 为77%。Moskowitz等还评价了 PET 驱动方案,该方案结合ICE 增强化疗用于单独 BV 未能达到 CR 的患者。仅27%的患者单独BV治疗达到CR(Deauville评分1-2)并接受ASCT,其余患者接受了2个周期的增强ICE;整体患者中76%在 ASCT 前获得CR。移植后结果极佳,2年 PFS 为80%。重要的是,单独使用 BV 与使用 BV 和ICE 后达到 CR 的患者的结局无显著差异。Lynch等通过联合剂量密集的 BV 和 ICE 获得相似的结局,但血液学和非血液学毒性显著,1例治疗相关死亡。除 ICE 外,BV还与许多其他化疗方案联合应用,ASCT 后CR 率高达70%-79%,2年 PFS 率达70%-76%。
抗PD-1为基础的复发治疗
抗 PD-1为基础的治疗在多种情况下优于BV,包括一线和复发。随机 III 期研究 KEYNOTE-204 在头对头比较中证实了帕博利珠单抗与 BV 相比的优效性。帕博利珠单抗中位 PFS 为13.2个月,而 BV 为8.3个月。后续研究在适合移植的患者中评估了多种抗 PD-1 抗体联合化疗、BV和伊匹木单抗等。在 ASCT 前的任何时间点接受PD-1 为基础的挽救治疗,与 BV 或化疗为基础挽救治疗相比均可显著改善PFS。
帕博利珠单抗-GVD 是完全门诊患者给药的移植前方案,在适合移植 R/R cHL 患者的 II 期研究中进行评估。患者接受2-4个周期,2-4个周期后 PET 评估达到CR(Deauville≤3) 的患者继续接受ASCT。允许ASCT 后进行维持治疗,约三分之一的患者接受 BV 维持治疗。大多数患者在仅2个治疗周期后便达到CR(n=31),其余患者则接受4个周期(n=8)。36例 (95%) 患者接受ASCT。迄今为止,帕博利珠单抗-GVD的疗效最佳,ORR和 CR 率分别为100%和95%,所有移植患者在末次随访时均保持缓解。一项II 期研究评估了帕博利珠单抗与 ICE 联用的类似方案,但需要住院治疗,结果2年 PFS 和 OS分别为87.2%和95.1%。对2例患者的 FDG-PET 阳性新区域进行了活检,结果淋巴瘤未累及,突出了免疫治疗背景下 PET假阳性的问题。
ICE 还以序贯方式与纳武利尤单抗联合使用 (Nivo-ICE)。该PET引导的研究允许缓解患者在移植前接受仅纳武利尤单抗治疗。治疗包括6个周期的纳武利尤单抗治疗,如果达到CR则进行ASCT;未达到 CR 者接受 Nivo-ICE 化疗2个周期。大多数患者能够接受纳武利尤单抗单药后ASCT(n=34),而少数患者 (n=9) 在纳武利尤单抗后接受 Nivo-ICE。方案治疗结束 CR 率为91%。总体结局极佳,大多数患者可直接进行移植,ASCT的患者2年 PFS 为94%。
最后,新药免疫疗法联合方案的效果都极好。BV和纳武利尤单抗治疗4个周期的 ORR 为85%,CR率为67%,3年 PFS 为77%;BV+Nivo后直接ASCT 的患者的3年 PFS 较高,为91%。一项 I 期研究评价了免疫治疗+BV,结果相似,并进一步证明PD-1相对于非PD-1疗法的优效性。值得注意的是,加用 PD-1均未对干细胞动员或采集或植入产生负面影响。
尽管尚无明确的随机研究确定 R/R cHL 的最佳挽救治疗方案,但基于观察到的显著疗效,抗PD-1为基础的挽救治疗已作为移植前标准方案纳入常规实践。但移植前抗 PD-1 治疗的问题包括可能增加植入综合征的风险,应密切监测并及时使用皮质类固醇治疗。考虑到支持抗 PD-1 挽救治疗的大量数据,对于一线治疗后 R/R cHL 患者,通常建议接受 PD-1 抗体联合非交叉耐药化疗或 BV 作为挽救治疗并序贯ASCT。
多项研究表明,R/R cHL患者接受抗 PD-1 为基础的挽救治疗后的结局非常好,近期研究评价了 PD-1 抑制剂联合化疗或BV(通常后续基于抗 PD-1 维持治疗,后续未进行ASCT)。尽管这些研究的中位随访时间太短而无法得出任何结论,但仍有部分患者在无 ASCT 的抗 PD-1 挽救治疗后出现持续缓解。
移植后维持治疗
为了改善移植后缓解而研究了结合 BV 或 PD-1抑制剂的维持治疗。在 III 期 AETHERA 研究中,BV维持治疗组的5年 PFS 优于安慰剂组(分别为59%和41%);其入组标准仅限于BV初治、伴有以下一种或多种情况的高危患者:原发难治性疾病、初始治疗后 <1年复发或复发时存在结外病变。尽管这是一项在发表时改变实践的研究,但在当前新药时代进行的后续回顾性研究表明,BV维持治疗的获益可能仅限于在 ASCT 前未接受过新药的患者。
已在3项单臂 II 期研究中评价抗 PD-1 为基础的维持治疗。R/R cHL患者在 ASCT 后60天内给予帕博利珠单抗,最多8个周期(根据AETHERA,90%有高危因素)。治疗获得极佳的长期结局,可评价患者的18个月 PFS 为82%,OS为100%。毒性有所增加,40%至少发生1起≥2级免疫相关AE。在纳武利尤单抗单药治疗和纳武利尤单抗联合 BV 的研究中观察到相似的结局。纳武利尤单抗单药维持治疗的初步数据中,6个月 PFS 为92%,OS为100%。BV+纳武利尤单抗作为移植后维持治疗的18个月 PFS 为94%。但两药治疗与较高的毒性发生率相关,包括53%的 PN 发生率、29%因免疫相关 AE 需要皮质类固醇治疗和24%提前停止治疗。但这是为数不多的的现代研究之一,很多患者接受了既往曾暴露的新药;51%的患者既往接受过BV,42%的患者既往接受过抗 PD-1 治疗,表明与 BV 不同,既往暴露于PD-1 治疗未降低移植后疗效。
新药在当代维持治疗的实际应用可包括高危患者,这些患者未暴露于该新药或具有最佳缓解和最小毒性。
总结
挽救治疗后ASCT仍是一线治疗后 R/R cHL 的标准治疗。基于 PD-1 异基因联合挽救治疗的极佳结果,使用抗 PD-1 治疗联合化疗或 BV 已成为一种常见实践。然而,随着 cHL 一线治疗的发展以及 BV 和 PD-1抑制剂的常规结合,需要根据接受的初始治疗药物调整挽救治疗方案。同样,新药维持治疗的效用尚不清楚,因为 BV 和 PD-1 抑制剂已用于一线治疗和移植前挽救治疗。R/R cHL初始治疗的逻辑策略是使用既往未使用过的新药(例如BV-AVD后抗 PD-1治疗);未来研究有必要在一线新药时代评价 R/R cHL 的最佳挽救治疗。
特殊HL人群的治疗考虑
老年患者常规治疗的结局较差,但随着 cHL 新型靶向治疗的出现,人们对这一具有挑战性的患者人群的关注越来越多,也包括老年和年轻患者中可能发生的患者合并症,积极的医疗管理和治疗前康复允许实施最有效的 cHL 治疗。另一个具有挑战性的患者人群为妊娠期间发生cHL,也需要特殊管理考虑。
老年患者
年龄≥60岁的老年患者约占 cHL 的20%。与年轻患者人群以及年龄和性别匹配的对照相比,老年 cHL 患者的生存率更差,相关因素包括合并症、体能状态差、组织学差异和疾病晚期。此外,治疗相关因素包括无法按计划耐受全剂量化疗和治疗相关毒性发生率增加而影响结局。从历史上看,老年患者在临床试验中的代表性不足,但脆弱(frailty)和功能(functionality)的评估已在改善。
根据正式评分,如累积疾病评分和工具性日常生活活动 (ADL) 评估,基线诊断时脆弱(根据疾病累积等级评分[Cumulative Illness Rating Scale,CIRS]和日常生活活动[activities of daily living, ADL]等评估)是老年 cHL 患者 OS 的强预测因素。达到 CR 强烈预测生存率;而与达到 CR 相关的因素包括合并症评分和 ADL,虚弱患者始终无法完成治疗。还需要更多的研究来描述更全面的老年评估。
化疗方案
德国霍奇金研究组在早期老年 cHL 患者中分析了 HD10 和 HD11 研究中 ABVD 的结局,观察到极佳的5年PFS,估计为75%,但老年患者的平均治疗延迟达两倍(2.2 vs 1.22周),该组中 WHO 3 级和4级毒性也更常见 (68 vs 50%),导致老年患者的治疗相关死亡率为5%。这些研究表明,与4个周期的含博来霉素治疗相比,2个周期的含博来霉素治疗可降低肺毒性。HD13研究发现,从两个 ABVD 周期中去除博来霉素仅可使无治疗失败率降低4%,而进一步的回顾性数据表明,如果在老年患者中降低博来霉素剂量,OS不受影响。因此,鉴于肺毒性和相关治疗相关死亡率的高发生率,博来霉素在老年 cHL 患者中通常应省略或慎用。
其他的含蒽环类方案包括环磷酰胺、多柔比星、长春新碱和泼尼松龙,此外多柔比星、环磷酰胺、长春新碱、丙卡巴肼和泼尼松龙 (ACOPP) 也可用于老年患者。在41例老年 cHL 患者中实施的一项回顾性研究显示,环磷酰胺减量的 ACOPP 的2年 PFS 和 OS 分别为73%和93%,可耐受,无重度副作用,但接近60%的患者在治疗过程中需要住院治疗。
含BV方案
采用BV为基础方案治疗不适合常规多药化疗的初治老年 cHL 患者的研究已进行探索。UK研究使用单药 BV 治疗年龄≥60岁的 cHL 患者,或年龄<60岁、unfit、或因心脏射血分数<50%/显著心脏病发病率和/或肺功能受损而不适合联合化疗的 cHL 患者。尽管 BV 耐受性良好,但缓解和持久性有限,CR率为26%,中位 PFS 为7.3个月。此外,29%的患者因不可接受的毒性而停止治疗,主要是由于感觉神经病变。
III期 ECHELON-1 研究在186例≥60岁患者中评估了A+AVD 与 ABVD。中位随访61个月,A+AVD与 ABVD 的5年 PFS 率分别为67.1%和61.6%。ABVD组的肺部不良事件发生率高于 A+AVD 组(分别为13% vs 3%)。A+AVD组的 PN 发生率(任何等级29% vs 17%)和重度 PN 发生率(分别为5% vs <1%)更高,但缓解率相似(分别为85.6% vs 87%)。
BV 已在老年 cHL 患者标准 AVD 前、后序贯使用。在单药 BV 导入期2次给药后,患者接受6个周期 AVD化疗,随后缓解患者接受4次 BV 巩固治疗。48例患者中77%完成了6个周期的AVD,73%接受了至少1次 BV 巩固治疗。初始 BV 导入治疗后的 ORR 和 CR 率分别为82%和36%,2年无事件生存 期、PFS 和 OS 率分别为80%、84%和93%。该研究表明,序贯 BV-AVD 的耐受性良好,对于能够耐受蒽环类药物和联合化疗的老年患者具有良好结局,并且基于老年评估的措施与患者的生存率密切相关。然而,33%的患者发生2级PN,治疗的持续时间较长。
一项 II 期、非随机研究评价了BV 单药、BV+达卡巴嗪 (DTIC) 和 BV+苯达莫司汀。对于接受 BV 单药治疗的患者,ORR为92%(CR,72%),但复发率较高。22例患者接受1.8 mg/kg BV和375 mg/m2 DTIC,最多12个周期;95%的患者达到客观缓解,64%的患者达到CR。中位随访时间为63.6个月,中位缓解持续时间为46.0个月,中位 PFS 为47.2个月,未达到中位OS。10例患者 (45%) 发生≥3级治疗后出现的不良事件,包括≥3级感觉性 PN (27%) 和中性粒细胞减少症 (9%),但总体耐受性良好。但加用苯达莫司汀导致毒性增加,包括数例治疗相关死亡。对于老年 cHL 患者,基于耐受性和缓解持续时间,BV联合 DTIC 可能是一线选择。
抗 PD-1为基础的方案
两项研究评估了 PD-1 抑制剂作为老年 cHL 患者的一线治疗。前瞻性 Lysa II 期研究评估了纳武利尤单抗单药治疗或联合长春碱治疗初治≥61岁伴合并症的 cHL 患者的安全性和疗效。给予患者6个周期的纳武利尤单抗诱导期,达到完全代谢缓解 (CMR) 的患者继续18个额外周期的纳武利尤单抗单药治疗;达到≤部分代谢缓解 (PMR)的患者接受18个周期的纳武利尤单抗联合长春碱治疗。总体而言疗效令人失望:EOT时,16例 (28.6%) 患者达到CMR,10例(17.9%)为PMR,10例 (17.9%) 无缓解,17例 (30.4%)疾病进展。15例 (23.4%) 患者在治疗期间死亡。
澳大利亚一项研究使用帕博利珠单抗作为初治老年 cHL 患者的单药治疗。20例患者接受中位11个周期的治疗,ORR为72%,CR率为32%。尽管5例患者死亡,但无治疗相关死亡。免疫介导的 AE 是最常见副作用,证明该治疗是可行的,具有合理疗效。
在 S1826 研究中,97例≥60岁患者随机分配到 N-AVD 或 BV-AVD 组,分别有52%和38%的患者发生3级血液学毒性,但 N-AVD 组的发热性中性粒细胞减少症、败血症和感染发生率低于 BV-AVD 组。在总体发生率和严重程度方面,N-AVD的 PN 发生率远低于BV-AVD。N-AVD和 BV-AVD 的1年 PFS 分别为93%和64%,非复发死亡率分别为4%和14%。N-AVD 组10%和BV-AVD 组33%提前中止治疗。在≥60岁患者中,N-AVD可改善 PFS 和EFS且耐受性优于BV-AVD,表明 N-AVD 可能是能够耐受联合化疗的老年患者的主要选择。S1826数据表明,≥60岁患者应避免联合使用BV-AVD,因为败血症/感染的风险较高,并导致治疗相关死亡。
BV联合抗PD-1治疗
还在老年患者中研究了纳武利尤单抗联合BV作为一线治疗。在一项46例患者的 II 期研究中,BV+纳武利尤单抗治疗8个周期,22例 (48%) 患者获得CMR,6例 (13%) 患者获得PMR (ORR 61%)。另一项研究在老年患者中评价了更长疗程的BV+纳武利尤单抗(最多16个周期),ORR为86%,CR率为67%,缓解更持久。中位随访51.6个月,未达到mDOR、mPFS和mOS。76%的患者发生治疗后出现的≥3级不良事件,其中脂肪酶升高 (24%)、运动性PN(19%)、感觉性PN(19%)最常见。尽管仍需进一步验证,但这些研究表明 BV+纳武利尤单抗可能是无法耐受化疗的老年 cHL 患者的可用选择(表3)。
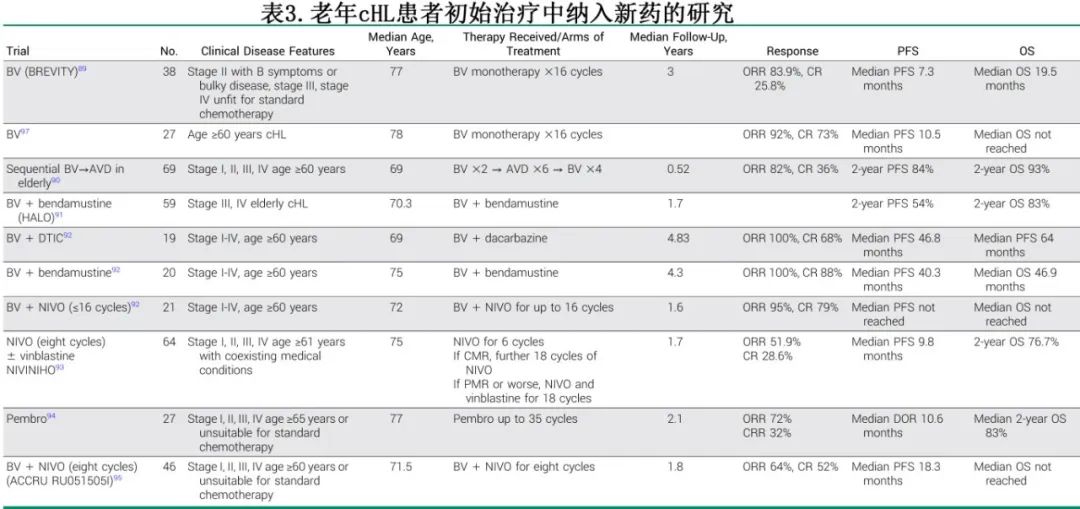
伴合并症的患者
心脏疾病
伴心脏病或有多种心脏危险因素的患者使用蒽环类药物后发生心力衰竭的风险较高。在既存心肌病或心力衰竭的患者中,cHL 相关死亡率是心血管相关死亡率的4倍(37% vs 8%)。cHL相关死亡率高可能部分归因于蒽环类药物使用较少。对于确诊心脏病的患者,必须与心脏病学或心脏肿瘤学密切合作,以便于优化药物治疗、筛查、监测超声心动图和其他策略,从而可以确定是否可以安全地提供含蒽环类治疗方案。
肾脏疾病
博来霉素肺毒性的发生率范围为5%-32%,相关死亡率为10%-25%。主要风险因素为年龄,但年龄增加的风险部分归因于肌酐清除率下降,因为博来霉素主要经肾脏代谢。对于肾损害患者,应慎用博来霉素。对于终末期肾衰患者,有病例报告了 BV可安全给药。
妊娠
对于妊娠合并 cHL 的管理,尚无前瞻性试验,但已发表病例报告、系列和队列研究。优先考虑事项为母亲的健康,患者应与产科专家团队共同管理。
可根据孕程考虑推迟治疗直至产后,但在大多数情况下,化疗可在孕中期和孕晚期安全给药,且母体和胎儿结局极佳。只有在极少数情况下才需要考虑终止妊娠。应避免含辐射的影像学,应使用磁共振和超声进行分期和缓解评估。
ABVD 是首选方案,已在所有三个孕期有所使用。胎儿发育的潜在风险在妊孕早期最高,器官形成和致畸性的可能性更高,因此应避免在孕早期暴露于化疗。对于维布妥昔单抗等新型药物,尚无妊娠期用药的数据,其潜在的致畸和毒性作用尚不清楚。放疗应尽量延迟至分娩后。
总结
老年、fit cHL 患者的治疗应以治愈为目的,大多数情况下包括使用蒽环类药物,减少或省略博来霉素,也可以考虑使用新药如 BV 和 PD-1 抑制剂。unfit或脆弱患者的治疗取决于合并症,应根据个体患者进行相应调整,减少或省略以蒽环类药物为基础的治疗,并可能使用 BV 和/或检查点抑制剂。对于老年 cHL 患者或伴有合并症的患者,应进行仔细的临床监督,并密切监测潜在的治疗相关毒性,包括感染性并发症和器官损伤。对于妊娠患者,优先考虑母亲的健康很重要,ABVD化疗可以在孕中期和孕晚期安全给药。
结论
近年来,由于 BV 和抗 PD-1 阻断抗体的结合,cHL治疗领域发生了巨大的变化。随机化研究目前支持使用这些新药作为晚期 cHL 初始治疗的一部分,并且有大量证据支持在 ASCT 之前将其用作 R/R cHL 挽救治疗的一部分。即使在老年患者和其他具有挑战性的情况下,也可以进行根治性治疗,通常结合新药以省略博来霉素和/或减少毒性。从一线治疗到疾病复发的治疗,BV和 PD-1抑制剂已经发展了 cHL 的治疗模式,超越了历史上的化疗和放疗。
参考文献
Burton C, et al. Paradigm Shifts in Hodgkin Lymphoma Treatment: From Frontline Therapies to Relapsed Disease. Am Soc Clin Oncol Educ Book. 2024 Jun;44(3):e433502. doi: 10.1200/EDBK_433502


