【论著】颅内动脉狭窄支架置入术围手术期安全性评估:富穿支动脉对比少穿支动脉
时间:2024-05-30 13:01:15 热度:37.1℃ 作者:网络
摘要:目的 探讨颅内动脉粥样硬化性狭窄(ICAS)支架置入术后30 d内的卒中发生率,对比富穿支动脉与少穿支动脉患者之间临床资料的差异,分析穿支动脉对颅内动脉狭窄支架置入术安全性的影响。 方法 检索2017年1月至2021年12月空军军医大学第二附属医院神经外科血管病数据库,筛选符合入组条件的所有接受支架置入术治疗的症状性ICAS病例,收集患者人口学资料(性别、年龄)、危险因素、临床表现(脑梗死、短暂性脑缺血发作)、病变位置(基底动脉及大脑中动脉M1段为富穿支动脉,颈动脉及椎动脉颅内段为少穿支动脉)及影像学资料、手术相关信息以及术后30 d内出血和缺血事件。依据穿支动脉情况,将患者分为富穿支动脉组和少穿支动脉组,比较两组患者的临床资料。采用单因素Logistic回归分析和多因素Logistic回归分析,分析影响术后卒中发生的因素。 结果 共196例患者因ICAS接受支架置入术治疗。术后30 d内发生卒中12例(6. 1%),其中出血性卒中6例(3. 1%),缺血性卒中6例(3. 1%)。富穿支动脉组96例,术后出血性卒中4例,缺血性卒中6例,卒中发生率10. 4%;少穿支动脉组100例,术后出血性卒中2例,缺血性卒中0例,卒中发生率2. 0%,富穿支动脉组围手术期卒中发生率明显高于少穿支动脉组,差异有统计学意义(P < 0. 05)。多因素Logistic回归分析结果显示,穿支动脉(OR = 6.01,95% CI:1. 25 ~ 28. 91,P =0.020)和吸烟(OR = 0. 18,95% CI:0. 04 ~ 0. 89,P = 0. 036)是术后发生卒中的独立影响因素,相对于少穿支动脉,富穿支动脉发生术后卒中的风险更高。 结论 ICAS支架置入术围手术期的卒中发生率在可接受范围,富穿支动脉的基底动脉和大脑中动脉M1段狭窄具有更高的围手术期卒中发生率,吸烟也是围手术期卒中发生的影响因素。
卒中是世界第二大、中国第一大导致人口死亡的原因。亚洲卒中患者中,以颅内动脉粥样硬化性狭窄(intracranial atherosclerotic stenosis,ICAS)最为常见,占比33% ~ 67%。中国人群颅内动脉粥样硬化(the Chinese intracranial atherosclerosis,CICAS)研究报道,在连续纳入的2 864 例卒中患者中,46. 6%的患者存在ICAS,为了预防ICAS 患者发生卒中,国内外研究者寄希望于经皮腔内血管成形术和支架置入术(percutaneous transluminal angioplasty and stenting, PTAS)。在一系列前瞻性研究如一种新型的、自膨、镍钛支架治疗医学难治性颅内动脉粥样硬化性狭窄的Wingspan 研究(a novel,self-expanding,nitinol stent in medically refractory intracranial atherosclerotic stenoses: the Wingspan study; 多中心、队列)、支架置入治疗症状性椎动脉或颅内动脉粥样硬化性病变(stenting of symptomatic atherosclerotic lesions in the vertebral or intracranial arteries, SSYLVIA)研究(多中心、队列)、Apollo 支架置入治疗症状性颅内动脉粥样硬化性狭窄(Apollo stent for symptomatic atherosclerotic intracranial stenosis, ASSIST)研究(单中心、队列)术后30 d 内的卒中发生率分别为4. 5%、6. 6%、6. 5%。而支架联合强化药物治疗预防颅内动脉狭窄卒中复发(stenting andaggressive medical management for preventing recurrent stroke in intracranial stenosis,SAMMPRIS)试验由于其围手术期支架治疗组较药物组具有明显高的卒中并发症发生率(14. 7% 比5.8%)而被提前终止。Vitesse颅内支架治疗缺血性卒中研究(the Vitesse intracranial stent study for ischemic therapy, VISSIT;多中心、随机对照)术后30 d 内球囊扩张支架组较药物组有更高的再发卒中率(24. 1% 比9.4%)。2022 年中国血管成形及支架置入术治疗症状性重度颅内动脉狭窄(the China angioplasty and stenting for symptomatic intracranial severe stenosis,CASSISS)研究中药物联合支架组较单纯药物治疗组在再发卒中预防方面也无明显优势(8. 0% 比7. 2%,P =0.82)。SAMMPRIS研究结果显示穿支动脉闭塞是术后发生卒中的重要原因。而SAMMPRIS、CASSISS、VISSIT、ASSIST研究中均将颅内大血管作为一个整体来研究,并未区分是否富含穿支动脉,可能是导致试验失败的原因之一。
本研究回顾性分析单中心接受颅内动脉狭窄支架置入术治疗的ICAS 患者,收集围手术期的卒中事件及相关危险因素,分析穿支动脉对于手术安全性的影响,以期对未来手术适应证提出建设性意见。
1 对象与方法
1. 1 对象
本研究为回顾性病例序列研究。检索空军军医大学第二附属医院神经外科血管病数据库,回顾性分析2017年1 月至2021 年12 月所有接受支架置入术治疗的症状性ICAS(经DSA 证实狭窄率为70% ~ 99%,诊断符合SAMMPRIS研究标准)患者。本研究方案已经获得空军军医大学第二附属医院医学伦理委员会批准(伦理审批号:TDLL-第202301-04号)。参与研究的患者或其家属均签署了诊疗知情同意书。
1. 2 纳入与排除标准
纳入标准:(1)年龄>18 ~< 80 周岁;(2)DSA证实狭窄程度70% ~ 99%,且接受颅内动脉狭窄支架置入术的患者;(3)具备至少一项动脉粥样硬化性狭窄的危险因素,如高血压病、糖尿病、吸烟、高脂血症、冠心病等;(4)责任病变导致的频发短暂性脑缺血发作或脑梗死患者,脑梗死患者手术时机为发病2 周之后;(5)病变经过严格的抗血小板聚集药物等治疗仍然出现症状,或者存在明确的低血流动力学症状和证据;(6)术前改良Rankin 量表(mRS)评分≤2分。
排除标准:(1)临床、实验室、影像学检查不支持动脉粥样硬化性狭窄,如烟雾病、动脉夹层等;(2)同时合并心房颤动、二尖瓣狭窄、人工瓣膜、发病6周以内的心肌梗死、心室壁瘤、细菌性心内膜炎等心脏疾病;(3)合并颅内动脉瘤或出血性疾病;(4)排除术前穿支血管梗死。
1. 3 资料收集及分组
由2名经验丰富的神经介入医师从军卫2号病例系统检索患者的人口学特征(性别、年龄)、危险因素(体质量指数、高血压病、糖尿病、高脂血症、冠心病、吸烟等)、临床表现(脑梗死、短暂性脑缺血发作)、病变位置(富穿支动脉、少穿支动脉)及影像学资料(头部MRI、CT、CT灌注、MR灌注、DSA、CT血管成像)等,记录患者ICAS 支架置入入院时、术后即刻及术后30 d mRS评分和美国国立卫生研究院卒中量表(NIHSS)评分。
高血压病为既往有高血压病,正在使用降压药物,或本次入院后不同时间测量血压,至少2次收缩压> 140 mmHg和(或)舒张压> 90 mmHg;糖尿病为既往有糖尿病,正在使用降血糖药物,或本次入院快速空腹血糖>7. 0 mmol / L,或随机血糖> 11. 1 mmol / L;吸烟为发病前吸烟10 支/ d,持续6 个月以上;脑梗死为既往诊断明确或有影像学证据支撑的卒中;将低密度脂蛋白水平≥ 3. 4 mmol / L 诊断为高脂血症。冠心病为既往诊断明确或入院后有明确胸痛、胸闷等症状经过影像学证实的心脏病。短暂性脑缺血发作是由局灶性脑缺血引起的短暂性神经功能障碍,至少持续10 min,但在24 h内消失;基底动脉及大脑中动脉M1 段为富穿支动脉,颈动脉及椎动脉颅内段为少穿支动脉。依据穿支动脉情况,将患者分为富穿支动脉组和少穿支动脉组,并进行组间各资料的单因素分析。
1. 4 术前检查及管理
所有患者术前常规头部MR 扩散加权成像和CT灌注成像检查,确定手术时机和手术策略。具有禁忌证如体内金属置入物,以头部CT替代头部MR扩散加权成像。所有患者术前行双联抗血小板聚集药物治疗(阿司匹林100 mg、氯吡格雷75 mg)至少5 d,应用血栓弹力图检测是否达标,对氯吡格雷抵抗者改用替格瑞洛(45 mg /次,2次/ d),对阿司匹林抵抗或过敏者更换为吲哚布芬(100 mg /次,2 次/ d),并根据血栓弹力图调整药物用量。应用阿托伐他汀(20 ~80 mg / d)强化降脂,将低密度脂蛋白水平控制于< 1. 8 mmol / L。控制收缩压< 140 mmHg(合并糖尿病患者,收缩压<130 mmHg),舒张压< 90 mmHg。
1. 5 手术过程
支架置入过程均在全身麻醉下进行。Seldinger法穿刺股动脉,常规置入6 F及6 F导引导管,迂曲病变应用8 F短鞘、6 F长鞘及中间导管,路途引导下,微导丝[Synchro-2(Stryker,美国)或ASHKI(ASAHIINTECC,日本)0. 014 英寸(0. 356 mm)]根据球囊情况选择2 m或者3 m长度,特殊病变需要应用动脉瘤微导管[Excelsior SL-10(Stryker,美国)、Echelon-10(EV3,美国)或Headway-17(MicroVention,美国)]通过病变确定真腔。应用颅内扩张球囊[Gateway(Boston,美国)、Monorail (Boston,美国)、玮通(心玮医疗,中国)或赛诺(赛诺神畅,中国)]对病变进行扩张。球囊直径为病变远端正常血管管径的80% ~ 100%(根据病变形态以及CT灌注成像检查结果确定)。球囊扩张后应用自膨支架[Wingspan(Stryker,美国)、Enterprise (Codman,美国)、Neuroform-EZ (Stryker,美国)、Solitair(Medtronic,美国)],部分患者直接应用颅内球囊扩张支架[Apollo(微创神通中国)]。支架直径略大于病变近端血管正常管径0. 5 ~ 1. 0 mm,长度覆盖病变两端至少3 mm。术后常规行Dyna CT检查以排除颅内出血。
1. 6 术后管理及短期内随访
术后控制收缩压维持在120 mmHg以下至少24 h,必要时给予镇静、镇痛处理。按术前方案继续服用抗血小板聚集药物,控制高血压、高脂血症、高血糖策略如术前。在条件允许下,术后24 ~ 48 h常规复查头部MR扩散加权成像和CT灌注成像,以明确出血、新发梗死、颅内灌注改善情况。患者术后4 ~6 d计划出院,收集影像资料并在术后30 d时对患者或其家属进行电话随访,并将随访结果记录在案。
1. 7 终点事件
主要事件:(1)ICAS介入治疗围手术期病变相关卒中发生率,包括手术相关和非手术相关卒中,手术相关卒中为因手术操作如术中导丝穿孔、球囊扩张致动脉夹层、血管破裂,支架置入致斑块逃逸等,而导致患者术后新发卒中或原有症状加重;次要事件:围手术期不良事件。
1. 8 统计学分析
应用SPSS 25. 0软件分析数据。连续变量采用P-P图进行正态性检验,符合正态分布的计量资料以x- ± s表示,组间比较采用t检验;偏态资料以中位数及四分位数[M(P25,P75)]表示,组间比较采用Mann-Whitney U检验。分类变量以例数和百分比表示,组间比较根据使用条件采用χ2 检验、校正χ2 检验或Fisher确切概率法。将单因素分析中P < 0.1的因素纳入多因素Logistic回归分析中,分析影响术后卒中发生的因素。以P < 0. 05为差异有统计学意义。
2 结果
2. 1 基本资料
共纳入196 例ICAS 患者,其中男140 例(71.4%),女56例(28. 6%);年龄29 ~ 80 岁,平均(58 ± 9)岁;高血压病132 例(67.3%),糖尿病60 例(30. 6%),高脂血症120 例(61. 2%),吸烟史100例(51. 0%),冠心病24例(12. 2%);症状为脑梗死129例(65. 8%),短暂性脑缺血发作67 例(34. 2%);入院时mRS评分0 ~ 4 分,中位数评分0(0,0)分,NIHSS 评分0~ 11分,中位数评分0(0,0)分;病变部位:颈内动脉颅内段50 例,椎动脉颅内段50 例,大脑中动脉M1段54例,基底动脉42 例;发病至手术时间为6 ~ 270 d,中位时间为35(24,60)d;术前狭窄率为70% ~ 99%,平均(85 ±9)%。
2. 2 手术结果
所有患者成功完成支架置入,术后平均残余狭窄率为(15±8)%。共应用196枚支架,其中Wingspan支架121 枚(61.7%), Neuroform-EZ 支架23 枚(11.7%), Enterprise 支架29 枚(14.8%),Solitaire支架3枚(1.5%),Apollo支架20枚(10.2%)。
2. 3 术后30 d内卒中
术后30 d内,发生出血性卒中6 例(3. 1%),缺血性卒中6(3. 1%)例,共12例(6. 1%)。出血患者中,2例发生于基底动脉狭窄术后,其中1例桥脑出血,术后1 个月随访时死亡;1 例左侧颞叶、右侧基底节区出血并破入脑室,行侧脑室穿刺引流术,支架置入术后1 个月随访,患者遗留失语、左侧肢体偏瘫。大脑中动脉M1段术后2例出血,其中1例基底节区出血破入脑室,行侧脑室穿刺引流,最后转归死亡;1例双额叶右侧硬膜下血肿并脑室铸型,行血肿清除去骨瓣减压术,支架置入术后1个月随访时遗留左侧肢体偏瘫。颈内动脉颅内段狭窄术后出血2 例,其中1例为同侧基底节、颞叶出血,药物对症治疗后神经功能明显恢复,支架置入术后1 个月随访时未留后遗症;另外1例为同侧额叶出血,行开颅血肿清除去骨瓣减压术,支架置入术后1个月随访,患者意识清醒,遗留左侧肢体偏瘫。见表1。
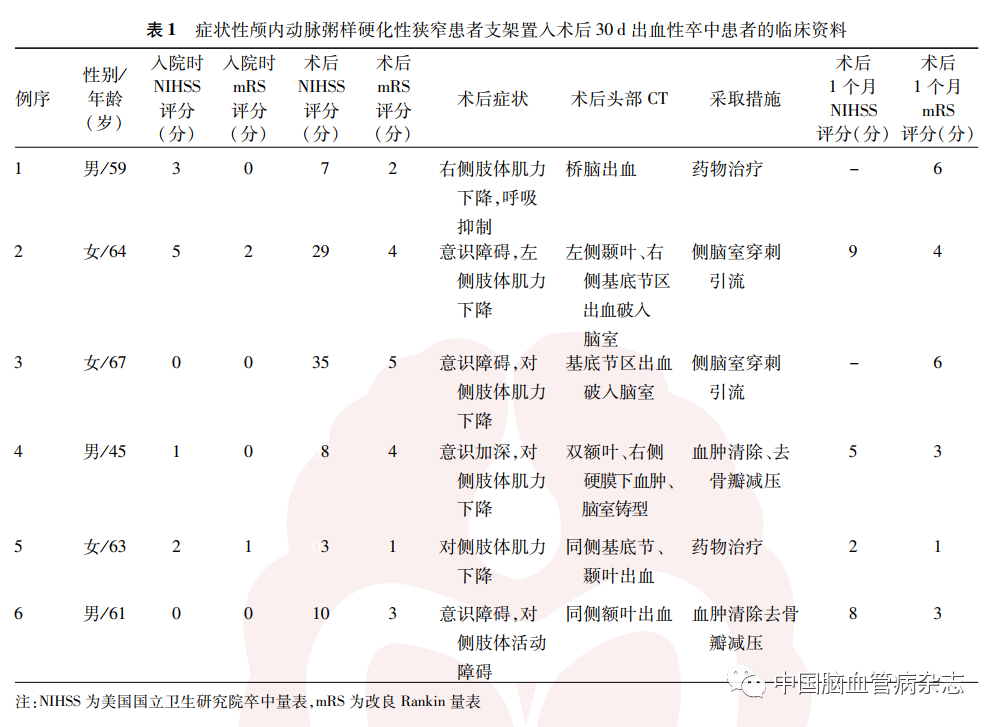
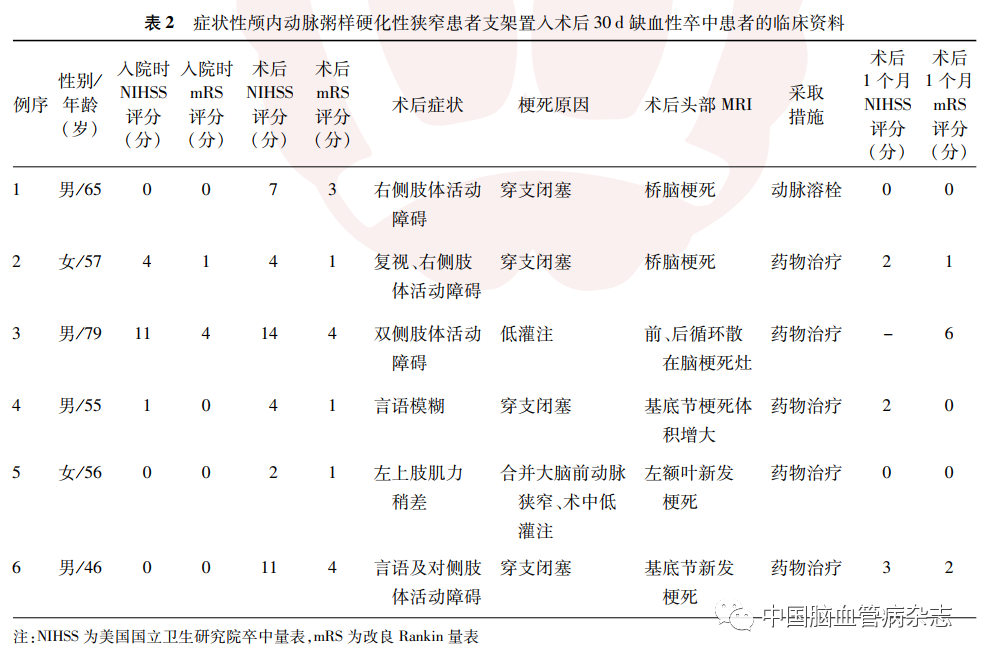
术后发生缺血性卒中的6 例患者中,基底动脉狭窄术后缺血性卒中3 例,其中2 例为脑干穿支血管闭塞性梗死,1 例为前、后循环散在梗死灶,因消化道出血最后死亡;大脑中动脉狭窄术后缺血性卒中3 例,其中2 例基底节梗死,考虑穿支血管闭塞,1 例合并大脑前动脉狭窄,术中、术后低灌注出现额叶新发梗死。见表2。
2. 4 富穿支动脉组与少穿支动脉组患者临床资料比较
富穿支动脉组与少穿支动脉组之间的基线特征差异均无统计学意义(均P>0.05)。富穿支动脉组围手术期卒中发生率明显高于少穿支动脉组,差异有统计学意义(P<0.05)。见表3。

2. 5 支架置入术后卒中发生的影响因素分析
12例术后卒中患者中,男7例;年龄45 ~79岁,平均(60 ±9)岁;既往史中,高血压病10例,高脂血症5例,糖尿病6例,吸烟史2例,冠心病0例,脑梗死9 例;体质量指数19. 40 ~ 27.68 kg / m2,平均(23. 6 ±2. 8)kg / m2;末次发病时间11 ~ 72 d,中位数时间34.5(18. 0,44. 5)d;入院时NIHSS评分0 ~ 11分,中位数评分0(0. 5,3. 5)分;入院时mRS评分0 ~ 4分,中位数评分0(0,1)分;富穿支动脉10例。
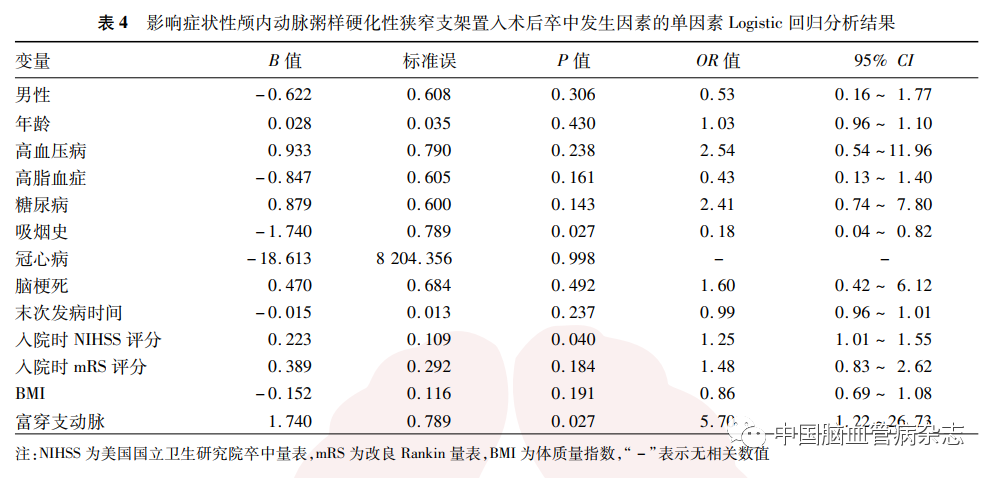
2. 5. 1 单因素分析:以术后卒中为应变量,以性别(男性= 1,女性= 0)、年龄、高血压病(是= 1,否=0)、糖尿病(是= 1,否= 0)、高脂血症(是= 1,否=0)、吸烟史(是=1,否=0)、冠心病(是=1,否=0)、脑梗死(脑梗死= 1,短暂性脑缺血发作=0)、末次发病时间、入院时NIHSS评分、入院时mRS评分、体质量指数及富穿支动脉(富穿支动脉= 1,少穿支动脉= 0)为自变量进行单因素Logistic回归分析,结果显示,性别、年龄、高血压病、糖尿病、高脂血症、冠心病、脑梗死、短暂性脑缺血发作、末次发病时间、入院时mRS评分、体质量指数术后卒中发生风险差异均无统计学意义(均P > 0. 05);相对于少穿支动脉患者,富穿支动脉术后卒中发生风险增加,差异有统计学意义(OR= 5.70,95% CI:1. 22 ~ 26.73, P =0.027);吸烟患者较不吸烟患者术后具有较低的卒中发生率,差异具有统计学意义(OR =0.18,95% CI:0. 04 ~ 0. 82,P = 0.027); 入院时NIHSS评分越高,术后发生卒中的概率越高(OR=1.25,95% CI:1. 01 ~ 1. 55,P = 0.040)。见表4。
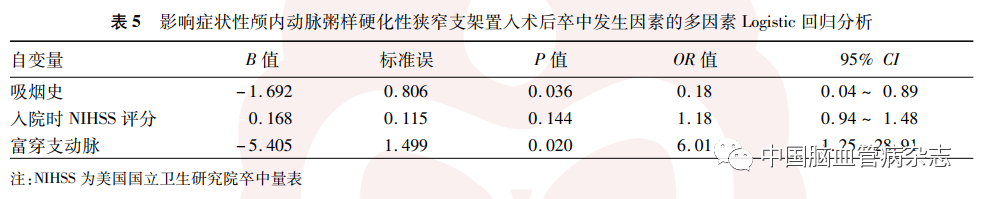
2. 5. 2 多因素分析:将表4 中P < 0. 1 的影响因素纳入多因素Logistic回归分析,结果显示,穿支动脉(OR = 6. 01,95% CI:1. 25 ~ 28. 91,P = 0. 020)和吸烟(OR = 0.18,95% CI:0. 04 ~ 0. 89,P = 0. 036)是术后发生卒中的独立影响因素,富穿支动脉是支架置入术后发生卒中的独立危险因素。见表5。
3 讨论
SAMMPRIS、VISSIT以及最近的CASSISS研究均未能证明支架联合药物治疗对比单纯药物治疗ICAS存在优势。围手术期较高的卒中发生率是主要原因之一。本研究报道了真实世界中颅内动脉狭窄支架置入术后30 d 内并发症发生情况,近5 年196 例ICAS(狭窄率70% ~ 99%)患者支架置入术后30 d内总体卒中发生率为6. 1%(12 / 196),低于SAMMPRIS 14. 7% 、VISSIT 24. 1% ,与CASSISS研究及Miao等、Jiang等、Nordmeyer等研究报道的4. 4% ~6. 2%相似。并发症发生率较低的可能原因有:(1)与本中心的患者数量和术者的经验有关。本中心至少连续10 年每年颅内动脉狭窄手术量为60 ~ 80 例,且术者每年完成其他介入治疗量超过200 例,均为经验丰富的神经介入医师。(2)对患者的筛选,即适应证标准的把握。卒中的发病机制包括脑血流低灌注、原位血栓形成、栓子脱落、穿支血管闭塞等。本中心筛选病例时,首先排除了穿支动脉闭塞所致的卒中,可能会减少术后该类卒中的发生,类似卒中在SAMMPRIS研究分析中占比14. 3%,CASSISS研究入组病例同样排除穿支动脉闭塞。本中心从2012 年始通过头部CT灌注成像检查来筛选出脑血流灌注不足的患者进行支架置入术,而此类患者通过药物治疗并不能解决其脑血流灌注不足的问题,因而应更积极地采取支架置入手术治疗。对原位血栓形成和栓子脱落所致卒中患者首选药物治疗,接近半数的患者药物治疗效果良好,因而避免了支架置入。(3)手术时机偏晚,本研究中患者发病至手术的中位数时间为35(24,60)d,远大于SAMMPRIS 中的7(7,19)d。美国国立卫生研究院Wingspan注册研究显示,卒中事件发生10 d以内行支架置入术的术后30 d卒中事件发生率较10 d以后行支架置入术的术后30 d卒中事件发生率具有增加趋势(17%比8%)。
本研究将ICAS分为富穿支动脉组和少穿支动脉组进行研究,两组之间的基线资料差异无统计学意义。通过单因素及多因素分析,穿支动脉是ICAS支架术后卒中的独立影响因素。富穿支动脉组6例缺血事件中,4例是因为穿支动脉闭塞,2例为术中、术后低灌注。而少穿支动脉组无缺血性卒中事件发生。这可能是由于大脑中动脉和基底动脉富含穿支动脉,在球囊扩张及支架置入过程中由于斑块的移位或“雪犁效应”易致穿支动脉闭塞,且脑干及基底节为脑部重要的功能区,尤其是脑干,即使很小体积的梗死,也可能会给患者带来严重的结果,同样的结果见于同期报道。与此不同的是,颈动脉及椎动脉颅内段由于穿支动脉较少,而且穿支动脉管径较粗,不易因斑块移位或“雪犁效应”而闭塞。根据此项研究结果,将颅内动脉狭窄依据穿支动脉情况分组后采取的治疗策略,或许是颅内动脉狭窄的最佳治疗方案。CASSISS研究的亚组分析即将出炉,或许可以进一步验证这个答案。
SAMMPRIS中,术后30 d内,非吸烟患者卒中发生率(18. 1%)高于吸烟患者(4. 7%),这与本研究中多因素分析的结果一致。考虑可能原因,一是非吸烟患者中具有较高比例的高脂血症(50%)、糖尿病(60%)、高血压病(90%),这很有可能增加了围手术期并发症的发生率;二是吸烟会诱导肝细胞色素P450系统,该系统参与氯吡格雷向其活性代谢物的转化,因此吸烟者往往较非吸烟者对氯吡格雷更敏感。
本研究中有5 例为术后高灌注出血,这可能与术前高狭窄率(85 ± 9)%、低代偿有关系。一旦支架置入术完成以后,除了降压之外无特别有效的办法来预防术后高灌注出血的发生,因此,如何在术前筛选出这部分患者是预防术后出血性卒中发生的关键,然后再根据这部分患者病变特点采取不同手术策略,如高残留狭窄、单纯球囊扩张、分期手术等措施。因此,脑灌注检查应该作为术前筛选患者的常规方法,也是术后预防高灌注出血的一个重要依据。
4 结论
ICAS支架置入术围手术期较高的卒中发生率仍然是不可忽视的问题,对于药物难治性,尤其伴有灌注损伤的患者,支架置入应该作为一项治疗选择。对于基底动脉和大脑中动脉M1 段狭窄病变,因其管壁相对较薄且富含穿支动脉,支架置入围手术期卒中发生率较高,在选择治疗方案时应慎重考虑手术治疗,而颈动脉和椎动脉颅内段支架置入围手术期具有较低的卒中发生率,在选择治疗方案时可以考虑相对积极的支架置入治疗。此外,吸烟也是围手术期卒中发生的影响因素。


