eGastroenterology:自噬在胰腺炎中的作用
时间:2024-06-01 06:00:21 热度:37.1℃ 作者:网络
导 读
近年来,胰腺炎的研究取得了重大进展,尤其是在自噬机制及其在胰腺炎发病过程中的作用方面。针对这一关键性问题,eGastroenterology特邀来自美国堪萨斯大学医学中心药理学、毒理学和治疗学系专家丁文兴教授撰写题为“Recent insights about autophagy in pancreatitis”的综述文章。本文将探讨近期关于胰腺炎自噬相关的研究,并讨论其对胰腺健康的重要性。

急性胰腺炎是一种常见的消化疾病,在发达国家的年发病率为34例/10万人。该疾病的特征是腺泡细胞坏死增加,随后出现局部和全身性炎症反应,并具有多变的临床过程。胆石症和饮酒是急性胰腺炎最常见的原因,其他风险因素包括高甘油三酯血症、高钙血症、病毒感染、遗传和自身免疫疾病。
胰腺外分泌腺泡细胞具有高蛋白质合成率,用于生产、储存和分泌大量消化酶。为了满足蛋白质合成和运输的高需求,腺泡细胞富含内质网和其他细胞器,包括线粒体、分泌小泡、内涵体、自噬和溶酶体。内质网稳态的失调会导致内质网压力和腺泡细胞损伤,进而引发胰腺炎。细胞利用诸如自噬的保护机制来平衡细胞器的稳态,使内质网和线粒体适应并保护自己免受内质网压力和线粒体损伤。
细胞和分子的自噬现象
自噬是一种细胞降解过程,将多余或受损的细胞成分运送到溶酶体,这是一个进化保守的过程。自噬降解蛋白质、脂质和细胞器,例如多余的内质网、核糖体和受损的线粒体。自噬主要有三种类型:巨自噬、微自噬和伴侣介导的自噬(chaperone-mediated autophagy,CMA),它们在货物运送到溶酶体的方式上有所不同。
目前已鉴定出40多种自噬相关(autophagy-related,ATG)蛋白,它们调节自噬的六个关键步骤。
(1)自噬的启动
自噬体形成的启动由ULK(uncoordinated 51-like kinase)复合物调节,ULK复合物由ULK1(或ULK2)、FIP200、ATG13和ATG101组成。
(2)自噬体膜生物合成
第二个自噬特异的激酶复合体,PIK3C3复合体I(PIK3C3-CI),由Vps34、Beclin-1、VPS15和ATG14L组成。
(3)自噬体膜的扩展和延伸
自噬体膜的扩展需要脂质输送。ATG2A和VPS13家族蛋白是两种具有高容量脂质结合表面的脂质运输蛋白。
(4)自噬体的关闭和成熟
随着自噬体膜的扩展,最终会包裹货物并从内质网分离,形成一个独立的自噬体。ESCRT机制在调节吞噬泡关闭中起着重要作用,CHMP2A是ESCRT-III的一个组成部分,是自噬体关闭所必需的。
(5)自噬体与溶酶体的融合
自噬体与溶酶体融合形成自噬溶酶体。溶酶体负责使用酸性水解酶降解封闭的内容物。SNARE家族蛋白(如VAMP7、VAMP8、SNAP29和STX17)促进了这种融合过程。
(6)自噬的终止和溶酶体的生成
在自噬完成后,通过自噬溶酶体再生过程重新形成溶酶体。TFEB是一个主导溶酶体生物合成的转录因子,调控着响应各种组织和细胞中自噬降解需求的基因表达。
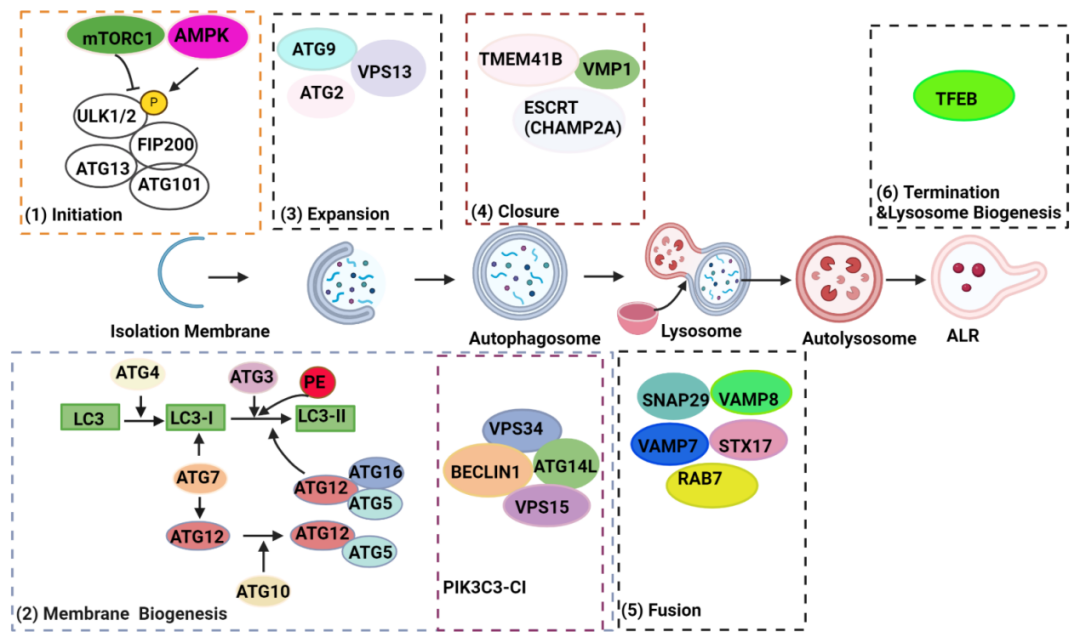
图注:哺乳动物细胞自噬机制示意图。营养缺乏会抑制mTORC1并激活AMPK,后者随即在不同位点对ULK1进行去磷酸化或磷酸化,从而激活ULK复合物并启动隔离膜(吞噬泡)的形成。激活的ULK复合物将PIK3C3复合物I(PIK3C3-CI)募集到自噬体的起始位点,产生信号分子磷脂酰肌醇3-磷酸以促进吞噬泡膜的生物合成。同时,两种泛素样结合系统,ATG7–ATG3–ATG8/微管相关蛋白1A/1B-轻链3(LC3)和ATG12–ATG5–ATG16L1复合物,将胞质形式LC3(称为 LC3-I)与磷脂酰乙醇胺(PE)结合,形成自噬体膜锚定LC3-II。通过从供体来源提供的膜,ATG9介导的循环系统(包括核心蛋白ATG9、ATG2、VPS13D和WIPI1/2)促进吞噬泡的伸长。当延伸的吞噬泡闭合时,成熟的自噬体将形成,由ESCRT蛋白CHAMP2A和ER跨膜蛋白VMP1和TMEM41B介导。自噬体最终在STX17–VAMP7/8–SNAP29复合物和GTPase RAB7及复合物HOPS的介导下与溶酶体融合,导致自噬溶酶体内的货物降解。然后,自噬溶酶体在TFEB的介导下进行ALR和溶酶体生物合成。ALR,autophagic lysosome reformation,自噬溶酶体重组;ER,endoplasmic reticulum,内质网;ESCRT,endosomal sorting complexes required for transport,运输所需的内体分选复合物;TFEB,transcription factor EB,转录因子EB。
来源:原文图1
胰腺炎中的细胞器应激和自噬
■ 胰腺生理学
胰腺是一个复杂的代谢器官,具有内分泌和外分泌功能。内分泌胰腺只占胰腺质量的2%,通过分散在胰腺实质中的胰岛细胞簇(Langerhans,郎格汉斯岛)调节血糖稳态。外分泌胰腺占胰腺质量的95%-98%,是胰腺炎的主要诱因。胰腺腺泡细胞高度极化,具有明显的基底侧膜和顶膜。在基底侧膜附近存在丰富的内质网(endoplasmic reticulum,ER),而在顶膜附近则聚集着含有胰蛋白酶原的酶原颗粒(zymogen granule,ZG)。餐后,ZG的内容物被分泌到胰管中,并在十二指肠中由肠肽酶激活为胰蛋白酶,用于蛋白质消化。
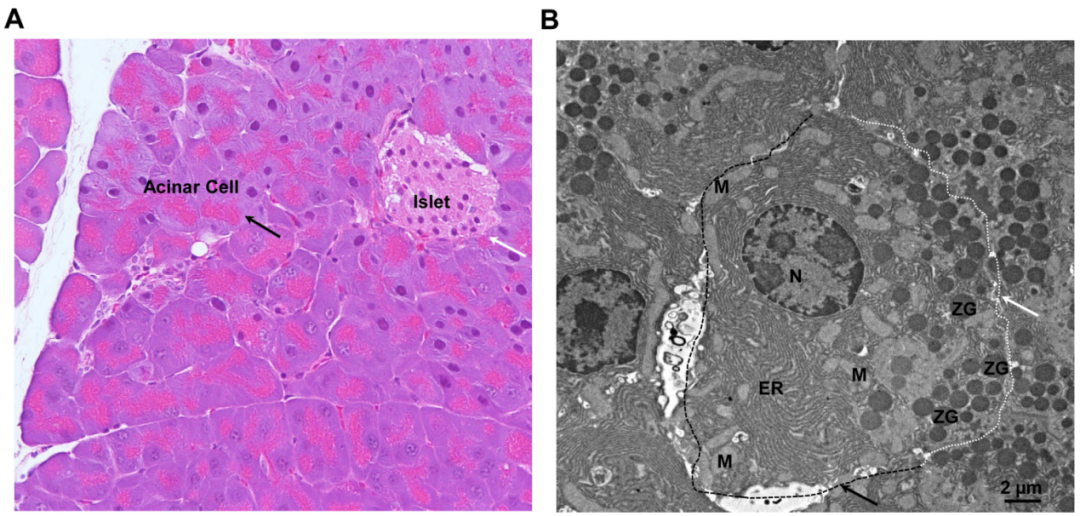
图注:内分泌和外分泌胰腺的组织学以及外分泌腺泡细胞的超微结构。(A)小鼠胰腺的代表性H&E染色图像。黑色箭头表示腺泡细胞,白色箭头表示胰岛。(B)小鼠胰腺腺泡细胞的代表性电子显微镜分析图像。白色虚线和箭头表示顶端膜。黑色虚线和箭头表示基底侧膜。ER,endoplasmic reticulum,内质网;M,mitochondria,线粒体;N,nucleus,细胞核;ZG,zymogen granule,酶原颗粒。
来源:原文图2
胰腺炎的病理机制传统上认为是由于腺泡细胞内胰蛋白酶原的过早激活,导致腺泡细胞的“自我消化”、坏死和随后胰腺的炎症。这一假设基于两个关键前提:胰腺中的胰蛋白酶原在胰腺炎早期被过早激活,以及这些病理激活的酶负责“自我消化胰腺”,导致腺泡细胞坏死和胰腺炎的发展。胰蛋白酶1(PRSS1)和胰蛋白酶抑制剂基因(SPINK1)的基因突变与遗传性胰腺炎相关。PRSS1基因编码阳离子胰蛋白酶原,其大多数变体在胰腺内过早将胰蛋白酶原转化为胰蛋白酶,而其他变体则防止胰蛋白酶的降解。SPINK1编码一种胰蛋白酶抑制剂,可抑制20%的胰蛋白酶活性,在胰腺腺泡细胞中表达并与活化的胰蛋白酶结合。在常染色体隐性遗传的背景下,SPINK1可能通过促进胰蛋白酶原的过早激活导致慢性胰腺炎。
最近的研究挑战了胰蛋白酶原激活是胰腺炎主要原因的传统观点。研究表明,慢性胰腺炎的发展可能与胰蛋白酶原激活无关。进一步应确定在各种动物或临床胰腺炎模型中,腺泡细胞内胰蛋白酶激活是否是胰腺炎(包括急性和慢性)病理发生的前提。
腺泡细胞损伤被认为是急性胰腺炎的主要触发因素。胰腺腺泡细胞的主要功能是合成、运输、储存和分泌消化酶。为了完成这些任务,多个细胞器(如ER、线粒体、高尔基体、内溶酶系统和自噬系统)必须协同工作。
■ ER稳态和ER应激
产生酶原的腺泡细胞由于蛋白质错误折叠的风险很高,容易受到ER应激。为了应对这种情况,腺泡细胞使用未折叠蛋白反应(unfolded protein response,UPR)来恢复细胞稳态。UPR有三个功能分支:IRE1α-XBP1s、PERK-eIF2α-ATF4和ATF6轴,这些分支介导ER应激诱导基因的转录。如果UPR不足以缓解ER应激,ER应激可能会进一步激活与ER相关的蛋白酶体降解(ER-associated proteasomal degradation,ERAD)或自噬降解作为另一层适应反应。适应ER应激的失败可能导致腺泡细胞死亡,从而引发胰腺炎。因此,UPR和自噬可以作为维持胰腺外分泌系统中蛋白质稳态的适应过程。
ER是细胞内Ca2+的主要存储位点。在实验性胰腺炎中,超生理剂量的胰泌素会增加细胞内Ca2+,导致线粒体损伤、胰蛋白酶原的过早激活和NFκB的激活。丧失胰腺的VMP1会导致ER应激,从而促进酒精诱导或自发性胰腺炎的发展。
■ 线粒体损伤
在各种急性实验性胰腺炎中,线粒体去极化是一个早期且普遍的事件。这与线粒体钙超载相关的线粒体通透性转变孔(mitochondrial permeability transition pore,MPTP)的激活同时发生。环孢菌素D的遗传缺失或MPTP的药理学抑制有效保护了各种实验性胰腺炎,这是通过改善ER应激和自噬通量实现的。这表明线粒体可能与其他细胞器和自噬相互作用,以调节腺泡细胞功能并防止腺泡细胞损伤。
■ 溶酶体功能障碍和胰腺炎中的自噬受损
胰腺炎是一种由于胰腺外分泌腺泡细胞损伤而引起的炎症性疾病。腺泡细胞具有巨大的蛋白质合成、运输和储存能力,因此,适当调节这些过程对于维持腺泡细胞功能至关重要。自噬在蛋白质和细胞器质量控制中的重要性使得自噬受损对腺泡细胞来说是有害的。实际上,大空泡的积累已被长期认为是实验性和人类胰腺炎的典型表型。这些大空泡在腺泡细胞中可能是由于溶酶体和自噬功能受损所导致的。
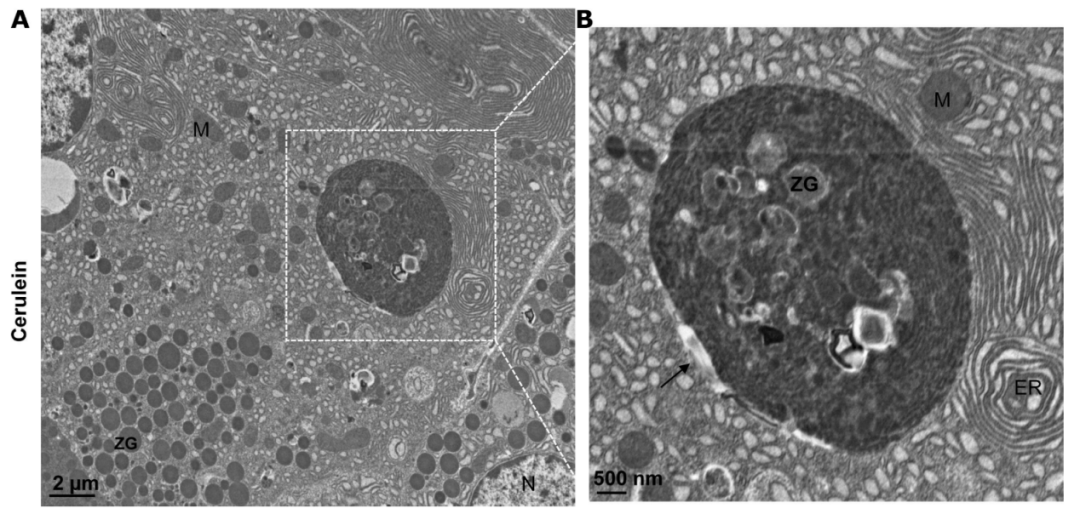
图注:急性胰腺炎组织中大空泡的电子显微镜照片。(A)用cerulein治疗诱发的小鼠急性胰腺炎组织的电子显微镜分析代表性图像。(B)从(A)中方框区域放大的照片,显示一个大的自噬空泡(黑色箭头)。ER,endoplasmic reticulum,内质网;M,mitochondria,线粒体;N,nucleus,细胞核;ZG,zymogen granule,酶原颗粒。
来源:原文图3
研究表明,大空泡通常呈现LC3(一种重要的自噬体标志物)和LAMP-1(溶酶体/自噬溶酶体标志物)阳性,这进一步支持了这些大空泡很可能是自噬溶酶体。溶酶体功能障碍的原因可能是胰腺炎实验模型中溶酶体蛋白酶的处理受损。胰腺中LAMP-1/2表达的减少也会导致实验性胰腺炎模型中的溶酶体功能障碍。由于溶酶体功能受损或溶酶体数量减少,导致的自噬不充分会使包含未降解的酶原颗粒和其他部分降解的细胞内容物的大溶酶体/自噬溶酶体的增大。
VMP1(vacuole membrane protein 1)是ER中的多跨膜蛋白,通过促进自噬体关闭调节自噬。此外,VMP1还通过调节磷脂翻转酶活性影响细胞内胆固醇和磷脂丝氨酸的分布。研究发现,VMP1在胰蛋白酶原诱导的胰腺炎中与p62介导的选择性自噬相互作用,移除受损的酶原颗粒,以防止细胞内胰蛋白酶原的过早激活。自噬体形成的早期生物合成和自噬体与溶酶体融合的后期降解阶段的膜融合主要由SNARE蛋白介导。在胰腺炎实验模型中,SNARE蛋白如STX17、VAMP8和SNAP29在自噬体与溶酶体的融合过程中起着重要作用。
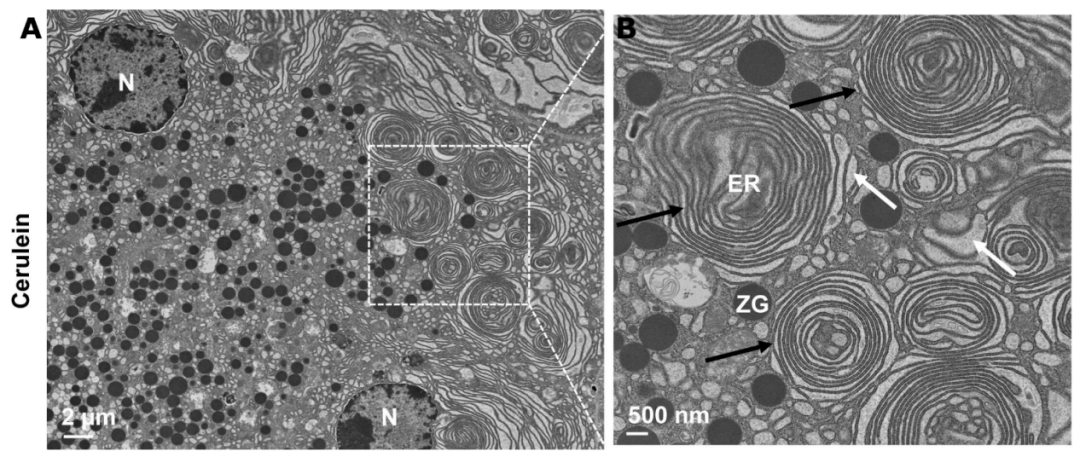
图注:急性胰腺炎组织中异常ER结构的电子显微镜照片。(A)用 cerulein 治疗诱发的小鼠急性胰腺炎组织的电子显微镜分析代表性图像。(B)从(A)中方框区域放大的照片,显示异常ER结构(黑色箭头)和ER扩张(白色箭头)。ER,endoplasmic reticulum,内质网;M,mitochondria,线粒体;N,nucleus,细胞核;ZG,zymogen granule,酶原颗粒。
来源:原文图4
基因敲除Atg5、Atg7或Tfeb的小鼠胰腺会导致自发性胰腺炎,表明自噬在胰腺炎中的重要性。自噬受损的另一个直接联系来自于基因敲除小鼠模型,包括敲除Atg5或Atg7、溶酶体相关膜蛋白2(Lamp-2)以及最近的Vmp1。这些小鼠都表现出自发性胰腺炎,表明不同的自噬阶段(如早期自噬体形成与晚期自噬体关闭)或这些蛋白质的非自噬功能可能对腺泡细胞功能产生不同影响。
此外,非典型自噬也可在无需形成LC3-II靶向单层膜泡或内溶酶体系统的区室的双层膜自噬体的情况下发生。在胰腺炎模型中,RAB9水平下降,过表达RAB9会将典型自噬转变为非典型自噬,恶化胰腺炎。尽管实验胰腺炎研究显示出增加的LC3-阳性单层膜内吞泡,但其在胰腺炎中的因果角色仍需进一步研究。
■ 酒精相关性胰腺炎
酒精相关性胰腺炎是酒精滥用的主要并发症。胰腺腺泡细胞通过氧化和非氧化途径代谢酒精。氧化途径通过酒精脱氢酶催化,生成乙醛和活性氧(reactive oxygen species,ROS),这些产物具有高度毒性。乙醛进一步被线粒体中的乙醛脱氢酶转化为乙酸。非氧化途径则由脂肪酸乙酯合成酶催化,将酒精酯化形成脂肪酸乙酯(fatty acid ethyl ester,FAEE)。FAEE以及氧化代谢产物乙醛和ROS会破坏溶酶体和酶原颗粒膜,导致胰腺炎。
酒精消耗会引起溶酶体功能障碍,导致消化酶的过早激活和腺泡细胞死亡。及时移除脆弱和有害的酶原颗粒和受损的溶酶体对于保护胰腺免受酒精诱导的损伤至关重要。研究表明,高酒精消耗会增加受损酶原颗粒的数量,并直接损害溶酶体,导致胰腺炎中大空泡的积累。
TFEB是调控溶酶体生成和自噬的关键转录因子。酒精通过影响TFEB的转录和翻译水平,导致其在胰腺中的表达减少。此外,酒精通过抑制mTOR、增加磷酸化的丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)水平来调节TFEB。胰腺特异性TFEB敲除小鼠在常规饮食下表现为轻度胰腺水肿,但在酒精饮食下表现为严重的胰腺炎症。
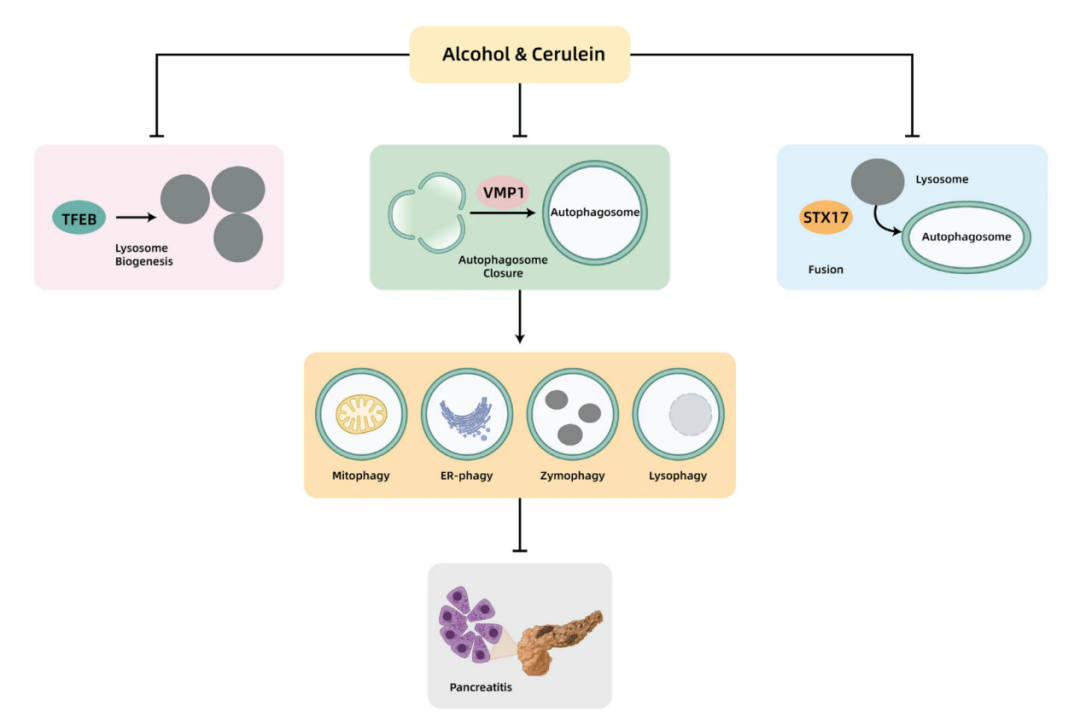
图注:图片表示了由cerulein或酒精引起的实验性急性胰腺炎中自噬受损的模型。Cerulein或酒精在多个步骤中损害自噬,从而促进胰腺炎。Cerulein或酒精降低胰腺VMP1,从而损害自噬体的闭合。Cerulein还降低STX17,从而损害自噬体与溶酶体的融合。Cerulein或酒精降低胰腺TFEB,导致溶酶体生物合成受损和自噬不足。自噬可以选择性地清除受损的线粒体(线粒体自噬)、异常的 ER(ER-自噬)、泄漏的 ZG(酶自噬)和受损的溶酶体(溶噬),以防止腺泡细胞死亡和胰腺炎。ER,endoplasmic reticulum,内质网;STX17,syntaxin 17,突触素;TFEB,transcription factor EB,转录因子EB;VMP1,vacuole membrane protein 1,液泡膜蛋白1。
来源:原文图5
未来展望
总之,自噬在胰腺腺泡细胞的健康调节中起着关键作用。它作为一种自我降解和质量控制机制,有助于移除受损或脆弱的细胞器,如酶原颗粒、线粒体、ER和溶酶体。自噬任何阶段的破坏,包括自噬体的形成、关闭或与溶酶体的融合,以及溶酶体功能和生成的障碍,都可能导致胰腺炎的发展。选择性自噬对于维持健康的腺泡细胞和防止胰腺炎至关重要。然而,是否需要特定或一般的自噬受体来调节腺泡细胞中的选择性自噬(如酶原颗粒自噬、ER自噬、线粒体自噬和溶酶体自噬)仍需进一步研究。未来的研究需要进一步明确自噬在胰腺炎中的转化价值,测试通过药理学手段增强自噬或溶酶体活动是否对治疗胰腺炎有益。这些研究将有助于开发更有效的治疗策略,改善胰腺炎患者的预后。
引证本文
Wen-Xing Ding, Xiaowen Ma, Sydney Kim, Shaogui Wang, Hong-Min Ni - Recent insights about autophagy in pancreatitis: eGastroenterology 2024;2:e100057.
https://egastroenterology.bmj.com/content/2/2/e100057


