发展变化中的癌症细胞疗法
时间:2024-06-05 20:00:48 热度:37.1℃ 作者:网络
前言
自2017年美国食品药品监督管理局(FDA)批准第一种CAR-T细胞产品以来,先后有6种CAR-T产品进入市场。今年早些时候,肿瘤浸润淋巴细胞(TIL)疗法lifileucel成为FDA批准的第一种用于实体瘤(转移性黑色素瘤)的细胞治疗产品。此外,TCR-T治疗产品afamitresgene Autoleucel可能在今年晚些时候获得批准,用于治疗晚期滑膜肉瘤。癌症细胞疗法在经历了数十年的磨砺之后,终于迎来了收获的时刻。
然而,尽管有这种变化,癌症细胞治疗领域仍面临着与细胞持久性、实体瘤有效靶向和产品制造等相关的挑战。癌症细胞疗法正经历着深刻的变化,创新和发展依然是该领域的主题。
癌症细胞治疗的临床变化
在过去的两年里,新的细胞治疗试验的数量有所减少。临床试验的数量在2021年达到峰值,此后在2022年下降了3.9%,在2023年下降了4.3%。尽管总体上有所减少,但三期试验在这两年分别增长了33.3%和43.8%,2022年至2023年的新试验总数仍超过2019年至2020年的数字。
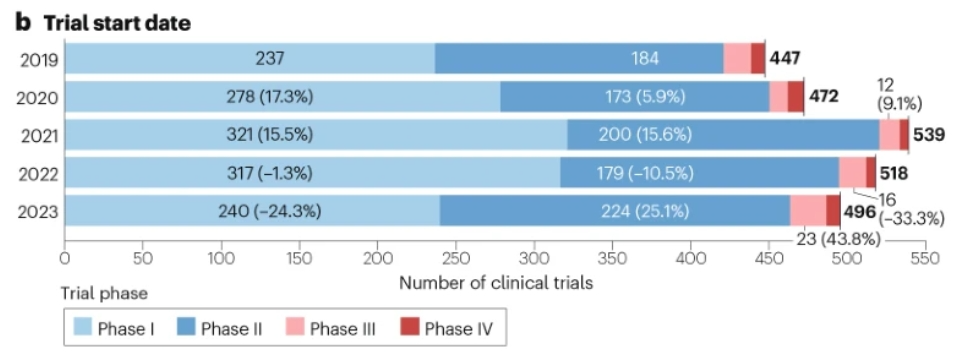
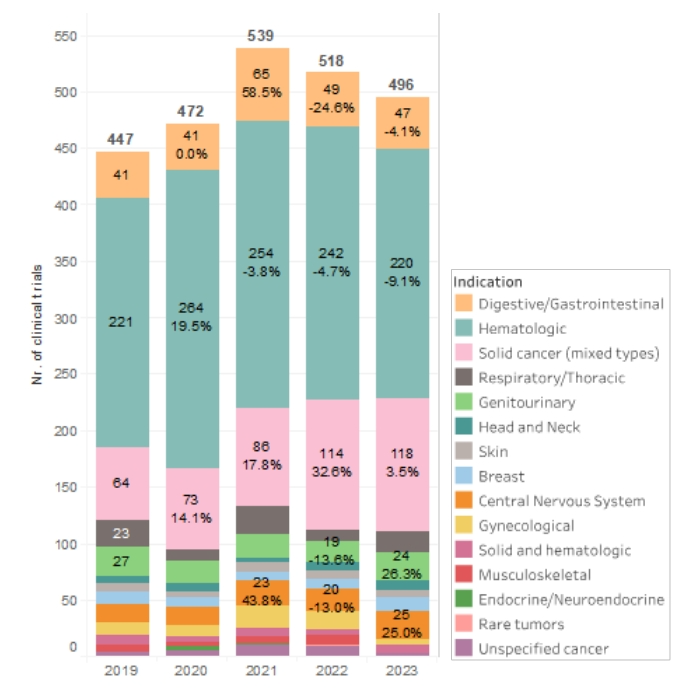
此外,细胞治疗临床研究在血液系统恶性肿瘤和胃肠道癌症中下降幅度最大,而在中枢神经系统(CNS)肿瘤(25.0%)、癌症呼吸系统(90.0%)和混合实体瘤(3.5%)试验中,细胞治疗的应用有所增加。
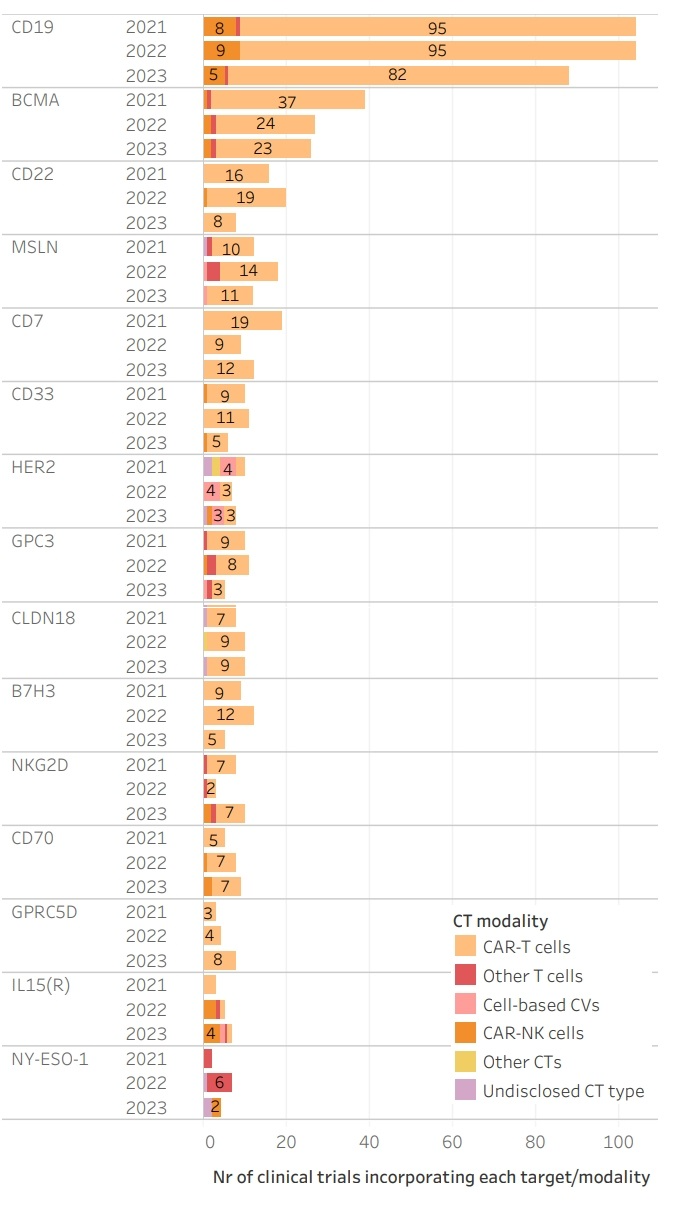
2023年,基于细胞的癌症疫苗、CAR-NK细胞和基于细菌的治疗药物相对于2022年有所增长,而CAR-T细胞和其他T细胞产品在该领域的份额减少。关于靶标,最常见的靶标仍然是CD19、BCMA和CD22,但它们在过去一年中有所减少。相比之下,其他靶标的试验增加,如CD7(33.3%)、HER2(14.3%)和NKG2D(233.3%)。
发展中的“中国CAR-T”
在过去的几年里,中国已超越美国成为CAR-T疗法临床研究的主要力量。除了CAR-T细胞治疗临床试验的大幅增长外,中国研究人员还在产品开发和临床前研究方面取得了进展,包括新靶点设计、功能增强、精确调控、通用CAR-T细胞以及不同免疫细胞源的细胞转化。此外,中国CAR-T的发展也得益于中国政府颁布的许多细胞治疗政策,包括金融支持和逐步完善的监管体系。
自2015年国务院发布《关于改革药品和医疗器械审评审批流程的意见》以来,中国生物技术行业开始快速开发CAR-T细胞产品,资本和资金不断增加。香港联交所于2018年发布了18A上市政策,允许创收前生物技术公司在满足特定条件后注册。此外,中国A股市场于2019年发布了科技创新委员会政策,并于2021发布了北京证券交易所政策,以鼓励并允许盈利前的科技公司公开上市。在这种开放政策的推动下,开发细胞治疗产品的公司看到了融资的强劲增长。2018年至2021,中国细胞治疗公司累计筹集资金23.7亿美元,年复合增长率为45%,公开宣布的金融交易109笔。
在过去的15年中,患者对临床试验的意识不断提高,患者的参与也在增加。此外,中国的研究人员一直在积极扩展CAR-T细胞的适用临床背景,包括实体瘤和肿瘤以外的疾病。CAR-T细胞疗法中最常试验的实体肿瘤包括肝癌、胰腺癌和脑癌,而非恶性疾病涵盖范围更广,包括自身免疫性疾病、传染病和POEMS综合征。具体而言,针对自身免疫性疾病的CAR-T细胞试验包括系统性红斑狼疮、硬皮病、肾炎、干燥综合征、视神经脊髓炎谱系障碍,以及针对感染性疾病的CAR-T细胞试验,包括艾滋病、慢性活动性EB病毒感染和新冠肺炎。
新一代“CAR-T”
免疫学和分子工程的进展推动了新一代CAR-T细胞治疗的发展,这些细胞武装了各种分子机制,包括额外的共刺激域、安全开关、免疫检查点调节、细胞因子表达或治疗干扰分子的敲除等。从而可以克服CAR-T疗法当前的局限性,增强疗效并减少不必要的副作用。目前,许多临床试验目前正在评估新型CAR-T疗法的安全性和有效性。
免疫检查点调节的武装CAR-T
CAR-T治疗中的免疫检查点调节旨在规避抑制性的肿瘤微环境。在血液肿瘤方面,评估该方法的所有临床试验都明确依赖于破坏程序性细胞死亡蛋白1(PD-1)途径。尽管试验数量相对较少(n=8),但个别研究显示了调节PD-1信号的独特方法。
在NCT03258047临床试验中,研究人员使用了一种创新方法,其中PD-1融合到细胞内CD28激活域。因此, PD-L1与PD-1的结合转化为激活信号,预期会产生更有效的抗肿瘤效果。该研究涉及17名患有B细胞非霍奇金淋巴瘤的受试者。结果显示,完全缓解率(CR)和客观缓解率(ORR)分别为41.2%和58.8%。
TRUCKs–表达细胞因子的CAR-T
重定向用于通用细胞因子介导杀伤的T细胞(TRUCKs)是新一代CAR-T细胞,被设计为表达某些细胞因子,以增强CAR-T细胞的抗肿瘤效力,提高其持久性,并改变肿瘤微环境的特征。目前,六项临床试验正在评估TRUCKs治疗血液系统恶性肿瘤。四项临床试验(NCT04381741、NCT03929107、NCT04833504、NCT03778346)正在评估表达IL-7和趋化因子CCL19的CAR-T细胞。IL-7促进T细胞的增殖和存活,而CCL19引导CAR-T细胞的肿瘤归巢。研究结果显示, r/r DLBCL的患者的CR率为4/7,ORR为5/7。此外,NCT03778346在r/r多发性骨髓瘤(MM)患者也探索了相同的方法,其中两名入选患者获得了CR(100%)。
安全开关的CAR-T
常规CAR-T疗法伴随的治疗相关毒性促进了安全开关CAR-T细胞的构建。新技术使研究人员能够结合安全开关,通过在给予外源药物后诱导细胞凋亡、补体依赖性细胞毒性(CDC)或抗体依赖性细胞细胞毒性(ADCC)来清除CAR-T细胞。
将截短的表皮生长因子受体(EGFRt)结合到CAR-T细胞中是临床试验中常见的安全开关方法。EGFRt被cetuximab靶向,其能够通过CDC或ADCC去除。截至2022年8月,20项临床试验正在研究多种血液系统恶性肿瘤中基于EGFRt的CAR-T细胞。目前,没有关于在人体中启动EGFRt安全开关机制的可用数据。缺乏此类报告的原因可能是调查期间没有危及生命的不良事件。
通用CAR-T
如今,传统CAR-T产品是由来自符合治疗条件的患者的自体T细胞制造的。该方法存在若干局限性,包括制造时间长、难以动员适当数量的T细胞以及严重治疗患者的T细胞质量降低。然而,利用分子工程产生异基因CAR-T细胞可以克服上述障碍。为了构建通用CAR-T,需要从供体来源的细胞中去除主要组织相容性复合物(MHC)和T细胞受体(TCR)分子。
CRISPR/Cas9技术在T细胞工程中的初步安全性和可行性已在首次人体试验NCT03399448中得到证实。截至2022年8月,在ClinicalTrials.gov上已注册了5项评估抗自相残杀CAR-T细胞的临床试验。
双靶点CAR-T
CAR-T细胞治疗后复发的主要机制在于CAR-T细胞的有限持久性、CAR-T细胞功能抑制和抗原逃逸。为了最大限度地减少因靶点逃逸而复发的风险,临床试验中正在积极探索双靶点CAR-T识别一种以上肿瘤相关抗原的策略。这种策略可以通过使用两种具有不同抗原结合特异性的混合CAR-T细胞或能够靶向两种不同抗原的单个CAR-T细胞来实现。
目前,在血液系统恶性肿瘤的临床前模型和临床试验中,双靶点CAR-T细胞治疗的抗原至少有三种组合:CD19/CD20、CD19/CD22以及BCMA/CD38。最近,双靶点CAR-T在临床上的使用越来越多,从披露的综合临床数据中,双靶点CAR-T展现出极富前景的应用价值。
小结
在过去的几年里,癌症细胞治疗领域正经历着显著的变化,新的癌症细胞治疗试验有所减少,这主要归咎于近年来生物制药行业的普遍低迷。然而,尽管观察到了减少,但2023年细胞治疗肿瘤学交易在所有生命科学交易中所占的份额比过去十年中的任何一年都要大。此外,随着研究数据的积累和分子工程的广泛应用,新一代CAR-T细胞治疗在临床上逐渐趋于成熟。
变化的另一方面,人们对自身免疫、心脏病和感染性疾病等非肿瘤适应症的细胞治疗越来越感兴趣,2021年至2023年间,自身免疫性疾病的基因修饰细胞治疗试验增加了近四倍。尽管非肿瘤适应症的试验数量仍然相对较低,但这一趋势不可忽视。这些创新和变化使CAR-T细胞疗法成为一种强大而有前途的细胞免疫疗法,有可能惠及中国和全球广大癌症患者。
参考文献:
1. The changing landscape of cancer cell therapies: clinical trials and real-world data. Nat Rev Drug Discov. 2024 May 31
2. CAR-T cells: the Chinese experience. Expert Opin Biol Ther. 2020 Nov;20(11):1293-1308.
3. CAR T-cell therapies in China: rapid evolution and a bright future. Lancet Haematol.2022 Dec;9(12):e930-e941
4. Next generations of CAR-T cells - new therapeutic opportunities in hematology? Front Immunol.2022 Oct 28;13:1034707.
5. Current Status and Perspectives of Dual-Targeting Chimeric Antigen Receptor T-Cell Therapy for the Treatment of Hematological Malignancies. Cancers (Basel).2022 Jul; 14(13): 3230.


