孔大陆教授组稿|庄严:基因突变特征分析在结直肠癌诊疗中的意义
时间:2024-06-09 06:00:34 热度:37.1℃ 作者:网络
编者按:结直肠癌(colorectal cancer, CRC)是常见的恶性肿瘤,发病率居全球恶性肿瘤第三位,2020年全球估计新发CRC人数超过193万例;死亡率居第二位,估计死亡人数达93.5万例,约占全球新发癌症病例和癌症相关死亡人数的10%。
本期「专家组稿」由天津医科大学肿瘤医院孔大陆教授担任执行主编,他将与庄严医生在第三期内容中分享《基因突变特征分析在结直肠癌诊疗中的意义》,为医者和患者提供更多参考。
世界卫生组织下属国际癌症研究机构(IARC)于2021年发布了2020年全球癌症统计数据《全球癌症报告》:2020年全球新发癌症病例1929万例,全球癌症死亡病例996万例,其中结直肠癌位于癌症发病率排行榜第三,癌症死亡率排行榜第二。国家癌症中心于2024年3月在《中华肿瘤杂志》发布的2022年中国恶性肿瘤发病和死亡情况显示:2022年中国新发癌症482.47万例,其中新发结直肠癌51.7万例位居第二位;2022年中国癌症死亡人数257.42万例,其中结直肠癌死亡人数24.0万例位居第四位。
而2020年进行的中国中晚期结直肠癌患者诊疗现状调查中期结果显示:首次确诊时,83%的结直肠癌患者都处于中晚期,且44%的患者已经出现了肝、肺等部位的转移。因此,结直肠癌是一种发生和死亡率双高的癌症,严重危害国民健康。以往的多项研究表明结直肠癌的发生发展与分子水平的基因突变密切相关。因此了解结直肠癌的基因突变特征有助于更好地了解其发生和发展,有助于从分子水平来解读、分析和预测结直肠癌,有助于更精准的指导结直肠癌的个体化治疗,有助于为临床实践提供一些潜在的生物标志物。因此,这是精准治疗时代结直肠癌领域一个重要且具挑战性的研究方向。
目前导致结直肠癌的途径总共有两种(图1):一种是传统的腺瘤-癌途径,在所有结直肠癌的发生中约占70-90%;另一种是锯齿状癌变途径,约占所有结直肠癌的10-20%。这些途径代表了序贯发生的不同的基因水平和表观遗传水平的改变[1]。染色体不稳定表型的发生前通常会先有APC突变和RAS激活或TP53功能缺失。相反,锯齿状癌变通路通常表现为RAS和RAF突变,以CpG岛甲基化为主要特点的表观遗传学的不稳定,以及其所导致的染色体稳定和不稳定性肿瘤。
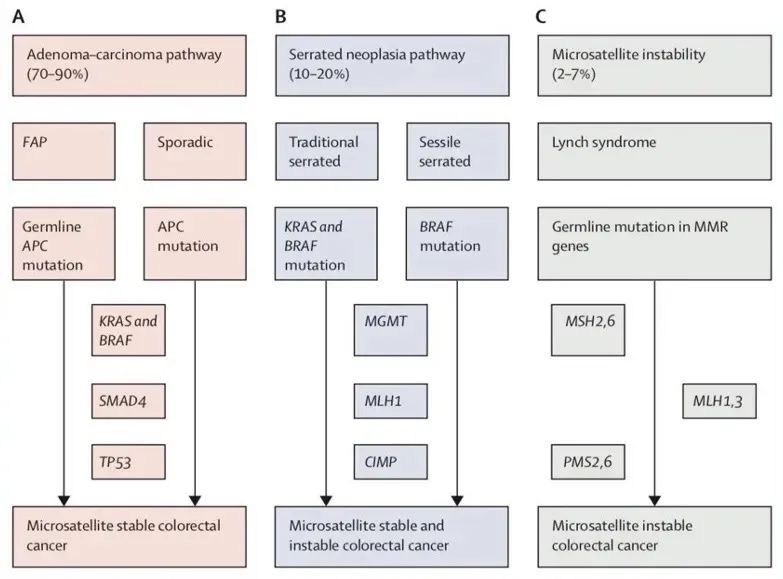
图1.结直肠癌进展的分子通路途径
从肿瘤发生部位分析,除了右半结肠和左半结肠在胚胎发育、生物学和解剖学方面也存在不同,肠癌的分子表达亦不同。右半结肠(盲肠、升结肠、肝曲、中右2/3的横结肠)癌与左半结肠(中左1/3的横结肠、脾曲、降结肠、乙状结肠、直乙交界)和直肠癌存在差异(图2)。图2反映了结肠癌患者遗传背景的不同和持续的变化。左右半的区分具有十分重要的意义,尤其在转移性肿瘤中其被用来作为判断肿瘤对抗EGFR药物敏感性的预测因素[2]。
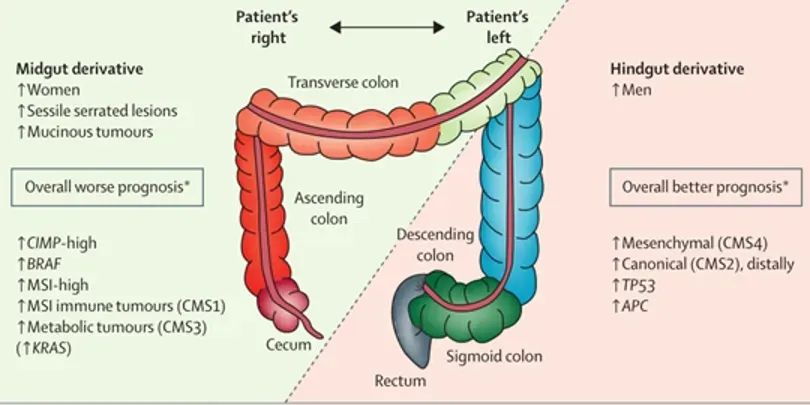
图2.右半结肠与左半结肠和直肠的区别
随着对结直肠癌基因及相关突变的研究逐渐深入,目前发现:
1、美国国立综合癌症网络NCCN(National Comprehensive Cancer Network)肠癌治疗指南指出全面的错配修复检测不但应用于Lynch综合征的发现,也应用于指导氟尿嘧啶为基础的辅助治疗的选择,同时也可作为转移性结直肠癌患者可能从免疫治疗获益的判断标准[3]。
2、RAS和RAF突变可以调控增殖、凋亡和血管生成,在结直肠癌中已经演变成为判断预后的标志物[4]。其中BRAF-V600E突变的结直肠癌患者,恶性程度高,对系统治疗反应差,预后要差2-3倍,这部分病人的鉴别是十分重要的[5]。因此,NCCN肠癌治疗指南推荐,结直肠癌患者在使用抗EGFR治疗前需要进行RAS和RAF(KRAS,NRAS和BRAF)突变检测[6]。
3、对于Ⅱ期的患者,dMMR是预后良好的标志,这部分患者并不能从辅助化疗中获益[7]。因此RAS、RAF和dMMR的检测已纳入NCCN肠癌治疗指南的常规推荐。
4、非V600E BRAF突变的结直肠癌患者可能比之前报道的患者有更好的预后[8]。
5、另一个有判断预后价值的治疗靶点是HER2/Neu[9],已经有了值得期待的结果。
综上所述,2021年《结直肠癌分子检测高通量测序中国专家共识》中指出:对Ras、BRAF、MMR/MSI、Her-2、PIK3CA、NTRK、TMB及遗传易感性基因APC、MMR、STK-11等相关分子标志物的深入研究、合理检测及应用已经成为目前临床实践的重要组成部分。
我们团队经过5年的研究,首次在多种常见恶性肿瘤中评估基因突变的频率和比例,并发现肠癌基于基因突变水平的高低风险人群的总生存具有显著性差异。2020年2月该研究成果Somatic gene mutation signatures predict cancer type and prognosis in multiple cancers with Pan-Cancer 1000 gene panel发表于CANCER LETTERS。
进一步研究我们发现在结直肠癌中有突变且突变频率在5%以上的共有44个突变基因,这44个基因均分布在结直肠癌发生发展相关的通路上(图3、图4),对这些基因的突变分析有助于结直肠癌的诊断、病理分类、分期和预后判断。
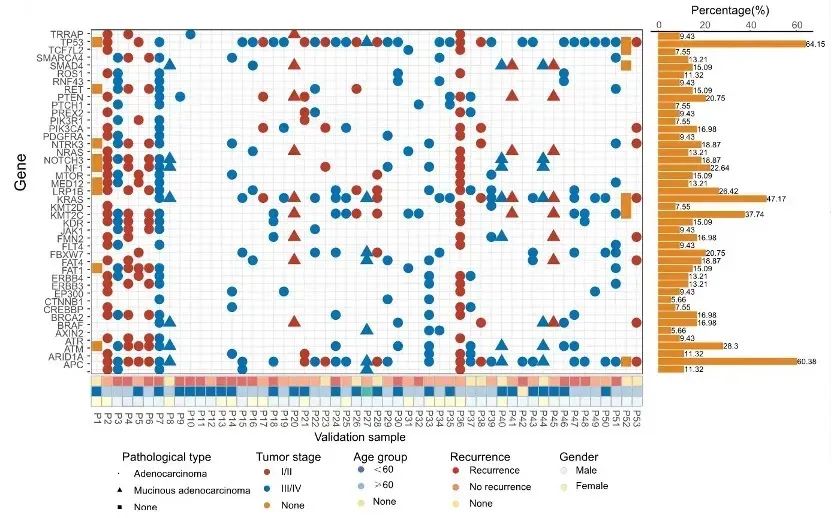
图3. 样本组44个基因的突变信息及患者临床信息
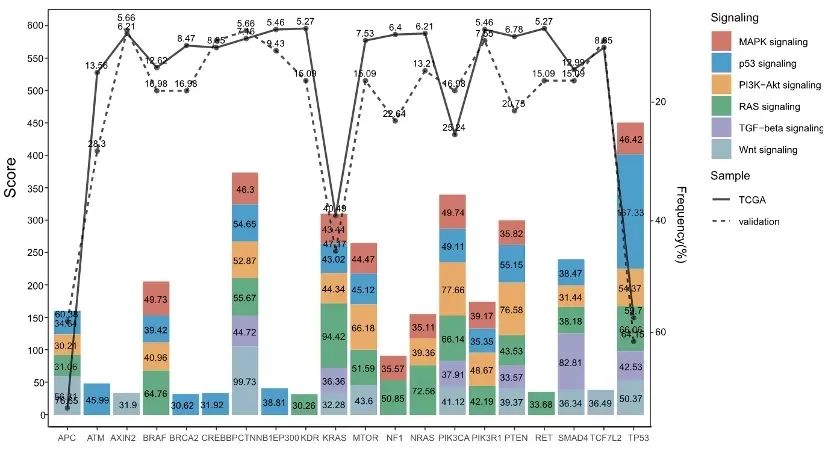
图4.GeneCards中超过30分的通路上的基因分布情况
2021年4月该研究成果Multi gene mutation signatures in colorectal cancer patients : predict for the diagnosis, pathological classification, staging and prognosis发表于BMC Cancer。以此44个基因及其他基因为标准可建立定制的选择性Panel进行NGS,可以进一步深入了解结直肠癌的基因表达及突变情况,有助于探索结直肠癌发生、发展的分子机制及分子标志物评价。我们从TCGA数据库下载531例结直肠癌患者的临床信息及其测序数据,临床收集53例手术的结直肠癌患者(样本组)并采用下一代测序技术进行测序。研究发现TP53、APC、KRAS、BRAF和ATM的突变覆盖了97.55%的TCGA人群和83.02%的验证组患者(图5、图6、图7)。
此外,57.14%的样本组和22.06%的TCGA样本表明粘液腺癌患者倾向于BRAF突变,但没有TP53突变(图8、图9)。重要的是,TP53、PIK3CA、FAT4、FMN2和TRRAP的突变在I-II期和III-IV期患者之间具有显著差异(P<0.0001)(图10、图11)。此外,我们还证实PIK3CA、LRP1B、FAT4和ROS1是预后相关的突变基因标志,可以预测CRC患者的复发和生存。
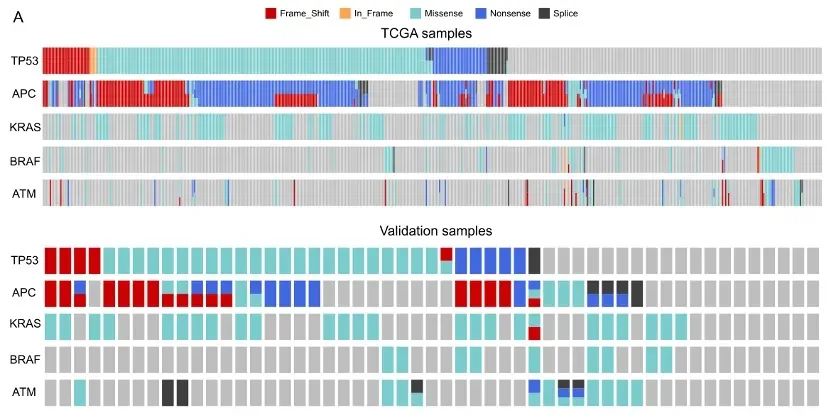
图5. TP53、APC、KRAS、BRAF和ATM在TCGA组和样本组中的突变分布
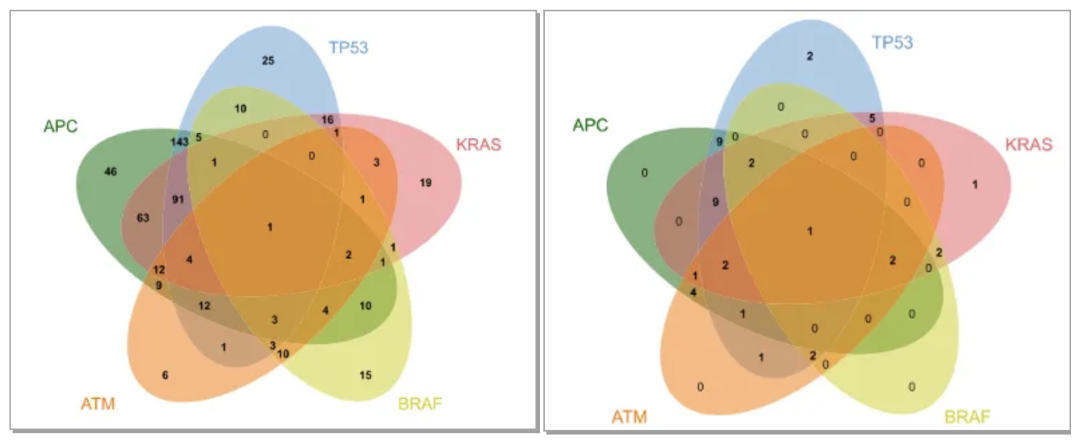
图6. TCGA人群中TP53、APC、KRAS、BRAF和ATM突变的Venn图 (左) 图7.样本组中TP53、APC、KRAS、BRAF和ATM突变的Venn图(右)
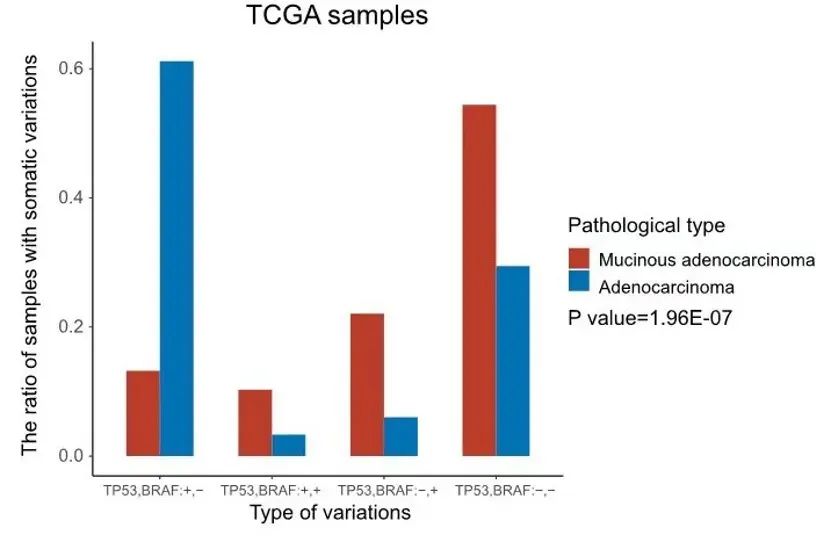
图8. TCGA样本中BRAF突变和TP53突变情况
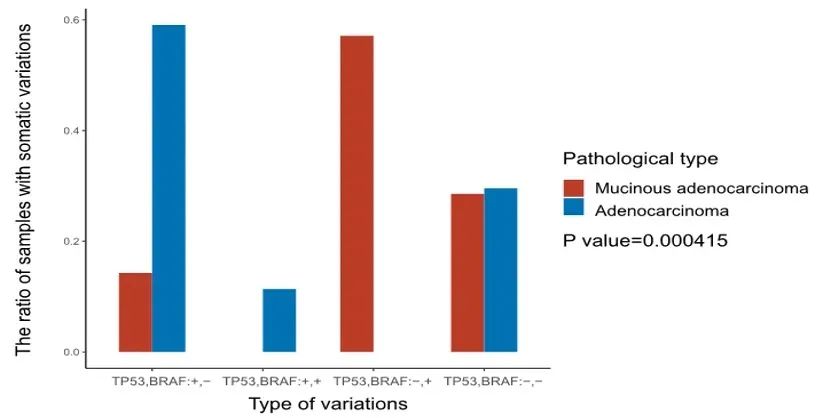
图9. 样本组中BRAF突变和TP53突变情况
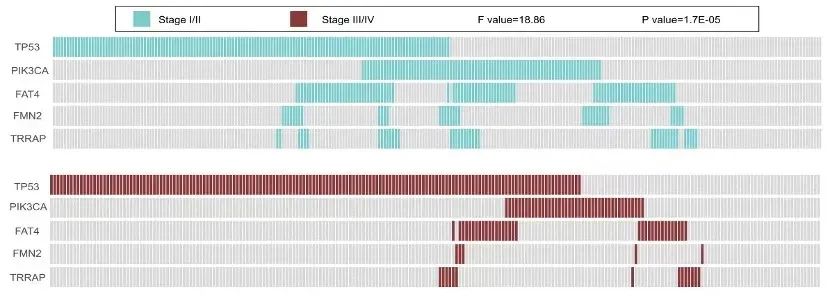
图10. TCGA组5种突变基因在不同TNM分期中的分布情况
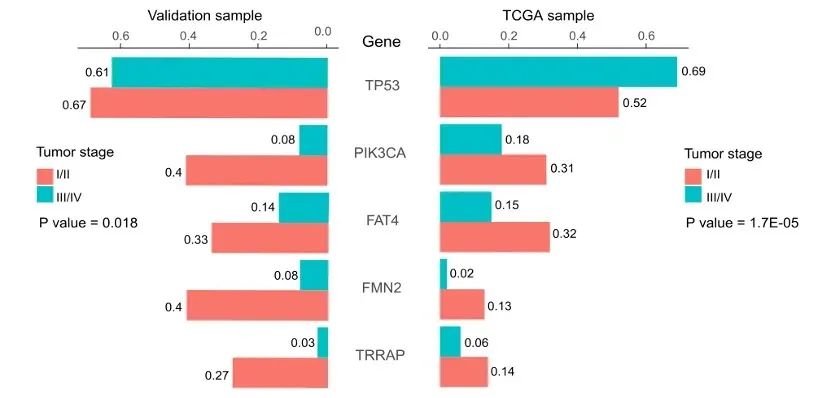
图11. 样本组(左)和TCGA组(右)中TP53、PIK3CA、FAT4、FMN2和TRRAP的基因突变频率
在我们研究发表后,美国弗吉尼亚大学和索尔克研究所的研究人员于2021年10月在Nature Commnications 发表研究论文,将基因突变信息与癌症患病率数据相结合,揭示了整个美国癌症患者人群中癌症的遗传基础,其研究思路及方法与我们不谋而合,但在结直肠癌方面研究还不够深入。而我们团队最早创新性的开展对中国结直肠癌人群进行选择性Panel的NGS,最早明确中国结直肠癌的遗传基础。第二,我们创新性通过高频突变基因研究其与结直肠癌生物学行为的关系。第三,研究中我们创新性有选择的定制结直肠癌Panel基因泛癌种芯片,与大Panel基因检测相比具有更高的性价比。
2022年我们团队又发现:Lynch综合征发展为结直肠癌的患者,基因表达情况、突变情况及表达水平与患者预后之间存在相关性。该研究成果Molecular Mechanisms and Differences in Lynch Syndrome Developing into Colorectal Cancer and Endometrial Cancer Based on Gene Expression, Methylation and Mutation Analysis发表于2022年2月的Cancer Causes & Control。
这些研究结果提示我们需要重新评估结直肠癌,将时间、精力和资源集中到结直肠癌发生、发展的分子机制及分子标志物领域,通过基因测序技术发现基因变异或者表达异常,通过精准生信分析和医学解读,找到基因变异与疾病或靶向用药对应关系,用以帮助指导开发更有效的诊疗方法。
参考文献
1.Cancer Genome Atlas Network. Comprehensive molecular characterization of human colon and rectal cancer. Nature 2012;487: 330–37.
2.Loree JM, Pereira AAL, Lam M, et al. Classifying colorectal cancer by tumor location rather than sidedness highlights a continuum in mutation profiles and consensus molecular subtypes. Clin Cancer Res 2018; 24: 1062–72.
3.Le DT, Durham JN, Smith KN, et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017;357: 409–13.
4.Schirripa M, Cohen SA, Battaglin F, Lenz HJ. Biomarker-driven and molecular targeted therapies for colorectal cancers. Semin Oncol 2018; 45: 124–32.
5.Roth AD, Tejpar S, Delorenzi M, et al. Prognostic role of KRAS and BRAF in stage II and III resected colon cancer: results of the translational study on the PETACC-3, EORTC 40993, SAKK 60–00 trial. J Clin Oncol 2010; 28: 466–74.
6.Pietrantonio F, Petrelli F, Coinu A, et al. Predictive role of BRAF mutations in patients with advanced colorectal cancer receiving cetuximab and panitumumab: a meta-analysis. Eur J Cancer 2015;51: 587–94.
7.Meyers BM, Cosby R, Quereshy F, Jonker D. Adjuvant chemotherapy for stage II and III colon cancer following complete rep: a cancer care Ontario systematic review. Clin Oncol 2017; 29: 459–65.
8.Jones JC, Renfro LA, Al-Shamsi HO, et al. Non-V600 BRAF mutations define a clinically distinct molecular subtype of metastatic colorectal cancer. J Clin Oncol 2017; 35: 2624–30.
9.Bertotti A, Migliardi G, Galimi F, et al. A molecularly annotated platform of patient-derived xenografts (xenopatients) identifies HER2 as an effective therapeutic target in cetuximab-resistant colorectal cancer. Cancer Discov 2011; 1: 508–23.


