【BCJ】1q获得/扩增负面影响骨髓瘤患者预后,并诱导恶性浆细胞转录组失调
时间:2024-06-17 06:00:58 热度:37.1℃ 作者:网络
1染色体异常
在多发性骨髓瘤(MM)中,1号染色体长臂(1q)的附加拷贝(Additional copies)是最常见的染色体异常之一,新诊断多发性骨髓瘤(NDMM)中越有30-40%,而复发/难治患者中越有50-60%。1q拷贝可预测高危疾病并已纳入部分风险分层模型,例如R2-ISS分期纳入1q21+。此外研究表明,1q扩增(Amp1q, 1q≥4个拷贝)与获得(Gain1q, 3个拷贝)患者的预后和生物学特性不同。但很少有研究探索1q异常对适合移植NDMM接受卡非佐米为基础治疗的影响
学者对随机FORTE研究进行分析,以评估Amp1q与Gain1q对卡非佐米为基础治疗的患者结局的影响,以及了解Amp1q、Gain1q和正常1q的转录组学变化,从而阐明与Amp1q/Gain1q相关的不良结局的生物学驱动因素。结果近日发表于《Blood Cancer Journal》。

研究方法&结果
FORTE研究共进行2次随机,第一次随机进入KCd-ASCT组、KRd12组或KRd-ASCT组,第二次随机进行维持治疗,进入KR组或R组。简而言之如下图。
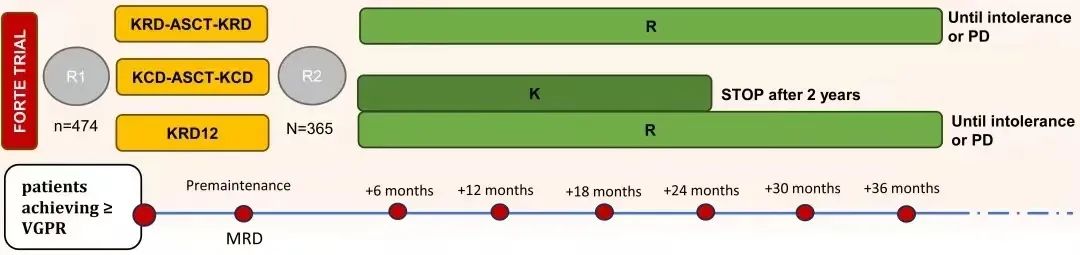
如果检测到≥10%的 1q 拷贝的细胞核且不符合 Amp(1q) 的定义,则定义为Gain(1q)阳性。如果检测到≥20%的细胞核 1q21 拷贝数≥4,则定义为 Amp(1q) 阳性。
研究人群
第一次随机的474例患者中有400例有1q拷贝数数据(图1) (称为ITT 1q人群),52例(13%)携带Amp1q、129例(32%)携带Gain1q、219例(55%)为正常1q。
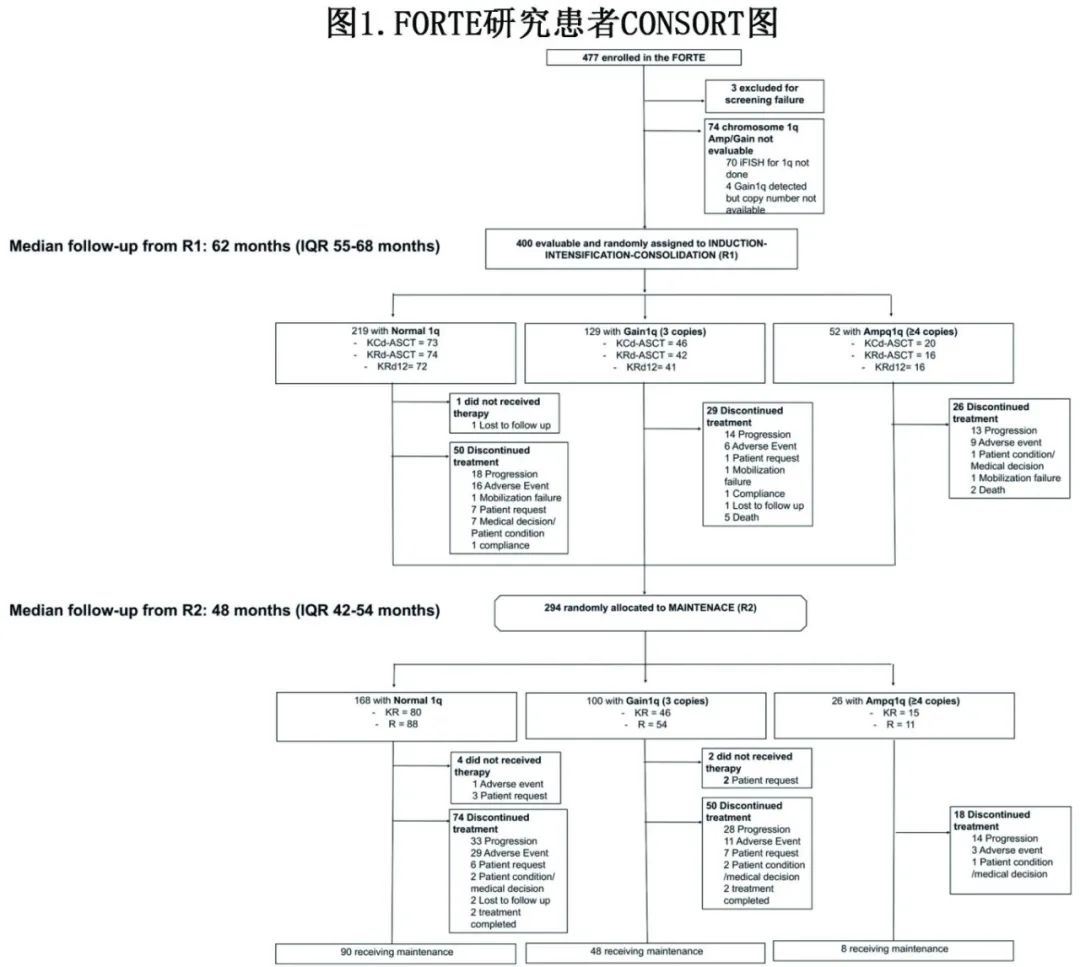
第一次随机后中位随访62个月。
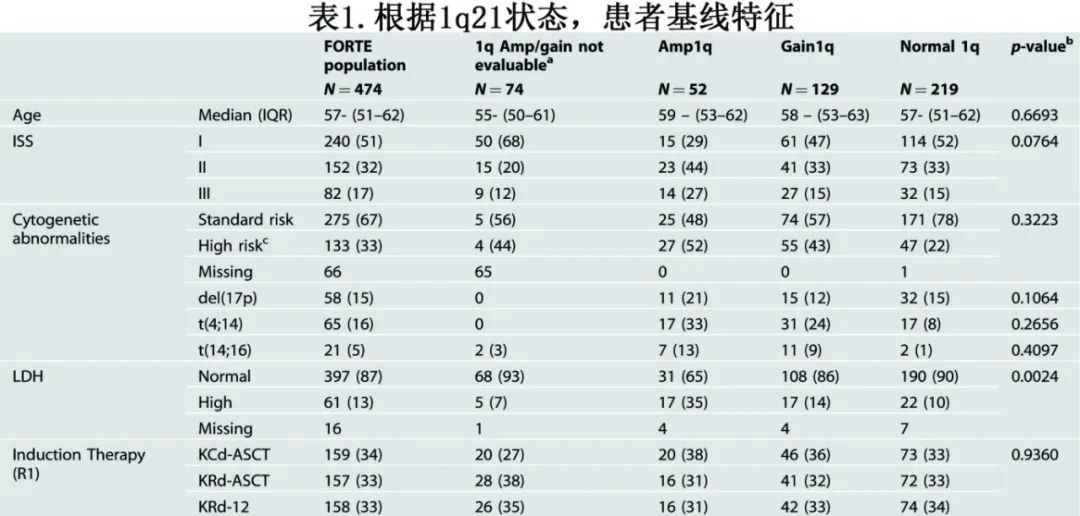
Amp1q、Gain1q和正常1q患者的人口学特征和治疗方案相对平衡。高危疾病特征(ISS II-III期、高危细胞遗传学和高LDH在1q异常组中比正常1q组中更多,且Amp1q与Gain1q组无统计学差异,但Amp1q组高LDH患者比例较高(p=0.0024)(表1)。值得注意的是,超二倍体患者在Amp1q组的比例较少(Amp1q组vs Gain1q组 vs 正常1q组的比例分别为23% vs 36% vs 45%;P=0.016)。
ITT分析
ITT分析中,Amp1q组的维持治疗前≥VGPR率为77%, Gain1q组为84%,正常1q组为84% (p=0.49),≥CR分别为46%、47%和52% (p=0.59),10-5 MRD阴性(MFC)率分别为44%、55%和55% (p=0.35),均无显著差异。但与Gain1q组(32%)和正常1q 组(37%)相比,Amp1q组(19%)的1年持续MRD阴性率有更低的趋势(p=0.05)。
第一次随机后的的PFS(图2A)显示,Amp1q组低于正常1q组(HR=3.34,p<0.0001)且Amp1q组低于Gain1q组(HR=1.99,p=0.0008),Gain1q组也低于正常1q组(HR=1.68,p=0.0031)。Amp1q组、Gain1q组和正常1q组的中位PFS分别为21.2个月、54.9个月和未达到,4年PFS率分别为27%、53%和71%。
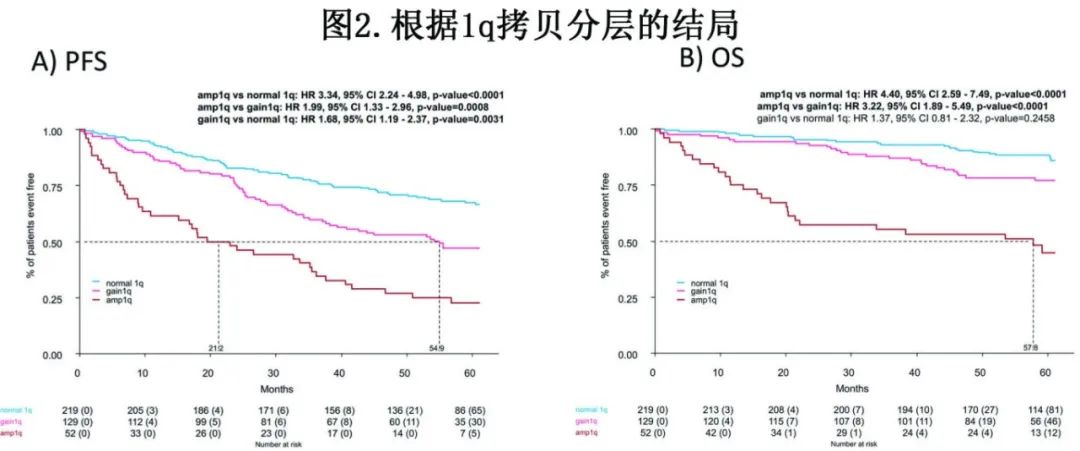
与正常1q组(HR=4.40,p<0.0001)和Gain1q组(HR=3.22,p<0.0001)相比,Amp1q组的OS更短(图2B),而Gain1q组和正常1q组之间无显著差异。Amp1q组、Gain1q组和正常1q组的4年OS率分别为53%、78% 和91%。
ITT 1q人群中有294例患者随机进入维持治疗组(R2),包括Amp1q组26/52 (50%),Gain1q组100/129 (78%),Normal 1q组168/219(77%)。R2之前停药的原因见图1,与Gain1q组(14/129,11%)和正常1q组(18/219,8%)相比,Amp1q组因PD而停药的比率(13/52,25%)更高。
第二次随机后的PFS,Amp1q组显著短于正常1q组(HR=3.05,p=0.0002)且Gain1q组短于1q组(HR=1.81,p=0.0116),而Amp1q组仅有短于Gain1q组的趋势(HR=1.69,p=0.0858)。Amp1q组、Gain1q组和正常1q组的3年PFS分别为46%、65%和80%。
亚组分析
PFS的亚组分析证实,在所有亚组患者中,Amp1q与Gain1q和正常q1相比均有负面预后影响。有趣的是,同时存在Amp1q与其他基线风险特征可确定一组预后极差的患者(图3) (高危细胞遗传学+Amp1q的中位PFS为10.9个月;高LDH+Amp1q为5.6个月;ISS 3期+Amp1q为10个月)。有趣的是,无附加高危染色体异常(HRCA)的Amp1q患者与附加HRCA的Gain1q患者结局相似(图3C,中位PFS 35.2个月 vs 35.1个月;HR=1.30,p=0.56)。然而,预后最差的患者为Amp1q伴附加HRCA,表明即使对于Amp1q这样的高危异常患者,附加HRCA也会产生叠加效应。
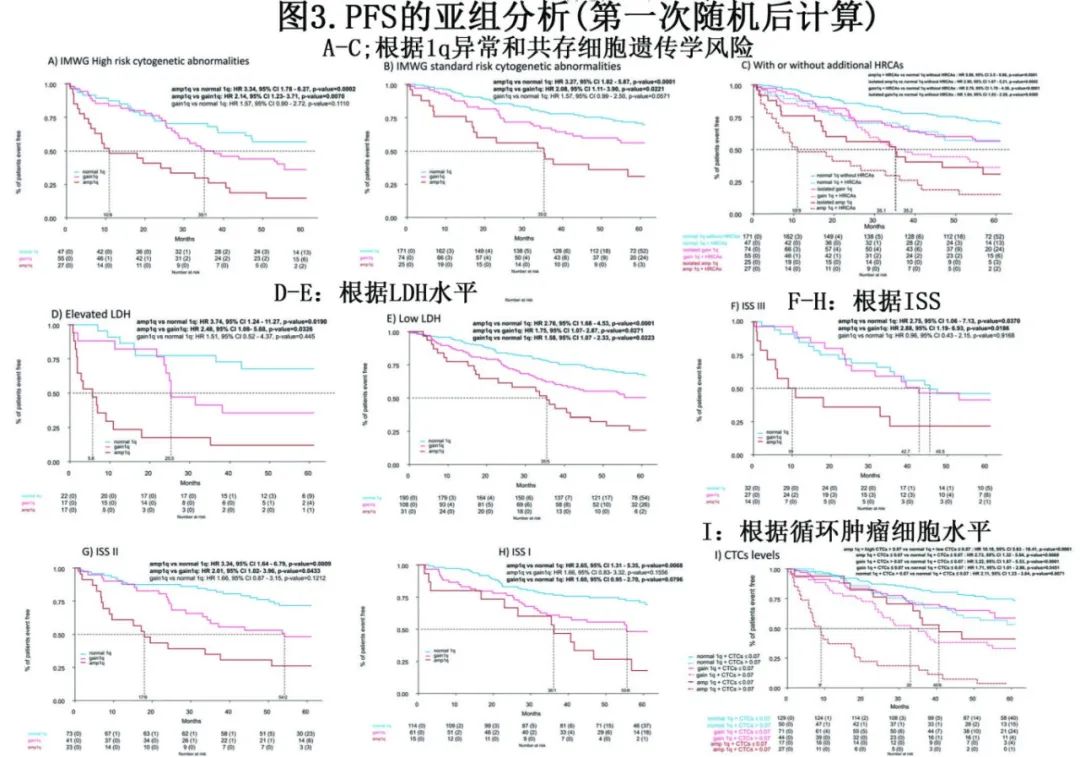
还分析了Gain1q和Amp1q与外周血基线循环肿瘤细胞(CTC,截断值0.07%)水平的关系。与其他基线风险特征一样,Amp1q和高CTC共存可导致最差的PFS(中位PFS 9个月,图3I)。
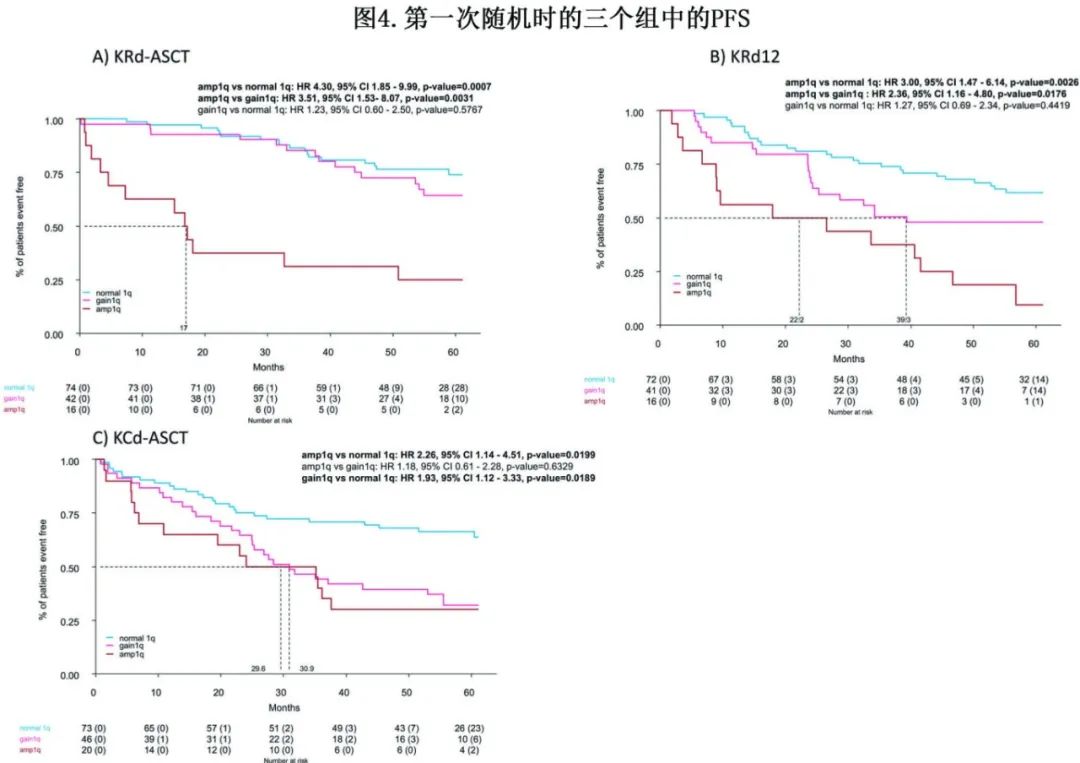
在治疗组方面,Amp1q的负面影响在所有治疗组中都很明显(图4)。Gain1q与正常1q组相比,在KRd-ASCT治疗组显示出PFS重叠(Gain1q组的4年PFS为72%,而正常1q组为77% ;HR=1.23,p=0.5777);在KCd-ASCT治疗组,Gain1q组的PFS劣于正常1q组(4年PFS为39% vs 68%,HR=1.93,p=0.0189),而在KRd12治疗组无显著趋势(4年PFS为48% vs 68%,HR=1.27,p=0.4419)。
值得注意的是,实现维持治疗前MRD阴性(MFC 10-5)可改善所有患者组的结局,但Ampl1q仍保留其预后意义。而未达到MRD阴性的Amp1q患者的中位PFS仅为7.3个月,代表着非常高危的人群。此外,在持续1年MRD阴性的患者中,根据1q亚组没有发现显著的PFS差异。
根据1q拷贝,恶性浆细胞的RNA测序
为使得比较的不同组样本量相似,在根据1q拷贝对RNA测序数据进行anova样分析时,作者随机选择了一组正常1q和Gain1q的患者,以匹配Amp1q组的大小,但排除伴t(4;14)易位的患者。
对入组 CoMMpass 研究的68例患者的 RNA测序数据进行 ANOVA 样分析(作为检测集),显示498个差异表达基因,能够在主成分分析中分离 1q 定义的组(图5A)。鉴定出的基因也能够在入组 FORTE 研究的24例患者的独立人群中分离出 1q 定义的组(作为验证集),这些患者未被纳入 CoMMpass 研究(图5B)。
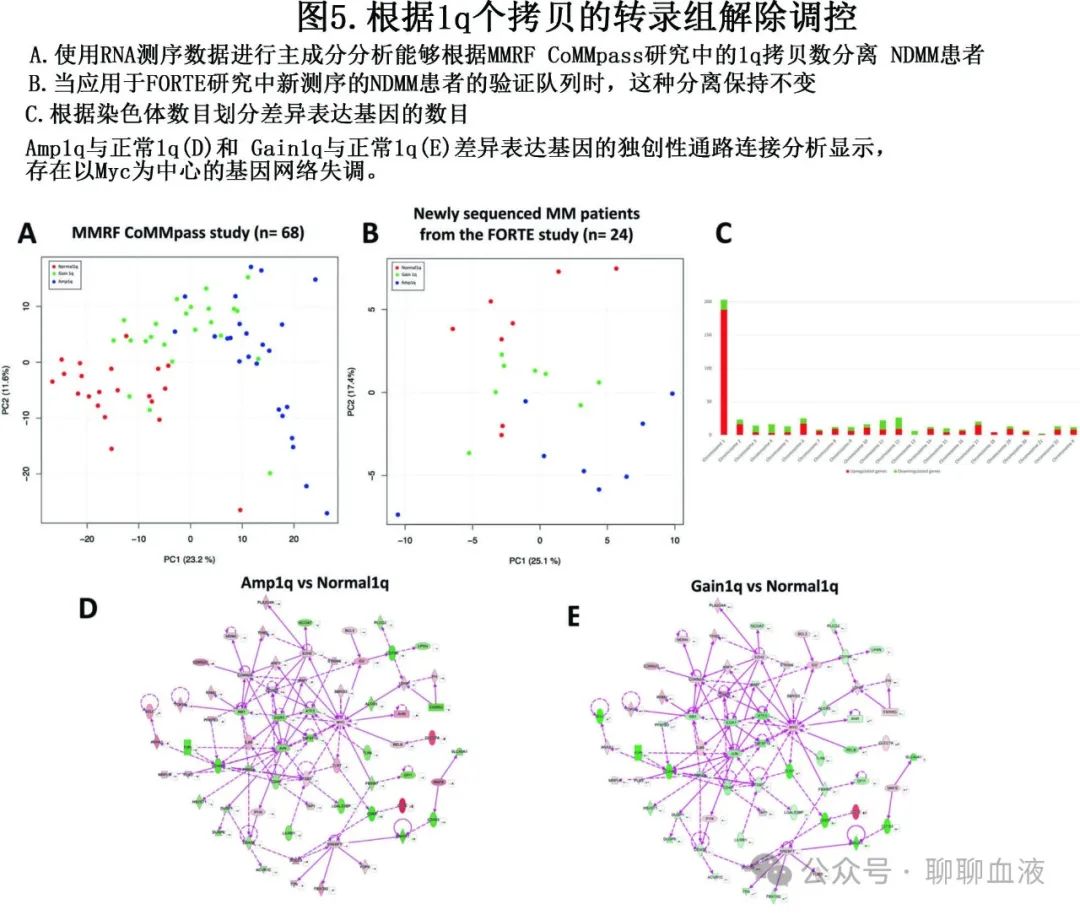
值得注意的是,许多(203/498)但非所有差异表达基因(DEG)都位于1号染色体(图5C)。此外,1号染色体203个DEG中有188个呈附加1q拷贝一致上调。凋亡信号通路(z评分 2.646)和p38 MAPK信号通路(z评分2.646)是Amp1q患者中最不受调节的通路。
Amp1q 与正常1q 差异表达基因的独创性通路连接分析 (图5D) 和Gain1q vs. 正常1q(图5E) 表现出以 Myc 基因为中心的失调基因网络。
总结
在该研究400例可获得1q数据的患者中,52例(13%)携带Amp1q、129例(32%)携带Gain1q。中位随访62个月,Amp1q组的中位PFS为21.2个月,Gain1q组为54.9个月,而正常1q组未达到。Amp1q的存在显著阻碍PFS (HR=3.34 vs.正常1q,P<0.0001;HR=1.99 vs. Gain1q,P=0.0008)。Gain1q组患者的PFS也明显短于正常 1q组(HR=1.68,P=0.0031)。在Amp1q患者中,伴随不良预后因素或未能达到MRD阴性可预测中位PFS<12个月。
总的来说,卡非佐米-来那度胺-地塞米松联合自体干细胞移植治疗改善了Gain1q的不良结局,但未改善Amp1q;Amp1q可识别极高危MM患者,而Gain1q患者处于中度进展和/或死亡风险,可能从KRd-ASCT-KRd中获益。转录组学数据显示,1q附加拷贝与凋亡信号、p38 MAPK信号和MYC相关基因的失调有关。在MM细胞中,额外的1q拷贝可诱导重要的转录组变化,可能值得探索在该患者亚群中使用特异性药物。
参考文献
D’Agostino, M., Rota-Scalabrini, D., Belotti, A. et al. Additional copies of 1q negatively impact the outcome of multiple myeloma patients and induce transcriptomic deregulation in malignant plasma cells. Blood Cancer J. 14, 94 (2024). https://doi.org/10.1038/s41408-024-01075-x


