IVD前沿丨最全的肿瘤生物标志物概述:用于诊断、预后和靶向治疗
时间:2024-06-24 12:00:43 热度:37.1℃ 作者:网络
杂志Signal Transduction and Targeted Therapy上发表了一篇题为“Tumor biomarkers for diagnosis, prognosis and targeted therapy”的文章。综述了肿瘤生物标志物的发现和发展,基于组织来源的肿瘤生物标志物分类以及肿瘤生物标志物在临床癌症管理中的应用。还讨论了该领域需要解决的限制和挑战,并提供了将挑战转化为机遇的见解和观点。

图片来源:Signal Transduction and Targeted Therapy
一 肿瘤生物标志物及检测技术
肿瘤生物标志物领域的目标是开发敏感、特异、可靠、经济、可重复、功能强大的检测和监测策略,在早期筛查、诊断、预后、复发监测等临床应用的各个方面都发挥着积极的作用。多种检测肿瘤生物标志物的技术已经开发出来(如下图)。在过去的几十年里,各种免疫测定方法(比如RIA、FIA技术)在肿瘤生物标志物的发现中发挥了至关重要的作用。同时,分子杂交技术(比如FISH)和基因扩增检测技术(比如PCR)进一步拓宽了肿瘤生物标志物在临床中的应用视野。免疫组织化学(IHC)带来了生物标志物在固定组织中的原始分布。此外,快速发展的测序技术(比如DNA和RNA测序)和基因编辑(比如CRISPR / Cas9技术)加快了挖掘预后和预测肿瘤生物标志物的速度和数量。其他技术,如液体活检和不同的显微镜技术,以及单细胞测序分析,也为癌症治疗提供了极大的便利。
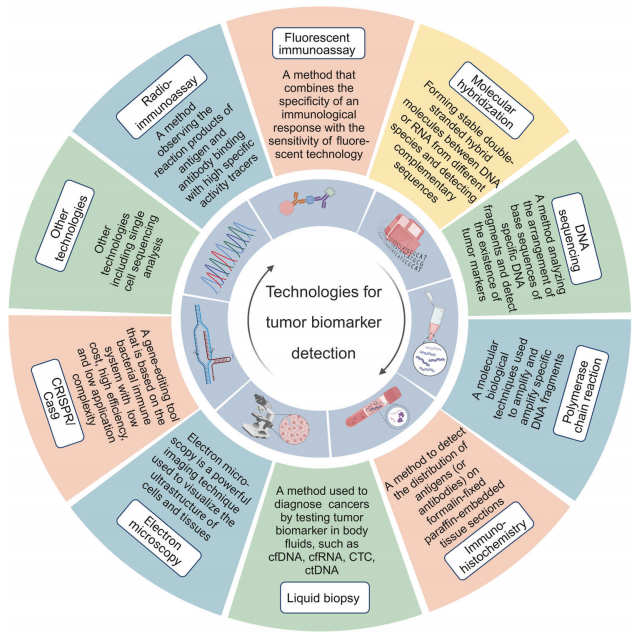
肿瘤生物标志物的检测技术。
图片来源:Signal Transduction and Targeted Therapy
二 肿瘤生物标志物的分类
肿瘤生物标志物是多种多样的,可以根据不同的标准进行分类。在这里,按组织来源划分肿瘤生物标志物:肿瘤生物标志物来源于血液、肿瘤组织和其他生物液体,如粪便、尿液和唾液(如下图)。下文将概述基于组织来源的肿瘤生物标志物分类以及肿瘤生物标志物在临床癌症管理中的应用。
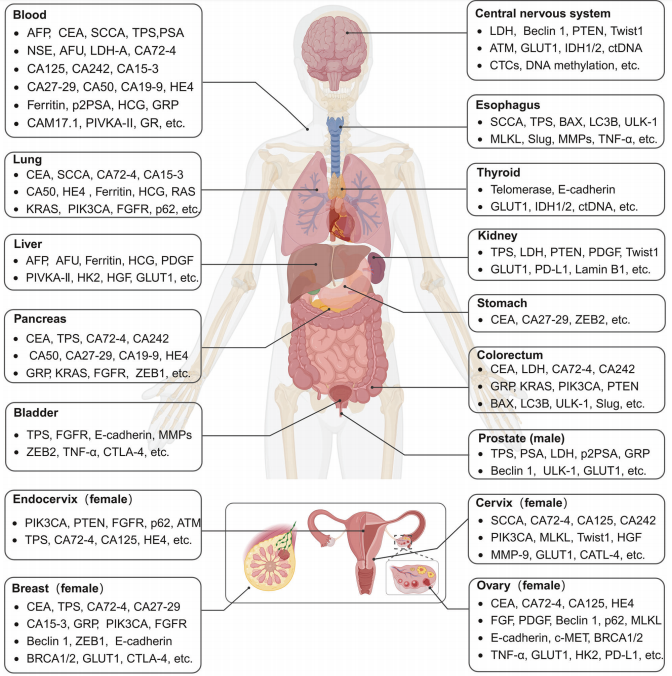
人类肿瘤生物标志物综述。
图片来源:Signal Transduction and Targeted Therapy
三 来源于血液的肿瘤生物标志物
AFP:健康成人血清中AFP浓度应低于10 μg/ l,是目前应用最广泛的HCC肿瘤生物标志物。约80%的HCC患者可出现AFP升高。在HCC患者中,AFP急剧升高提示肿瘤复发或转移。术后AFP >200 μg/L提示HCC清除不完全或转移。但慢性肝病患者可观察到AFP水平升高,包括约20%的肝炎患者和40%的肝硬化患者。
CEA:CEA在70%的结直肠癌、55%的胰腺癌、50%的胃癌、45%的肺癌、40%的乳腺癌、40%的尿道癌和25%的卵巢癌患者中升高。血清CEA水平与肿瘤负荷成正比。因此可被用于辅助诊断、判断预后、监测复发和评价治疗效果。然而,CEA缺乏良好的敏感性和特异性,不适合用于肿瘤筛查。
SCCA:血清SCCA水平与宫颈SCC的分期、侵袭程度、复发和进展相关。在肺癌、食管癌、泌尿生殖系统癌等多种SCCA中均发现高水平的SCCA,提示其在上述癌症的诊断和预后中具有重要作用。
组织多肽特异性抗原(TPS):血清中TPS的水平特异性地指示细胞的增殖活性,而非肿瘤细胞总数。在多种肿瘤中,血清TPS水平明显升高。由于缺乏敏感性和器官特异性,TPS的主要应用是监测治疗效率,预测肿瘤进展和复发。但TPS水平会因一些病理和生理状况而改变,如慢性胰腺炎、肝硬化、排卵和绝经状态。
PSA:血清PSA水平升高代表前列腺病变,包括前列腺炎、良性前列腺增生和前列腺癌。PSA在前列腺癌的检测和患者管理中得到广泛应用,包括筛查、复发风险分层、诊断后监测和监测治疗。然而,PSA在前列腺癌诊断中的特异性较差,仅为20-40%。一些非癌性病变,如炎症、创伤或良性前列腺增生也可能升高PSA水平,从而导致高假阳性率。
NSE:在中枢或外周神经元中,细胞增殖加速响应癌性转化,并伴有糖酵解增强和NSE表达升高。因此,NSE在神经和神经内分泌肿瘤的诊断、预后和治疗效果评估中发挥着关键作用。此外,在伴有神经内分泌特性的SCLC以及NSCLC中也观察到NSE升高。
AFU:血清AFU水平在肿瘤侵袭机体的过程中迅速升高,其水平与肿瘤分期和肿瘤大小密切相关。AFU是HCC检测中最有价值的生物标志物之一,具有85%的敏感性和91%的特异性,对于判断HCC的治疗效果、预后和复发具有重要意义。但在某些非肿瘤性疾病如肝硬化、慢性肝炎和胃肠道出血中,血清AFU水平也会轻度升高。
LDH:高水平的血清LDH与癌细胞的增殖、侵袭性和转移增强、癌症预后不良以及放疗和化疗耐药有关,是黑色素瘤、RCC和CRC患者预后不良和远处转移患者预后的主要预测指标。LDH过表达还可以指导实体肿瘤个体化治疗的预测因子。总之,LDH是一个有价值的肿瘤诊断、疗效评价和复发转移的指标。
CA72-4:血清CA72-4水平升高是胃癌、胰腺癌、结直肠癌、乳腺癌、卵巢癌、肺癌、宫颈癌、子宫内膜癌等癌症诊断的有效指标,对消化系统肿瘤(胃癌)具有较高的敏感性和特异性。但CA72-4在正常组织中也有高表达,导致萎缩性胃炎患者出现假阳性。
CA125:CA125是监测上皮性卵巢癌最重要的生物标志物之一,敏感性达到~70%。此外,CA125也是其他非卵巢肿瘤的诊断和预后生物标志物,如宫颈癌、子宫内膜癌和胃癌。但一些良性疾病(如子宫内膜异位症和冠状动脉疾病)患者有不同程度的血清CA125升高。
CA242:CA242的主要应用是作为结直肠癌和胰腺癌的生物标志物。诊断胰腺癌和结直肠癌的敏感性分别为~ 70%和45%,特异性分别为~ 95%和83%。此外,CA242也被用作胰腺癌化疗期间进展或复发的临床指标。
CA15-3:CA15-3在大多数人类癌症中过度表达,被认为是癌症的关键生物标志物,特别是在指示癌症转移方面。CA15-3联合CEA是最常用的乳腺癌诊断方法同时,CA15-3也是评价乳腺癌术后恢复、复发、转移的重要指标。值得注意的是,在乳腺、肝脏、胃肠道、肺等器官的良性疾病中,血清CA15-3也有不同程度的升高,但阳性率较低。
CA27-29:CA27-29对乳腺癌的检测灵敏度为84%,主要用于乳腺癌患者的诊断和疗效评价。其升高也见于其他癌症,包括结直肠癌、胃癌、胰腺癌、卵巢癌以及乳腺和肝脏的良性疾病。
CA50:CA50在正常组织中通常不存在,但在多种癌症中均升高。胰腺癌、肺癌和结肠癌患者的血清CA50水平最高。血清CA50对胰腺癌的诊断相当有效,敏感性可达84%以上。慢性胰腺炎、结肠炎、胆囊炎和肺炎等非肿瘤疾病患者血清CA50也升高
CA19-9:CA19-9是胰腺癌金标准生物标志物,诊断胰腺癌的中位敏感性为79%。此外,CA19-9也被用作消化道癌症癌症的生物标志物,但肝损伤、胆管阻塞和炎症、胰腺炎、急性腹泻、胃溃疡和肺纤维化也与CA19-9水平升高有关。
HE4:血清HE4主要用于卵巢癌的诊断和复发监测,敏感性为67%,也被用于评价卵巢癌的治疗效果。此外在其他非妇科恶性肿瘤中也过表达,包括NSCLC、胰腺癌和移行细胞癌。
Ferritin:Ferritin在多种癌症中过表达,如HCC、肺癌、淋巴瘤、黑色素瘤和CRC,在评估癌症患者的进展和预后方面具有重要价值。然而,许多因素影响Ferritin水平,对肿瘤检测的特异性有限。
p2PSA:p2PSA在早期前列腺癌的诊断中具有一定的临床价值,前列腺健康指数是通过PSA和p2PSA计算得出的,已被FDA批准用于前列腺癌的早期诊断和风险分级。
HCG:在滋养细胞肿瘤、卵巢癌、睾丸癌、乳腺癌、肺癌、HCC、CRC和肾癌中观察到血清HCG水平升高。虽然HCG水平可用于监测疾病进展,但不能作为诊断标志物。
CAM17.1:CAM17.1在胰腺癌中过度表达,对胰腺癌的诊断敏感性为86%,是胰腺癌诊断的潜在生物标志物,需要进一步研究。
PIVKA-II:PIVKA-II主要用于HCC的早期检测,敏感性和特异性分别为97.5%和90%。其他肿瘤如胃癌和胰腺癌中,PIVKA-II也有不同程度的升高。能够区分肝硬化或慢性肝炎等非恶性疾病,但某些维生素K缺乏症患者也表现出PIVKA-II水平升高。
Pro-GRP:血清pro-GRP检测主要用于SCLC的诊断、疗效及预后分析,灵敏度为47 ~ 86%,此外,在胃炎、急性肝炎等少数疾病中,pro-GRP也有升高,但阳性率普遍较低。
四 来源于肿瘤组织的肿瘤生物标志物
肿瘤具有14个主要特征,包括持续增殖,逃避生长抑制因子,无限复制,诱导血管生成,抵抗细胞死亡,侵袭和转移能力,基因组不稳定和突变,肿瘤促进炎症,细胞代谢紊乱,免疫逃逸,解锁表型可塑性,非突变表观遗传重编程,多态性微生物组和衰老细胞。下文总结了按肿瘤特征划分的肿瘤组织中的肿瘤生物标志物(如下图)。
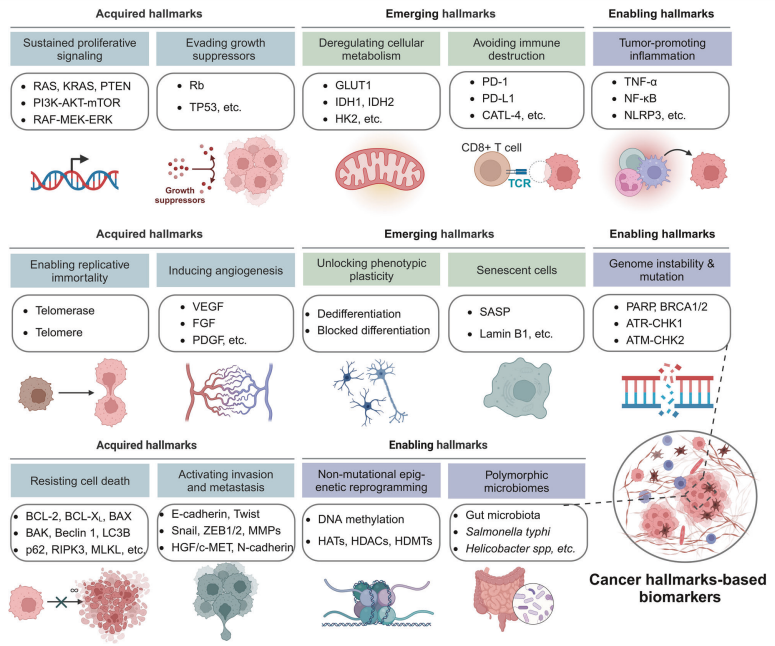
基于14种癌症特征的生物标志物。
图片来源:Signal Transduction and Targeted Therapy
1 持续增殖
癌细胞能够通过多种途径获得维持增殖的能力。在生长因子和其他增殖信号的刺激下,肿瘤细胞中的RAS、PI3K-AKT-mTOR通路、RAF-MEK-ERK通路等增殖相关信号通路被激活,进而调控肿瘤细胞的增殖、迁移侵袭、基因转录、细胞代谢重编程和肿瘤微环境(TME)重塑。
RAS:RAS激活与多种肿瘤表型相关,包括细胞周期进展、增殖、转移和细胞凋亡抵抗。此外,RAS参与多种代谢过程,如有氧糖酵解、氧化还原稳态和肿瘤细胞的脂质代谢,以支持肿瘤生长。RAS激活重塑了TME,包括启动和维持促血管生成,产生促炎因子和免疫逃逸。RAS突变是肿瘤发生发展中的重要因素,是肿瘤诊断、预后和治疗的重要生物标志物。
KRAS:KRAS是最常扩增和突变的RAS亚型,KRAS突变存在于88%的胰腺癌、50%的结直肠癌和32%的肺癌中,已成为一些肿瘤预后、诊断和治疗的生物标志物。KRAS突变是肿瘤发生最普遍的驱动因素之一,其激活与肿瘤进展和不良预后相关,是重要的肿瘤生物标志物。
PI3K-AKT-mTOR:PI3K-AKT-mTOR通路影响多种细胞过程,如细胞增殖、血管生成、蛋白质翻译和代谢重编程,在多种癌症中发挥着重要作用。pAKT水平是SCLC治疗的一种诊断性生物标志物,PIK3CA突变可作为HR+和HER2-转移性乳腺癌的诊断生物标志物。PIK3CA突变、PTEN缺失和pAKT激活是肿瘤治疗疗效的预测性生物标志物。综上所述,PI3K-AKT-mTOR通路是肿瘤诊断、预后和治疗的重要生物标志物通路。
RAF-MEK-ERK:RAS-RAF-MEK-ERK通路参与细胞增殖、分化、迁移和凋亡等关键过程的调控。RAF-MERK-ERK信号的突变发生在约50%的癌症中,可以作为乳腺癌的预测和预后生物标志物,也作为癌症治疗药物敏感性的预测性生物标志物。
PTEN:PTEN负向调控PI3K-AKT-mTOR通路,从而阻碍肿瘤细胞的增殖和存活。此外,PTEN在细胞上皮-间质转化(EMT)、迁移和侵袭、糖脂代谢、细胞周期、DNA修复、基因组稳定性和基因转录等方面均有作用。PTEN作为各种癌症的预后和预测性生物标志物,包括前列腺癌、RCC、PDAC、CRC、乳腺癌、子宫内膜癌、脑癌、皮肤癌和血液恶性肿瘤。PTEN缺失与癌症患者较短的OS和DFS密切相关。综上所述,PTEN是肿瘤预后的重要生物标志物。
2 逃避生长抑制因子
Rb:Rb蛋白的失活是癌症中最常见的事件之一,导致细胞分裂异常,细胞周期退出缺陷,细胞周期检查点控制受损。因此,Rb失调作为癌症预后的生物标志物。
TP53:TP53编码p53肿瘤抑制蛋白,在细胞周期阻滞、衰老、DNA修复和细胞凋亡等生物过程中起着不可或缺的作用。TP53是最常见的突变基因,约50%的肿瘤携带TP53.的突变或缺失,可以作为预测性生物标志物来评估各种癌症的预后和监测治疗反应。
3 实现无限复制
端粒酶:端粒酶通过维持端粒长度,补偿连续细胞分裂过程中染色体末端的损耗。hTERT在几乎所有体细胞中沉默,在约90%的人类癌症中显著重新表达,从而保证了癌细胞的永生化。端粒酶是癌症患者OS的独立预后生物标志物。
4 诱导血管生成
VEGF:VEGF可激活PI3K-AKT和RAF-MEK-ERK通路,产生新血管分支,最终促进肿瘤快速增殖和迁移。VEGF水平与肿瘤的侵袭性有关,不同肿瘤患者血浆VEGF水平均升高,且与肿瘤预后呈负相关。此外,VEGF水平可用于预测口服酪氨酸激酶抑制剂对癌症患者的疗效。总之,循环VEGF和VEGFR-2已被用作预测预后和抗血管生成药物疗效的重要生物标志物。
FGF:在肿瘤中,FGF对血管内皮完整性、血管生成、肿瘤增殖、存活和转移至关重要。异常的FGF信号通过促进肿瘤血管生成来加速肿瘤增殖。FGFR与多种肿瘤的发展密切相关,如前列腺癌、肺癌、乳腺癌、胰腺癌等。突变或扩增的FGFR可驱动癌基因异常激活下游通路,导致细胞分裂、抗凋亡反应。总之,FGF和FGFR是肿瘤预后和治疗的重要生物标志物。
PDGF:PDGFs是一种血小板α-颗粒成分,可激活多种下游生长信号通路,促进癌细胞增殖、迁移侵袭、血管生成和耐药。PDGF在多种癌症中广泛表达,高PDGF-A水平与癌症患者转移性复发风险独立负相关,PDGF-D的水平与肿瘤的晚期和骨转移的发生有关。PDGFR-β高表达与前列腺癌复发独立相关。总之,PDGFs和PDGFRs是有意义的诊断性生物标志物。
5 抵抗细胞死亡
5.1 细胞凋亡:
细胞凋亡可通过内源性或线粒体途径和外源性途径触发,导致细胞凋亡。针对促凋亡和抗凋亡蛋白诱导细胞凋亡是潜在的癌症治疗策略。
BCL - 2 / BCL-XL:BCL-2家族蛋白可分为3个亚家族:抗凋亡的BCL-2和BCL-XL,促凋亡的BAX和BAK,以及促凋亡的BIM和PUMA。BCL-2和/或BCL-XL的过表达诱导细胞凋亡抵抗有助于肿瘤进展和化疗药物的耐药。此外,BCL-XL可作为预测结直肠癌患者预后的独立生物标志物。BCL-2是TNBC患者的预后生物标志物。综上所述,BCL-2和BCL-XL是肿瘤预后和治疗的重要生物标志物。
BAX/BAK:BAX基因的下调和突变对细胞凋亡抵抗至关重要,在包括胃癌、食管癌和CRC在内的多种癌症中,BAX基因是一种潜在的预后和预测性生物标志物。BAX的激活可用于促进凋亡细胞死亡和克服耐药性。BAK的高表达与晚期胃癌患者OS和PFS的改善相关。BAK是多西紫杉醇在晚期胃癌患者治疗效果的预测和预后生物标志物。BAX-BAK异源二聚体也被用作MCL1抑制剂靶向药物作用的药效学生物标志物。
5.2自噬:
自噬在癌症中是一把双刃剑。肿瘤细胞中自噬流的增强加速了肿瘤细胞的生长,而诱导自噬可以阻止肿瘤的发展。因此,抑制和促进自噬都是癌症治疗策略,其应用取决于实际情况。
Beclin 1:Beclin 1是多种癌症的预后生物标志物。Beclin 1在脑肿瘤和宫颈细胞癌中表达降低。Beclin 1的低表达与胃癌的恶性表型和不良预后相关。Beclin 1在体外和体内通过调节自噬抑制人乳腺癌细胞MCF7的增殖。Beclin 1表达升高与CRC患者远处转移和预后不良有关。综上所述,Beclin 1可能作为一种有效的癌症预后指标和治疗靶点。
LC3B:LC3B是经典的自噬标志物。LC3B的高表达与胃癌、CRC、 TNBC、黑色素瘤、星形细胞瘤、食管癌、OSCC等多种肿瘤的侵袭性进展及不良预后密切相关,还与HCC的血管侵袭和淋巴结转移密切相关,是HCC的潜在治疗靶点,是一种癌症治疗预后生物标志物。
ULK-1/2:ULK-1高表达与多种肿瘤预后不良相关,包括食道SCC、HCC、 NPC、前列腺癌、和CRC。ULK1和LC3B过表达的HCC患者肿瘤较大,淋巴结转移频率较高,并可作为CRC患者的预后生物标志物。在人鼻咽癌中,ULK1也可用于预测不良预后和治疗反应。
p62:p62的积累通常代表自噬的抑制。p62的上调或降低降解与肿瘤进展和抗癌耐药有关。p62高表达与癌症的侵袭性和不良预后相关,包括子宫内膜癌、OSCC、上皮性卵巢癌和NSCLC。此外,p62高表达还与乳腺癌患者的高级别、远处转移和5年生存率降低相关,尤其是TNBC癌症患者。总之,p62是一种有意义的预后生物标志物,也是癌症治疗的潜在靶点。
5.3 坏死:
RIPK3:RIPK1-RIPK3- MLKL复合体,介导上游细胞死亡受体和下游信号通路。RIPK3在多种肿瘤细胞中下调,包括乳腺癌、黑色素瘤、肺癌和CRC。低RIPK3水平与CRC和乳腺癌患者预后不良密切相关。相反,RIPK3在其他几种肿瘤中表达升高,如浆液性卵巢癌、胰腺癌和结肠癌。RIPK3通过肿瘤细胞增殖和CXCL1诱导的免疫抑制促进结肠炎相关结直肠癌。总之,RIPK3是一种潜在的肿瘤预后生物标志物,尽管其作用需要根据具体情况进行分析。
MLKL:MLKL是癌症患者治疗反应和预后不良的重要决定因素。在胃癌、卵巢癌、子宫颈癌、结肠癌、胰腺癌中,MLKL低表达水平与较低的OS显著相关。MLKL已成为早期PDAC切除患者的预后生物标志物。然而,高水平的MLKL与结肠癌和食管癌患者的预后不良有关,可能原因是一些癌细胞激活坏死来调节免疫系统。总之,MLKL是潜在的预后生物标志物。
6 激活侵袭和转移
6.1 E-cadherin:E-cadherin是上皮细胞层的生物标志物,与肿瘤患者的病理及临床特征密切相关,如分化程度、侵袭性、静脉渗透、腹膜播种、浸润性生长、肝骨转移、淋巴结转移、肿瘤分期、预后不良等。E-cadherin的缺失或下调可促进肿瘤侵袭、浸润性生长和去分化。因此,E-cadherin可作为多种肿瘤转移的预后生物标志物,包括结直肠癌、胃癌、胰腺癌、食管癌、肝癌、肺癌、膀胱癌、前列腺癌、乳腺癌、子宫内膜癌、卵巢癌、甲状腺癌和HNSCC。
6.2 EMT转录因子:EMT在上皮源性肿瘤从良性病变到侵袭性癌和转移的过程中起着重要作用。EMT受EMT转录因子调控,直接抑制因子包括Snail超家族和ZEB家族。间接抑制因子包括Twist1和Twist2。EMT转录因子促进癌性转化、调节CSCs、产生化疗耐药、增加肿瘤血管生成等最终促进肿瘤细胞运动和转移。此外,EMT转录因子还调节肿瘤促生存表型,如参与肿瘤细胞DNA修复、逃避衰老和凋亡、免疫逃避等。EMT相关信号通路基因与CRC患者的预后预测高度相关。EMT转录因子被认为是肿瘤侵袭性和转移的预后生物标志物。
Twist:Twsit1和Twsit2在多种人类癌症中过表达。Twsit1过表达与肿瘤患者的侵袭性和转移密切相关,包括肉瘤、胶质瘤、黑色素瘤、ESCC、神经母细胞瘤、宫颈癌、RCC、以及血液系统恶性肿瘤。在CML患者中,Twist的表达增加与肿瘤进展、肿瘤分期和耐药性有关,Twist可作为评估MRD的生物标志物。总的来说,Twist是肿瘤预后和转移的一个生物标志物。
Snail:Snail下调E-cadherin的表达,从而诱导EMT和基底样表型转化。在乳腺癌、结直肠癌、肝癌患者中,Snail过表达与预后不良有关。Slug对EMT也有显著的影响,是CRC和食管SCC患者生存不良的独立预后生物标志物。
ZEB1/2:ZEB1阻断E-cadherin转录并诱导EMT。ZEB1过表达与胰腺癌的高侵袭性前体病变和不良预后密切相关。ZEB1的异常表达与多种肿瘤的进展和转移相关,包括子宫癌、骨肉瘤、肺癌、肝癌和胃癌,这揭示了ZEB1在EMT诱导和肿瘤发展中的重要性。过表达ZEB2阻断E-cadherin蛋白介导的细胞间粘附,促进肿瘤细胞转移。ZEB2促进乳腺癌、膀胱癌、卵巢癌、胃癌、CRC、 OSCC和胰腺癌的迁移和侵袭。
6.3 HGF / c-MET:HGF/c-MET参与胚胎发生、血管生成、伤口愈合和器官再生等细胞过程。c-MET活化增强肿瘤的致瘤性、侵袭性和转移性,与预后不良密切相关。HGF促进HCC迁移和侵袭,是一种独立的预测性生物标志物和卵巢癌患者的主要诊断标志物。此外,c-MET通过自分泌和旁分泌信号通路增加细胞运动和抑制细胞凋亡,从而介导耐药。综上所述,c-MET/HGF过表达是各种血液学和实体肿瘤患者预后不良和耐药的独立生物标志物。
6.4 N-cadherin:N-cadherin在多种肿瘤中高表达,通过调节生长因子受体信号通路、Wnt信号通路、以及新生血管信号通路,促进肿瘤细胞存活、增殖、侵袭和转移。N-cadherin在血液系统恶性肿瘤(如白血病和多发性骨髓瘤)中表现出重要作用,并与多发性骨髓瘤的不良预后密切相关。阻断N-cadherin可有效抑制前列腺癌的侵袭、转移和去势抵抗,已成为前列腺癌重要的治疗靶点和生物标志物。
6.5 MMP:MMPs是一种蛋白水解酶,能够降解基底膜和大部分ECM成分,重塑ECM并参与肿瘤细胞的各种稳态调节,如免疫、血管生成、细胞粘附、细胞增殖、细胞凋亡和EMT等。MMP-9在癌细胞的侵袭和转移中起着至关重要的作用,并已被证明是不同癌症的关键生物标志物,包括NSCLC、宫颈癌、胃癌、卵巢癌、乳腺癌、骨肉瘤和胰腺癌。
7 基因组不稳定性和突变
PARP:DNA单链断裂(SSB)主要由PARP1或PARP2识别,抑制PARP可降低SSBs的修复效率,显示其抗癌功效。
BRCA1/2:BRCA1/2通过HR途径促进准确的DNA修复来维持基因组完整性。BRCA1/2功能的缺失导致DNA损伤和基因组改变的积累,促进肿瘤发生。BRCA1/2可作为评价消化系统肿瘤预后的生物标志物。此外,BRCA1/2突变与多种癌症的进展密切相关,包括乳腺癌、卵巢癌、前列腺癌和胰腺癌。总之,BRCA1/2可作为癌症预后和治疗反应的生物标志物。
ATR-CHK1 / ATM-CHK2:ATM负责协调细胞对DSB和复制应激的反应。ATR是细胞复制应激反应的重要调节因子。CHK1和CHK2负责下调CDKs的活性,从而阻止应激下细胞周期的进展。ATM在多种肿瘤中经常发生突变或失活,包括肺癌、乳腺癌、脑癌和胰腺癌,ATM突变可以作为子宫内膜癌免疫检查点治疗的独立预后因素和潜在生物标志物。
8 肿瘤促进炎症
TNF-α:与正常组织相比,各种癌前病变中TNF-α水平异常升高,如胃病变和炎症性肠病,也在多种恶性肿瘤的肿瘤和基质中过表达,包括乳腺癌、卵巢癌、结直肠癌、前列腺癌、膀胱癌、食道癌、肾细胞癌、黑色素瘤、淋巴瘤和白血病。总之,TNF-α是连接炎症和肿瘤发生的关键调节因子,它可能是一种有希望的肿瘤炎症预后和治疗生物标志物。
NF -κB:NF-κB是一种二聚体转录因子,促进参与细胞周期、增殖、抗凋亡和促进转移的各种基因的转录,最终促进细胞生长、血管生成、干细胞形成和细胞代谢,在多种血液学和实体肿瘤中被激活。NF-κB通过诱导EMT转录因子调控EMT转化。总之,NF-κB是肿瘤炎症的预后生物标志物。
NLRP3:高水平的NLRP3与肿瘤晚期、远处转移和肿瘤的血管侵袭相关。NLRP3炎症小体激活导致炎症反应,促进癌症的发生和进展,NLRP3可能作为肿瘤的预后和治疗生物标志物。
9 细胞代谢失调
GLUT1:肿瘤细胞中GLUT1的表达显著上调,从而促进葡萄糖摄取。GLUT1过表达是多种癌症预后不良的重要生物标志物。研究表明,靶向GLUT的抑制剂是一种有效的癌症治疗策略综上所述,GLUT1是肿瘤糖代谢的重要靶点,可作为肿瘤的诊断性生物标志物。
IDH1/2:突变型IDH导致D2HG在细胞内大量积累,导致组蛋白和DNA甲基化失调,最终促进肿瘤进展。IDH1/2突变可作为易于检测、可靠和特异性的生物标志物。此外,考虑到D2HG在IDH突变的肿瘤中表达上调,肿瘤组织中D2HG水平升高可作为临床IDH突变肿瘤的无创检测生物标志物。总之,IDH1/2突变是有意义的肿瘤代谢诊断生物标志物。
HK2:HK2过表达与实体肿瘤中更差的OS和PFS显著相关。例如,在HCC、胃癌和CRC患者中观察到HK2对OS的负面影响。HK2表达与晚期和高级别卵巢癌相关,HK2下调抑制肿瘤发生。因此,HK2是一种有意义的肿瘤预后生物标志物和潜在的肿瘤治疗靶点。
10 免疫逃逸
PD-1 / PD-L1:PD-1和PD-L1参与癌细胞对免疫系统的逃逸。PD-1在多种癌症的肿瘤浸润淋巴细胞中高度表达。在接受免疫检查点阻断治疗的晚期癌症患者中,高可溶性PD-L1是PFS和OS降低的预测和预后生物标志物。阻断PD-1/PD-L1相互作用的免疫检查点抑制剂延长了各种癌症患者的生存期。总之,PD-/PD- l1的表达可以作为癌症预测和预后的生物标志物。
CATL-4:CTLA-4是一种常见于活化T细胞的抑制检查点,促进肿瘤逃避宿主免疫监视,并参与多种癌症的免疫失调。靶向CTLA-4可显著改善多种晚期癌症的预后。然而,在不同的癌症中,CTLA-4表达与患者预后之间的相关性存在争议。CTLA-4过表达的NSCLC与死亡率降低相关,是一个良好的预后生物标志物。相反,高CTLA-4的恶性胸膜间皮瘤预后较差。总之,CTLA-4是癌症的预后生物标志物,其阳性或阴性作用取决于特定的癌症情况。
11 解锁表型可塑性
打开表型可塑性以逃避终末分化状态是癌症发展的关键组成部分。分化和去分化在许多肿瘤的发育过程中是必不可少的,比如黑色素细胞在肿瘤发生过程中经历去分化,胰岛细胞癌向易转移癌的恶性进展与去分化有关。分化相关基因,如HMGCS2、BDH1、ALDH2、PIPOX、HAO1、AQP9和PAH,可预测多种癌症的生存和不良预后。总之,分化相关因子可以作为癌症诊断和预后的生物标志物。
12 非突变表观遗传重编程
12.1 DNA甲基化:DNA甲基化在染色质转录调控、表观遗传基因表达、基因组稳定性、DNA修复和复制中起着至关重要的作用。CpG岛对基因转录调控和肿瘤恶性转化至关重要。在各种癌症基因组中,5-10%的CpG启动子岛异常甲基化。目前只有13种基于DNA甲基化的生物标志物可供商业使用和检测,包括GSTP1、APC、RASSF1、NDRG4、BMP3、SEPT9、SHOX2、TWIST1、OTX1、ONECUT2、MGMT、BCAT1和IKZF1。其中只有9个(GSTP1, APC, RASSF1, NDRG4, BMP3,两个SEPT9生物标志物SHOX2和MGMT)被纳入临床指南应用。总之,肿瘤DNA甲基化是一种临床有价值的肿瘤治疗生物标志物。
12.2 组蛋白修饰:组蛋白的修饰,如乙酰化、甲基化、磷酸化和泛素化,可以改变DNA可及性,从而干扰基因表达。组蛋白修饰总体水平的变化可以预测各种癌症的临床结果。
HAT:组蛋白乙酰化与开放的染色质构象有关。HATs和HDAC家族调节组蛋白的乙酰化。HAT与许多实体肿瘤和血液系统恶性肿瘤有关,它们的表达水平在肿瘤进展过程中发生改变。
HMT:组蛋白甲基化最典型的位点是赖氨酸残基的单甲基化、二甲基化或三甲基化,包括H3K4、H3K9、H3K27、H3K36、H3K79和H4K20。其中,H3K4、H3K36、H3K79与正染色质活性基因相关,H3K9、H3K27、H4K2与基因组异染色质区相关。
HDAC:HDAC通过介导恶性肿瘤中的异常基因沉默促进白血病的发展。抑制HDACs可诱导肿瘤细胞生长停滞、分化和凋亡。此外,研究表明HDAC通常与肿瘤预后不良有关。
HDMTs:LSD1 (KDM1A)是一类去甲基酶,在多种癌症中升高,它与神经母细胞瘤细胞的分化有关。此外,HDMT还参与了乳腺癌、PDAC和其他致瘤过程的发展
13 多态性微生物组
微生物群可以影响微环境、肿瘤发生和各种恶性肿瘤的转移,对各种癌症的发展起着至关重要的作用,包括胃癌、卵巢癌、CRC、胰腺癌、前列腺癌、HCC、肺癌、乳腺癌、胆管癌。微生物群促进癌变的调节机制主要有三大类:改变宿主细胞增殖和死亡的平衡,如DNA损伤和DNA修复;调节组织内致瘤性炎症环境和免疫系统功能;影响宿主的新陈代谢。因此,靶向微生物群的小分子药物已成为抗肿瘤治疗的研究热点。已知的致癌性菌群包括但不限于胆道癌中的伤寒沙门氏菌和幽门螺杆菌,胃癌中的幽门螺杆菌等。微生物群对癌症的发展至关重要,微生物群可以作为肿瘤的潜在生物标志物。
14 衰老细胞
衰老相关分泌表型(SASP):SASP涉及大量生物活性蛋白趋化因子、细胞因子和蛋白酶的释放,在肿瘤发生过程中具有双刃剑效应。SASP通过维持衰老程序,以及招募免疫细胞表现出肿瘤抑制作用。但一些SASP因子是致瘤性的。总的说来,NF-kB调控的SASP因子具有肿瘤抑制和免疫监视作用,而STAT3调控的SASP因子具有肿瘤促进和免疫抑制作用。
Lamin B1:Lamin B1调节细胞核和细胞骨架组织、机械稳定性、染色质组织、基因调控、基因组稳定性、分化。多种衰老细胞中Lamin B1表达减少,其过表达可延缓衰老。在大多数肿瘤组织中广泛观察到Lamin B1上调。高水平的lamin B1表达预示着较差的OS和DFS。Lamin B1表达升高表明HCC预后和免疫治疗反应较差。综上所述,Lamin B1的丢失是一种与衰老相关的生物标志物。
五 液体活检肿瘤生物标志物
ctDNA:ctDNA已成为液体活组织检查的重要生物标志物,用于预测对靶向治疗和免疫治疗的反应,从而指导临床抗癌治疗。ctDNA分析被用于临床实时监测多种肿瘤的治疗反应,包括乳腺癌、 NSCLC、前列腺癌、胃食管癌、HCC和CRC,还被用于监测临床癌症治疗耐药性。综上所述,ctDNA在晚期实体瘤患者中广泛应用于MRD的检测、早期复发的监测、治疗反应的预测以及耐药性的监测。
CTC:CTC作为转移性癌症患者的临床管理和精准医疗实施的生物标志物具有临床意义,可评价预后信息、复发和转移风险、实时分层监测治疗、确定肿瘤患者的治疗靶点和耐药机制。CTC检测和分子表征已应用于乳腺癌、结直肠癌、前列腺癌、肺癌、胰腺癌、多形性胶质母细胞瘤和黑色素瘤患者的分层,并监测疾病进展。综上所述,CTC分析是一种临床相关的无创工具,可以监测癌症的进展和预后,具有促进癌症个性化精准治疗的潜力。
外泌体:外泌体已被证明参与肿瘤的发展、血管生成、转移和治疗耐药性,并可作为肿瘤患者的诊断和预后生物标志物。血清外泌体中DNA已被证明在检测癌症相关突变中具有重要价值,如KRAS和TP53。癌细胞与正常细胞外泌体中差异表达的特异性miRNA在癌症的早期检测中具有重要的诊断或预后价值。此外,来自癌细胞的外泌体可以有效调节TME转移部位的血管生成和细胞外基质重塑,从而促进肿瘤的生长和转移。癌细胞分泌的外泌体还可以直接与药物相互作用,降低其抗肿瘤功效,或通过TEM细胞的外泌体调节癌细胞基因表达,有利于细胞存活。综上所述,外泌体是癌症早期诊断、预后预测和疗效评估的重要生物标志物。
六 结论与展望
肿瘤生物标志物,由六种不同类型的生物标志物组成,包括早期检测、诊断、预后、预测、治疗靶点和替代终点标志物。尽管肿瘤生物标志物在癌症精准医疗中越来越重要,但从发现到临床试验的生物标志物数量很少,未来仍有一些挑战亟待解决。
首先,肿瘤生物标志物的特征和浓度受到不同生物因素的影响,如治疗后、宿主异质性、年龄和不同个体之间存在其他疾病、其他生理或病理过程产生的假阳性生物标志物,以及外源性干扰物质,即食物、药物和自然替代疗法。
其次,迫切需要探索新的工具或技术,以发现新的和准确的生物标志物来检测癌前肿瘤、微转移扩散和早期或侵袭性癌症复发状态。
第三,分析灵敏度和特异性仍然存在局限性。标准的程序、明确的指南和质量控制方案对于确保生物标志物开发的准确性和可重复性至关重要。
第四,当从数千个分子中识别生物标志物时,假阳性的风险很高。需要平衡多次大规模筛查的成本和过度诊断假阳性风险的增加。遵守肿瘤生物标志物的指南可以提高透明度,更好地判断推定的生物标志物鉴定的质量。人工智能为大规模筛选可用数据和开发新的肿瘤生物标志物提供了一个有趣的机会。
最后,合理组合各种生物标志物可以提高生物标志物应用的效率和准确性。需要进行广泛的研究,同时使用新技术。
创新型肿瘤生物标志物的不断研发和新型检测技术的不断发展,将使敏感、特异的肿瘤生物标志物逐步应用于临床实践,使肿瘤的早期筛查、诊断、治疗和预后评估成为现实。


