Nat Commun:上海交通大学赵维莅团队发现CAR-T治疗复发/难治性弥漫性大B细胞淋巴瘤产生耐药性的潜在机理
时间:2024-06-24 12:01:34 热度:37.1℃ 作者:网络
嵌合抗原受体T (CAR-T)细胞疗法在复发/难治性弥漫性大B细胞淋巴瘤(DLBCL)的早期试验中显示出有希望的疗效。然而,其治疗原发性难治性DLBCL的疗效尚未全面研究,潜在的耐药机制尚不清楚。
2024年6月18日,上海交通大学赵维莅团队在Nature Communications 在线发表题为“Cholesterol efflux from C1QB-expressing macrophages is associated with resistance to chimeric antigen receptor T cell therapy in primary refractory diffuse large B cell lymphoma”的研究论文,该研究报告了一项I期、开放标签、单臂临床试验的结果,relmacabtagene autoeucel (relma-cel)是一种靶向CD19的CAR-T细胞产品,以安全性和有效性为主要终点。
在12名入组患者中,8名患者出现了4级血液毒性治疗出现的不良事件。未发生≥3级细胞因子释放综合征或神经毒性。单细胞RNA测序显示,在CAR-T细胞治疗前,进展性疾病患者中表达C1QB的巨噬细胞比例增加。研究发现,M2巨噬细胞的胆固醇外排通过诱导CD8+ T细胞的免疫抑制状态,导致其衰竭,从而抑制CAR-T细胞的细胞毒性。巨噬细胞与CD8+ T细胞之间可能的相互作用,介导脂质代谢(AFR1-FAS),免疫检查点激活和T细胞衰竭(LGALS9-HAVCR2, CD86-CTLA4和NECTIN2-TIGIT)在疾病进展中增强。这些发现表明,巨噬细胞的胆固醇外排可能触发CD8+ T细胞衰竭,为代谢重编程以抵消CAR-T治疗失败提供了理论依据。

弥漫性大B细胞淋巴瘤(DLBCL)是一种异质性B细胞淋巴瘤,通常表现为侵袭性或晚期疾病,占所有新诊断的非霍奇金淋巴瘤的30-40%。化疗联合利妥昔单抗(CD20靶向抗体)可显著改善DLBCL患者的预后。然而,大约20%的原发性难治性DLBCL患者预后不佳,中位总生存期(OS)仅为7.1个月。一些研究已经证明靶向CD19的嵌合抗原受体T (CAR-T)细胞疗法治疗复发/难治性DLBCL的疗效和可控的不良反应。
在ZUMA-7和TRANSFORM试验中,二线CAR-T细胞疗法被证明优于标准治疗化疗,无论是否采用自体干细胞移植(ASCT),但据报道,原发性难治性患者的生存率低于r/r DLBCL患者,这突出了进一步提高该人群疗效的必要性。此外,在这些试验中,大约60%的患者在CAR-T细胞治疗后出现了进行性疾病(PD),中位疾病控制期为6个月。因此,了解原发性难治性DLBCL患者对CAR-T细胞治疗耐药的机制至关重要。
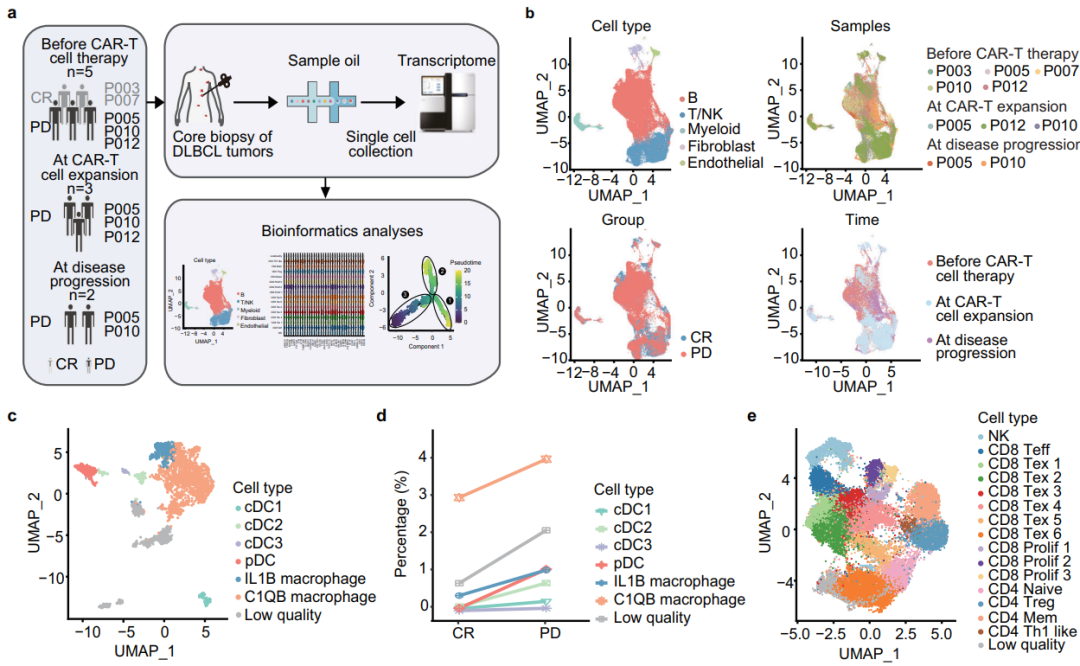
CAR-T细胞治疗前CR和PD患者的肿瘤微环境特征(图源自Nature Communications )
肿瘤微环境(tumor microenvironment, TME)在CAR-T细胞耐药过程中起重要作用。TME的免疫抑制性质促进CAR-T细胞衰竭,是临床治疗效果的主要障碍。据报道,M2巨噬细胞的代谢重编程可以调节免疫治疗的疗效和T细胞功能。事实上,胆固醇已被证明可诱导TME内的免疫检查点表达和CD8+ T细胞衰竭。然而,CAR-T细胞治疗后DLBCL患者TME的特定代谢特征,特别是M2巨噬细胞的代谢特征仍然非常有趣。relmacabtagene autoeucel (relma-cel)是一种CD19靶向CAR-T细胞产品,具有4-1BB共刺激结构域,一项I期研究证实了CAR-T细胞治疗r/r DLBCL的初步安全性和有效性。这一发现支持了relma-cell治疗原发性难治性DLBCL (JWCAR029-003)的I期、单臂、开放标签、多中心临床试验的合理设计和启动。
该研究报告了该试验的结果,包括CAR-T细胞治疗原发性难治性DLBCL患者的安全性和有效性。此外,该研究利用单细胞RNA测序(scRNA-seq)探索了这些患者对CAR-T细胞治疗耐药的机制。
参考消息:
https://www.nature.com/articles/s41467-024-49495-4


