钇-90凭何脱颖而出?
时间:2024-07-03 11:02:53 热度:37.1℃ 作者:网络
钇-90凭何脱颖而出
——和肝癌肿瘤异质性与免疫逃逸机制的关系
PART.01 钇-90的本地化进程
钇‑90微球选择性内放射治疗(90Y‑SIRT,也称为放射栓塞术)是治疗肝癌的重要手段,通过数字数字减影血管造影(DSA)引导下肝动脉插管介入方法,将数千万粒高能纯β辐射体的钇[90Y]树脂微球植入至肝脏肿瘤供血动脉内,从肿瘤内部进行近距离辐射照射,实现对肝脏肿瘤的精准打击。虽然中国专家们早前就有接触过90Y‑SIRT,但对该技术的了解多停留在理论层面,亲自实施和观摩的机会很少。直到2021年9月28日,董家鸿院士团队在海南成功实施了中国首例特许准入SIR-Spheres钇[90Y]微球注射液精准介入手术。【接受手术的患者临床诊断为巨块型肝细胞癌伴门静脉侵犯,肿瘤长径10.2cm,甲胎蛋白(AFP)180644ng/ml。术后3个多月增强CT及MRI影像复查结果显示,肿瘤病灶完全缓解,无活性病灶(mRECIST),AFP水平降至335.76ng/ml。】尽管实践经验还较少,《钇-90(90Y)微球选择性内放射治疗原发性和转移性肝癌的中国专家共识》[1]和《钇90微球管理专家共识》[2]于同年发布,制定人员以核医学科专家为主,主要针对原发性肝癌和转移性肝癌两大类疾病。
2022年1月30日,国家药品监督管理局(NMPA)批准了远大医药集团的联营公司Sirtex Medical Pty LtdSirtex的钇[90Y]微球注射液的上市申请,适应症为经标准治疗失败的不可手术切除的结直肠癌肝转移,这是我国首款批准上市的治疗结直肠癌肝转移产品,该产品也是食品药品监督管理局(FDA)正式批准的第一款正式用于结直肠肝转移的放射性微球产品(PMA),标志着我国内放射治疗的国际标准化。2022年5月7日,该产品钇[90Y]微球在国内正式投入应用。
如今经过两年多的临床实践积累,为使这项技术得到更好地推广应用,规范性文件《钇‑90微球选择性内放射治疗肝脏恶性肿瘤规范化操作专家共识(2024版)》[3]于2024年2月发布。新共识内容涉及适应证、禁忌证、术前影响评估、技术应用、场景管理、剂量计算等。专家阵容领域扩展,增加了介入科专家、肝胆外科专家和影像学专家等。适应症也放宽到肝脏恶性肿瘤,不再局限于原发性肝癌和转移性肝癌。产品覆盖更全面,客观描述了90Y玻璃微球和90Y树脂微球等产品特性。
对大多数肝癌患者来说,90Y-SIRT无疑是给了他们再生的希望。超过70%的肝癌患者晚期才被诊断出来,此时总生存期(OS)少于30个月,还常合并各种严重并发症,再加上可移植的供体肝源非常有限,化疗效果不佳,仅有10%左右的肝细胞癌患者能够进行根治性治疗。90Y-SIRT优势在于其高效的癌症控制,同时还避免了体外放射造成的部分组织功能丧失以及脱发等副作用。此外,在首次治疗前约一周时,需进行肠系膜血管造影及锝99m(Tc 99m)标记的多聚白蛋白(macroaggregated albumin,MAA)扫描,但该流程通常后续治疗中一般不需重复。
PART.02 钇-90在肝癌治疗中和肿瘤异质性与免疫逃逸机制的关系
肝细胞癌(HCC)是全球癌症相关死亡的第三大原因。预计到2040年,肝癌新发病例和死亡人数预计将增加55%以上[4]。不幸的是,HCC中已知的驱动突变,即TERT、TP53、CTNNB1,不是药物靶向的,而且HCC以其对全身治疗的耐药性而闻名[5,6]。人们开始在晚期HCC患者中开展免疫检查点抑制剂(ICI)的临床试验,因为免疫检查点分子在肿瘤细胞的免疫逃避中起着至关重要的作用。终于在2020年,HCC全身治疗领域的一个新的里程碑:IMBRAVE-150研究表明,阿替利珠单抗(抗PDL1)和贝伐单抗(抗血管内皮生长因子[VEGF])的联合治疗比索拉非尼有5.8个月的生存优势[7。两年后,根据HIMALAYA研究,durvalumab(抗PDL1)和tremelimumab(抗CTLA4)的联合治疗也被FDA批准作为不可切除的HCC(无门静脉主干侵犯)的一线治疗[8]。尽管取得了这一突破,但由于肿瘤内异质性、复杂的肿瘤微环境和缺乏预测性生物标志物,晚期HCC使用阿替利珠单抗和贝伐单抗的最佳总体反应率仅为30%,而使用度伐利珠单抗加曲美木单抗的最佳总体反应率仅为20.1%[9,10],对HCC的临床管理提出了严峻挑战。
HCC的肿瘤内异质性(ITH)
癌细胞通过获得基因突变来逃避人体的自然防御能力,这些基因突变可以避免细胞凋亡和衰老,促进血管生成和转移,改变细胞代谢以在有限的营养和氧气供应下支持快速增殖,并引发微环境变化以逃避免疫监视[8]。HCC的发展类型多种多样,也就具有不同的微环境,这些微环境刺激癌细胞在遗传、表观遗传和代谢水平上进行广泛的重编程,以适应和维持其生长[9]。肿瘤生态系统的进化受到的刺激包括来自癌症基因组内在不稳定性以及免疫调节和治疗暴露等外在环境的选择压力所驱动[10]。HCC中还有一个重要刺激是肿瘤缺氧。由于HCC高度血管化,血管生成失调会导致肿瘤微环境缺氧[11,12]。为了应对缺氧,肿瘤生态系统会发生遗传和代谢重编程[13]。
HCC肿瘤微环境
肝脏是一种免疫特权器官,通过复杂的免疫细胞环境以及促炎和抗炎细胞因子维持免疫耐受和免疫激活之间的平衡[14]。比如肝脏从门脉循环接收血流,门脉循环将来自胃肠道的各种细菌抗原带入肝脏,导致肝脏大量抗原暴露和持续的免疫刺激[15]。为了保护器官免受自身免疫损伤,肝脏在先天性和适应性免疫反应中发展出了免疫耐受机制[16,17]。
癌症的标志之一是能够逃避宿主的免疫系统,从而继续生长和转移[18]。ITH产生的HCC肿瘤亚克隆被迫通过破坏免疫检查点通路来促进免疫逃避,从而存活下来[19,20]。
就亚洲肝癌患者而言,其分子亚型(C2)的特征是CD4+记忆T细胞增多、Treg细胞减少和白细胞浸润增多,这表明免疫“热”肿瘤与良好的结果相关[21]。研究结果表明肿瘤浸润免疫细胞在抑制肿瘤进展中起着至关重要的作用。免疫浸润增加(“热”免疫微环境)的肿瘤与更有利的结果相关,而逃避免疫机制会导致较差的生存结果和对免疫疗法的敏感性降低。
免疫逃避对治疗结果的影响
局部区域治疗是治疗中晚期HCC的标准方法,有助于减轻和控制疾病负担并延长生存期。其中的经动脉治疗方式,包括经动脉栓塞(TAE)、化学栓塞(TACE)和放射栓塞(TARE)。尽管治疗方式相似,但这些疗法治疗后的肿瘤生物学结果明显不同。
TACE涉及施用与碘油混合的化疗药物(阿霉素或顺铂)以阻塞肿瘤供血动脉,从而导致肿瘤缺氧和缺血性坏死[22,23]。考虑到Suthen等人的发现。[24],有理由假设,TACE诱导的肿瘤缺氧将导致缺氧相关基因上调,进而将创造免疫抑制肿瘤微环境,可能降低TACE后ICI单药治疗的疗效。最近发表的IMBrave050试验研究了肝切除术或射频消融(RFA)后辅助阿替利珠单抗和贝伐单抗的疗效,该研究有意思的发现在术后切除术/RFA后接受TACE,随后接受辅助阿替利珠单抗和贝伐单抗的患者比未接受TACE的患者表现更差[25]。2024年美国临床肿瘤学会(ASCO)GI会议上公布的EMERALD-1试验的最新结果评估了TACE附加durvalumab(抗PDL1)/贝伐单抗的益处,并描述了TACE后接受durvalumab和贝伐单抗联合治疗(而非durvalumab单药治疗)的患者的无进展生存期(PFS)改善[26]。这表明添加抗VEGF药物(贝伐单抗)可使异常血管生成正常化,增加免疫细胞的肿瘤浸润,并作为免疫刺激剂与ICI结合以克服TACE后的缺氧TME。然而,近一半(46.9%)的试验患者的肿瘤负担相对较小(在7个标准内),治疗组治疗相关死亡率明显较高(D+TACE为9.1%,D+B+TACE为10.4%,而单独TACE为5.5%)。
钇-90(Y-90)选择性内放射疗法用于中晚期HCC包括伴有门静脉侵犯的HCC的局部区域治疗,该方法已反复证明具有非常好的疗效和安全性[27,28]。由于Y-90微球比TACE使用的颗粒小得多,治疗后小动脉栓塞最少,因此杀肿瘤作用主要由放射损伤而不是缺血性改变介导,还可导致免疫激活增强[29,30]。
通过CyTOF和NGS分析了41名接受Y-90放射栓塞治疗的HCC患者,包括降期后接受肝切除术的患者肿瘤样本的免疫状况,发现接受Y-90放射栓塞治疗的肿瘤具有更高的颗粒酶B(GZB)+、CD8+T细胞、CD56+NK细胞和CD8+CD56+NKT细胞。与对照组相比,接受Y-90治疗的肿瘤中还发现先天性和适应性免疫激活基因上调,表明存在局部免疫激活。比较放射栓塞前后的PBMC样本,发现Y-90治疗后肿瘤坏死因子-α(TNFα)+CD8+和CD4+T细胞增加,表明全身免疫激活增加[29,30]。从外周血样本证实了接受Y-90治疗的患者中活化CD3+T细胞和CD8+亚群、Treg和炎症单核细胞群(PDL1+、HLA-DR+)的频率增加[30]。PD1+CD3+T细胞的频率在Y-90放射栓塞后1个月达到峰值,并在3个月内迅速恢复到基线水平。临床结果较好的患者在Y-90治疗后诱导的GZB+Ki67+CD4+T细胞水平较高(图1)。此外,Craciun等人比较了术前TACE或Y-90放射栓塞治疗后切除的HCC中的肿瘤内免疫浸润。与上述研究一致,在Y-90放射栓塞后切除的HCC中TIL和GZB表达显著增加,尤其是接受>100 Gy的患者[31]。而在术前接受或未接受TACE治疗的患者样本中,免疫浸润无差异。
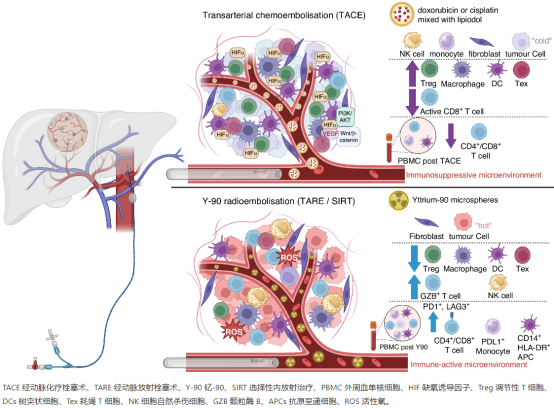
图 1:经动脉化疗栓塞与 Y-90 放射栓塞后肿瘤免疫微环境改变。
总的来说,研究表明Y-90放射栓塞改变了肿瘤生物学,并创造了一个免疫“热”肿瘤微环境,这可能会增强后续免疫治疗的反应。
参考文献:
[1] 中国临床肿瘤学会核医学专家委员会, 北京市核医学质量控制和改进中心. 钇‑90(90Y)微球选择性内放射治疗原发性和转移性肝癌的中国专家共识[J]. 中华肝脏病杂志, 2021, 29(7): 648‑658. DOI: 10.3760/cma. j. cn501113‑20210302‑00103.
[2] 中国抗癌协会肿瘤介入学专业委员会, 国家卫生健康委能力建设和继续教育中心介入医学专家委员会, 宋莉, 等. 钇90微球管理专家共识[J]. 中国介入影像与治疗学, 2021,18(6): 321‑325. DOI: 10.13929/j. issn. 1672‑8475.2021.06.001.
[3] 中国医师协会介入医师分会临床诊疗指南专委会, 中国研究型医院学会肝胆胰外科专业委员会. 钇‑90微球选择性内放射治疗肝脏恶性肿瘤规范化操作专家共识(2024版)[J]. 中华医学杂志, 2024, 104(7): 486-498. DOI: 10.3760/cma.j.cn112137-20231025-00894.


