指南更新 | 多部实体瘤NCCN指南新增瑞普替尼推荐!(乳腺癌、结肠癌、直肠癌、胆道癌、肝细胞癌……)
时间:2024-07-07 06:00:44 热度:37.1℃ 作者:网络
继2024年6月26日非小细胞肺癌NCCN指南率先新增瑞普替尼后,近日乳腺癌、结肠癌、直肠癌、胆道癌、肝细胞癌NCCN指南相继新增瑞普替尼治疗晚期NTRK融合阳性肿瘤推荐。详细更新内容如下:
01 更新内容
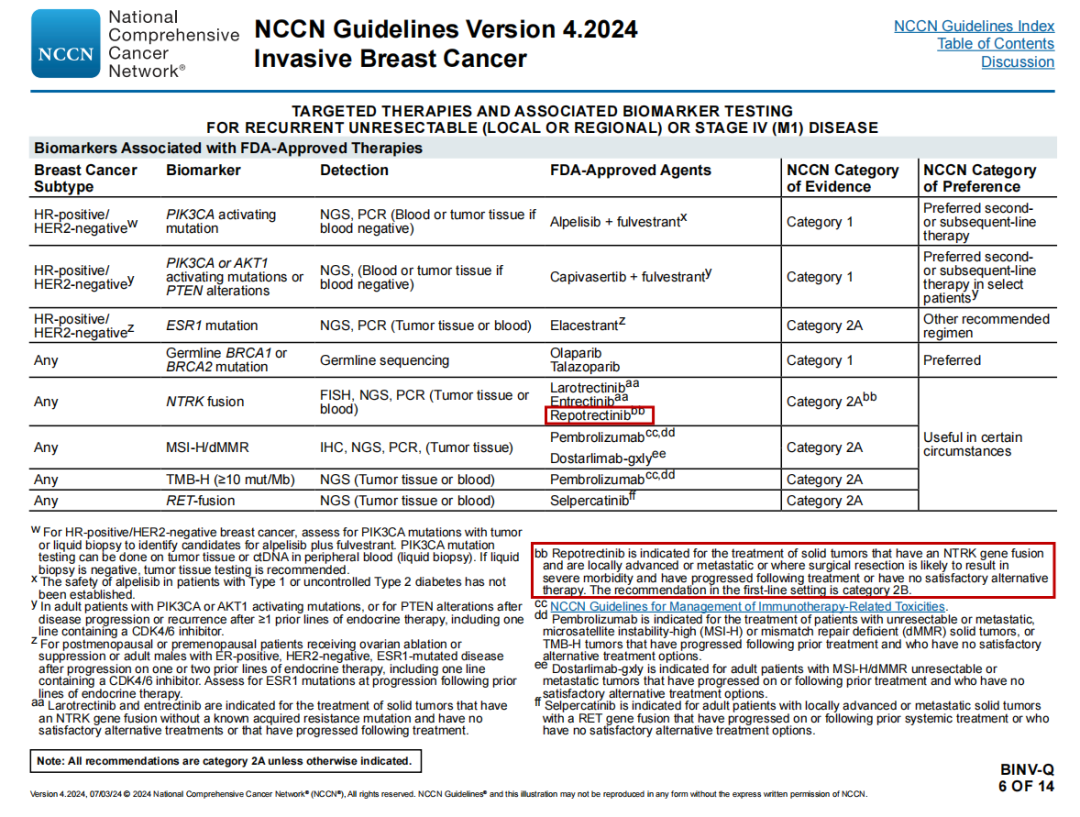
乳腺癌(2024.V4)
复发性不可切除(局部或区域)或Ⅳ期(M1)疾病的靶向治疗和相关生物标志物检测
FDA批准的治疗相关的生物标志物
-
NTRK融合:新增“瑞普替尼”
-
新增脚注bb:瑞普替尼适用于具有NTRK基因融合、局部晚期或转移性、手术切除可能导致严重并发症、治疗后进展或没有满意的替代疗法的实体瘤的治疗。在一线阶段的推荐为2B类
结肠癌(2024.V4)
连续治疗——晚期或转移性疾病的全身治疗
pMMR/MSS(或不适合或接受检查点抑制剂免疫治疗时疾病进展的dMMR/MSI-H或POLE/POLD1突变)
二线和后续治疗方案(如果既往未使用)
-
生物标志物导向治疗
🔹 NTRK基因融合阳性:新增“瑞普替尼”
🔹 新增脚注w:在TRIDENT-1试验中,瑞普替尼在NTRK TKI初治和经治患者中均显示临床活性


晚期或转移性疾病全身治疗——化疗方案
-
新增“瑞普替尼(NTRK基因融合阳性)剂量说明”:前14天160 mg PO,每日一次,然后增加至160 mg PO,每日两次

直肠癌(2024.V3)
连续治疗——晚期或转移性疾病的全身治疗
pMMR/MSS(或不适合或接受检查点抑制剂免疫治疗时疾病进展的dMMR/MSI-H或POLE/POLD1突变)
二线和后续治疗方案(如果既往未使用)
-
生物标志物导向治疗
🔹 NTRK基因融合阳性:新增“瑞普替尼”
🔹 新增脚注v:在TRIDENT-1试验中,瑞普替尼在NTRK TKI初治和经治患者中均显示临床活性


晚期或转移性疾病全身治疗——化疗方案
-
新增“瑞普替尼(NTRK基因融合阳性)剂量说明”:前14天160 mg PO,每日一次,然后增加至160 mg PO,每日两次

胆道癌(2024.V3)
全身治疗原则
靶向治疗
不可切除或转移性疾病的初始治疗和如果疾病进展胆道癌的后线治疗
-
某些情况下有用:
🔹 对于NTRK基因融合阳性肿瘤:新增“瑞普替尼”

肝细胞癌(2024.V2)
全身治疗原则
一线全身治疗
-
某些情况下有用:
🔹 新增“对于NTRK基因融合阳性肿瘤:瑞普替尼(2B类)”

02 更新依据
各瘤种瑞普替尼方案的新增基于一项多中心、单臂、开放、Ⅰ/Ⅱ期研究1(TRIDENT-1研究;NCT03093116),该研究旨在评估瑞普替尼治疗包括NSCLC在内的ROS1/NTRK融合阳性晚期实体瘤的疗效和安全性。2023 ESMO会议公布了该研究NTRK融合阳性队列的最新疗效和安全性数据。
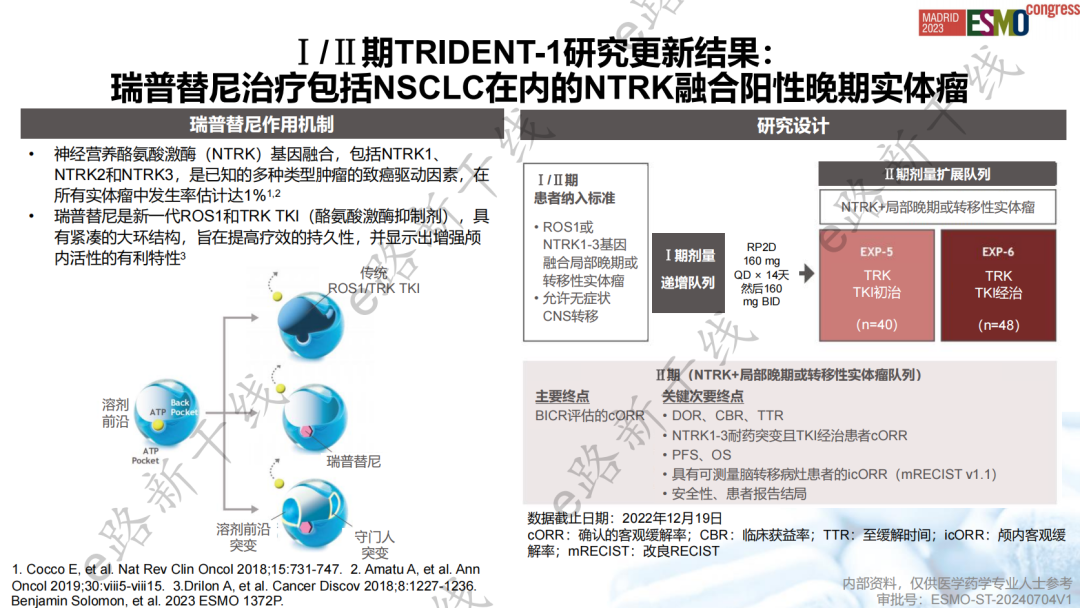
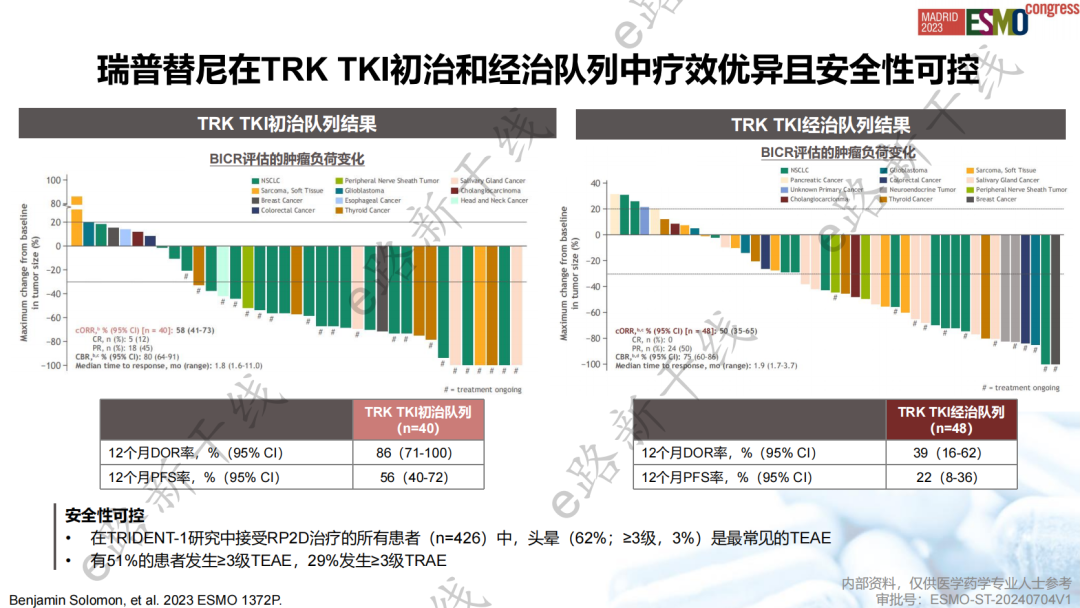
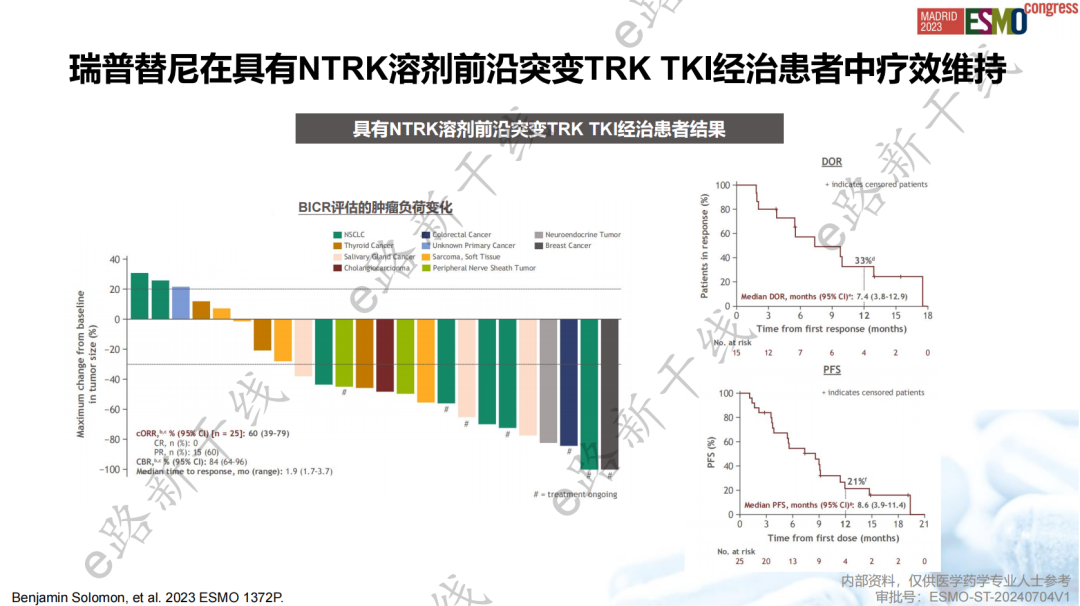
研究结果显示,在TRK TKI初治患者中,cORR为58%(95% CI,41-73),12个月DOR率为86%(95% CI,71-100),12个月PFS率为56%(95% CI,40-72);在TRK TKI经治患者中,cORR为50%(95% CI,35-65),12个月DOR率为39%(95% CI,16-62),12个月PFS率为22%(95% CI,8-36),在NTRK溶剂前沿突变存在的情况下临床活性得以维持。
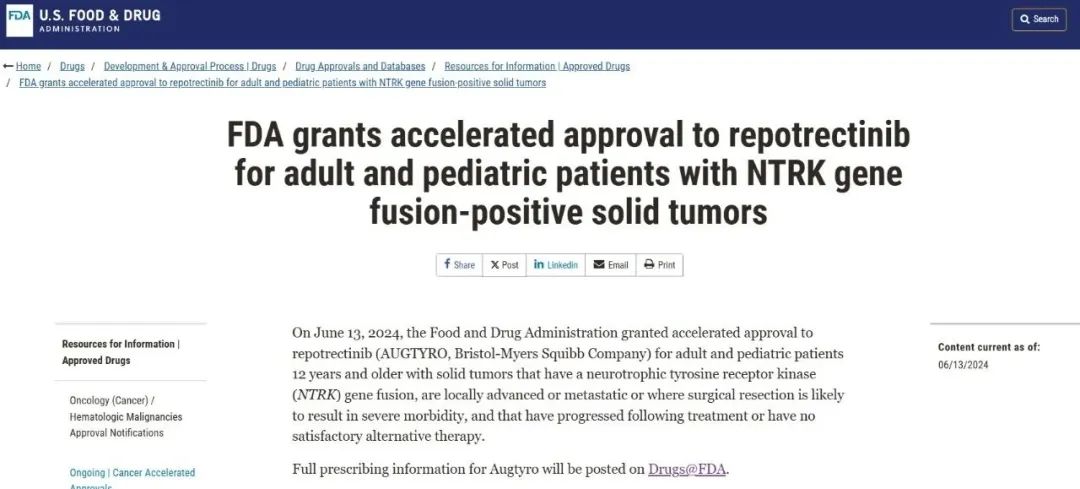
2024年6月13日,基于TRIDENT-1研究的积极结果,FDA加速批准了瑞普替尼治疗NTRK基因融合阳性实体瘤成人和儿童患者。
03 总结
NTRK融合已被确定为多种实体瘤成人和儿童患者的致癌驱动因素。总体而言,实体瘤NTRK融合阳性率低,整体约为1%,针对该靶点治疗药物的选择有限。早期TRK TKI的缓解持续时间可能受到获得性耐药突变的限制,如溶剂前沿突变,通常导致疾病进展。瑞普替尼作为新一代TRK TKI,在TRIDENT-1研究NTRK融合阳性多瘤种队列中显示出良好的治疗前景,包括具有溶剂前沿突变患者。期待随着研究的继续深入和随访时间的延长,瑞普替尼在NTRK融合及耐药的患者中展现更多优异数据。
参考文献:
1. Benjamin Solomon, et al. 2023 ESMO 1372P.
2. NCCN指南:乳腺癌(2024.V4).
3. NCCN指南:结肠癌(2024.V4).
4. NCCN指南:直肠癌(2024.V3).
5. NCCN指南:胆道癌(2024.V3).
6. NCCN指南:肝细胞癌(2024.V2).

