II期临床研究表明:激活iNKT细胞令肺癌患者生存期达21.9个月,疾病控制率42.9%,疗法安全耐受性好
时间:2024-07-22 12:00:41 热度:37.1℃ 作者:网络
亮点
1. 激活iNKT细胞后,晚期NSCLC患者的生存期长达21.9个月,1年生存率高达84.4%,近半数患者病灶病变稳定。
2. 激活iNKT细胞后,患者体内免疫细胞亚群数量大幅增多,超半数患者患者产生IFN-γ的细胞数量增加1.9倍,2年生存率高达50.0%。
3. 接受激活iNKT细胞疗法的患者未观察到严重不良事件,轻微不良症状会随着时间推移或人为干预得以消退,安全性良好。
一直以来,肺癌在全球范围内广泛存在,并逐渐发展成为癌症死亡的主要病因。据统计,每年约有160万肺癌患者因病去世,其中,非小细胞肺癌(NSCLC)约占所有原发肺癌的85%,且大多数患者在诊断时已是晚期,预后较差。
近年来,免疫疗法在晚期NSCLC治疗中显示出乎意料的效果,能有效提高患者生存率。其中,恒定自然杀伤T(iNKT)细胞在胸腺中发育,主要聚集在肝脏中,其高度特异性天然糖脂配体——α-半乳糖神经酰胺(α-GalCer)有助于激活iNKT细胞产生大量免疫调节因子(如IFN-γ);另一方面,活化的iNKT细胞能通过凋亡信号转导途径,释放穿孔素、颗粒酶B和肿瘤坏死因子(TNF-α)等,从而杀伤肿瘤。
近期,一项题为Phase II study of α-galactosylceramide-pulsed antigen-presenting cells in patients with advanced or recurrent non-small cell lung cancer的II期临床研究表明,通过注射α-GalCer激活体内iNKT细胞,能够延长晚期或复发性NSCLC患者生存期至21.9个月,近半数患者病情稳定,体内免疫细胞亚群数量显著提高,患者抗肿瘤反应与治疗前相比大幅改善。
研究起始,科研人员招募了年龄在20岁至75岁之间的35名患者,这些患者经组织学或细胞学均确诊为 NSCLC,所有患者已接受过全身一线化疗,包括铂类化疗或表皮生长因子受体酪氨酸激酶抑制剂(TKI)。
随后,他们令患者接受了外周血白细胞清除术,并通过密度梯度离心分离了患者的外周血单个核细胞(PBMC),再加入αGalCer培养,以获得αGalCer脉冲的抗原呈递细胞(APC)。研究人员将得到的αGalCer脉冲APC按照1×10^9个细胞/m^2的剂量,再次静脉注射回患者体内。随后,所有患者每周均接受一次完整的体格检查和实验室评估,整个随访时间最长达到27.2个月。
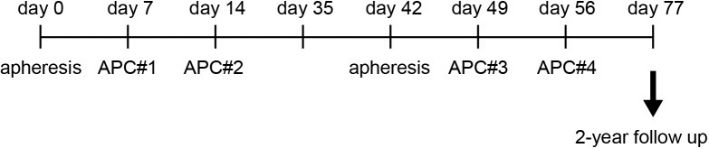
研究设计
一直以来,总生存期(OS)被认为是肿瘤临床试验中最佳的疗效终点,研究人员对所有患者的OS进行了系统评估。令人惊喜的是,所有患者的中位OS长达21.9个月,远远优于预期生存时间(17个月);其次,患者1年生存率竟高达84.4%,2年生存率也达到了惊人的40.6%。
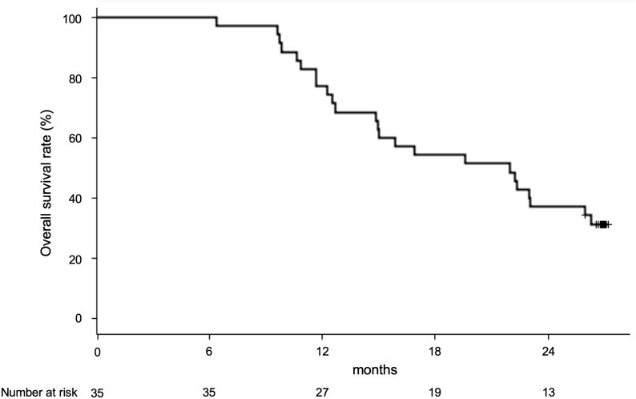
激活iNKT细胞后患者的总生存期
由此看来,这项针对iNKT细胞的免疫疗法令患者的存活时间得到了大幅延长。那么,患者病灶是否也得以缓解呢?
进一步的,研究人员对患者的进行了胸部CT扫描,以评估αGalCer脉冲APC治疗后患者体内的抗肿瘤反应。与生存期延长相对应的是,其中1例患者病灶已达到部分缓解(PR),14例患者病变稳定(SD)。总体而言,所有接受治疗的患者总体缓解率(RR)为2.9%,疾病控制率(DCR)高达42.9%,患者中位无进展生存期(PFS)达到2.8个月。
注:CR:所有靶病灶消失,无新病灶出现,且肿瘤标志物正常,至少维持4周;PR:肿瘤靶病灶最大径之和减少≥30%,至少维持4周;SD:肿瘤靶病灶最大径之和缩小未达PR,或增大未达PD;PD:肿瘤靶病灶最大径之和至少增加≥20%,或出现新病灶;RR:达到CR、PR的病人占同期病人总数的百分比;DCR:经治疗后获得缓解(PR+CR)和病变稳定(SD)的病例数占可评价例数的百分比;PFS:从随机化开始到肿瘤发生(任何方面)进展或(因任何原因)死亡之间的时间。
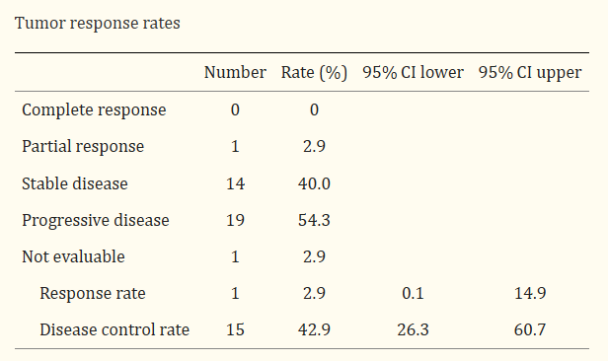
肿瘤反应率
接下来,为了更加“具象化”分析αGalCer脉冲APC疗法的免疫调节能力,研究人员仔细鉴定了患者PBMC中每个免疫细胞亚群。
有趣的是,他们发现治疗后,患者体内白细胞和淋巴细胞的数量明显增加,白细胞的从6.02×10^6增至6.74×10^6个/毫升,淋巴细胞从1.28×10^6增至1.45×10^6个/毫升。此外,自然杀伤(NK)细胞的数量明显增加,从1.25×10^5增至1.71×10^5个/毫升,效应CD8+ T细胞也在治疗期间从5.40×10^4个/毫升增到6.67×10^4个/毫升。以上充分说明了,α-GalCer脉冲APC疗法有效“调动”免疫群体的积极性,令更多的免疫细胞加入抗肿瘤战斗中。
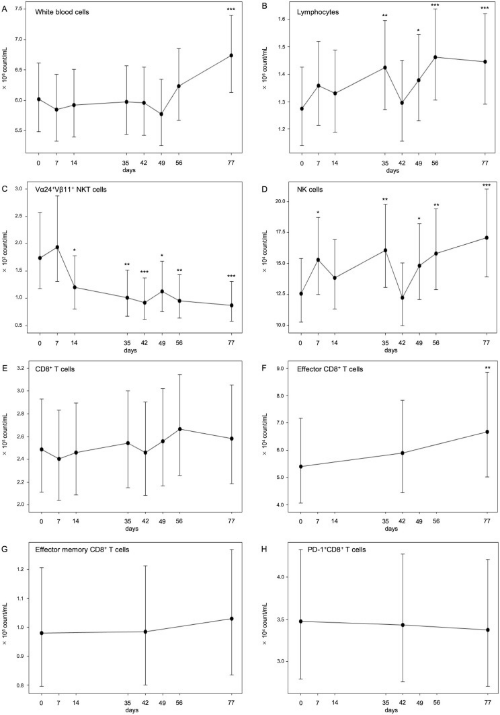
患者的免疫学监测
此时,研究者的脑海里产生了一个新的疑问:患者生存期大幅延长的关键原因究竟是什么呢?
巧合的是,已有临床研究表明,αGalCer脉冲APC注射后,产生IFN-γ的细胞数量增加与患者中位生存期延长有关,于是,他们立马评估了用αGalCer刺激后PBMC产生IFN-γ的能力。
果不其然,给予αGalCer脉冲APC后,共24名患者产生IFN-γ的细胞数量增加了1.9倍以上,被评估为“良好应答者”;仍有8名患者的 IFN-γ 生成能力变化极小(<1.9倍),被评估为“不良应答者”。有趣的是,良好应答者的生存期(24.4个月)与不良应答者(14.9个月)相比延长了近两倍;并且良好应答者的2年生存率高达50.0%,而不良应答者仅为12.5%。
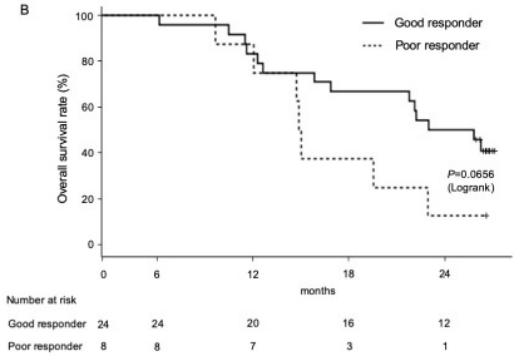
良好应答者和不良应答者的总生存期比较
最后,也是最重要的是,研究者对治疗后患者的不良反应进行了系统性评估。令人心安的是,未观察到与治疗相关的严重不良事件,仅有个别患者出现了短期眩晕、疼痛等症状,但随着时间推移或人为干预,不良反应均得以消退。
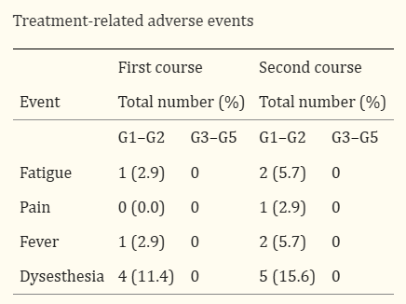
治疗相关不良事件
总的来说,这项II期临床研究发现,通过静脉注射αGalCer脉冲APC,激活iNKT细胞活性,能够促进患者体内抗肿瘤反应、延长生存期,且耐受性良好。这些结果令人大受鼓舞,相信随着医疗的发展,iNKT细胞疗法必将令更多癌症患者大受裨益。
来源:
微信公众号: 基因启明
参考文献
Toyoda T, Kamata T, Tanaka K, Ihara F, Takami M, Suzuki H, Nakajima T, Ikeuchi T, Kawasaki Y, Hanaoka H, Nakayama T, Yoshino I, Motohashi S. Phase II study of α-galactosylceramide-pulsed antigen-presenting cells in patients with advanced or recurrent non-small cell lung cancer. J Immunother Cancer. 2020 Mar;8(1):e000316. doi: 10.1136/jitc-2019-000316. PMID: 32188702; PMCID: PMC7078938.









