Adv Sci:王科嘉/朱永生/严鹏合作研究发现Ccl2诱导的调节性T细胞通过巨噬细胞极化调节肝内炎症环境
时间:2024-10-11 09:00:39 热度:37.1℃ 作者:网络
炎症被认为是帮助协调肝脏重建的初始因素。然而,控制肝脏重建过程中炎症的确切机制尚未完全阐明。
2024年10月1日,厦门大学王科嘉、西安交通大学朱永生、严鹏共同通讯在Advanced Science 在线发表题为“Ccl2-Induced Regulatory T Cells Balance Inflammation Through Macrophage Polarization During Liver Reconstitution”的研究论文。该研究中,肝脏重建过程中表现出明显的免疫反应。
抑制肝脏炎症反应会延缓肝脏再生。在此过程中,Ccl2主要由1型先天淋巴细胞(ILC1s)产生,ILC1衍生的Ccl2将外周ILC1s和调节性T细胞(Tregs)募集到肝脏。Ccl2或Tregs的缺失会加剧肝脏损伤和炎症细胞因子释放,加速肝脏增殖和再生。采用Tregs和IL-10注射可逆转这些对肝细胞再生增殖的影响。此外,Treg衍生的IL-10可直接诱导巨噬细胞从M1极化到M2,从而减轻巨噬细胞分泌的IL-6和TNF-α,平衡肝脏重建过程中的肝内炎症环境。本研究揭示了Treg通过IL-10介导的巨噬细胞极化来调节肝内炎症环境和肝脏重建的能力,为改善肝脏炎症和维持稳态提供了潜在的机会。
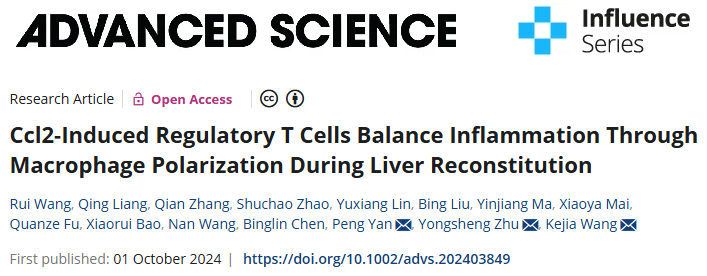
成人肝脏在急性肝损伤后具有惊人的再生能力。经典的啮齿动物实验表明,经过三分之二部分肝切除术(PHx)或四氯化碳(CCl4)治疗后,肝脏块可以重建。肝脏炎症由死亡或垂死细胞中的内源性分子引发,可触发肝脏修复并促进体内平衡的重建。然而,过于强烈或失败的炎症反应几乎总是伴有异常重建或对肝脏造成不可逆的损害。越来越多的证据表明,炎症通路(包括TNF-α和IL-6信号通路)被炎症介质(如细胞因子、趋化因子和补体)强烈激活,这些介质刺激静止的肝细胞进入细胞周期。然而,细胞因子与免疫细胞之间的通讯以及平衡肝脏重建期间炎症的潜在调节机制在很大程度上是未知的。
肝脏富含各种免疫细胞。迄今为止,几乎所有免疫细胞亚群都参与了肝脏重建。如果不考虑不同免疫细胞之间的相互作用,没有任何单一细胞群或细胞因子具有足够的可信度来完全理解肝脏再生过程。巨噬细胞长期以来被认为是急性肝损伤反应中的关键参与者,因为它们产生IL-6并通过STAT3的磷酸化和磷酸肌醇3激酶(PI3K)通路的激活促进肝细胞增殖,从而参与肝脏再生。最近的证据表明,急性肝损伤会导致巨噬细胞在细胞外刺激下向M1(促炎)或M2(抗炎)表型极化。M1和M2巨噬细胞之间的平衡在肝脏炎症反应的消退中起着关键作用。因此,肝脏重塑的终止很大程度上取决于巨噬细胞极化。
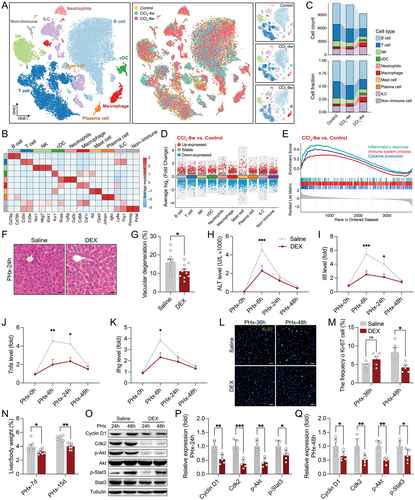
DEX 抑制肝损伤后的炎症反应和再生增殖(图源自Advanced Science )
调节性T细胞(Tregs)是一种特殊的T细胞谱系,在自我耐受和免疫稳态中起着关键作用。它们通过产生抗炎细胞因子(如IL-10、TGF-β和IL-35)来控制和终止炎症反应。X染色体编码的转录因子叉头框P3(Foxp3)被确定为Tregs的谱系特异性转录因子,在Tregs的发育和Treg表型的维持中起着核心作用。Tregs可能从组织微环境中感知炎症的开始和进展,以调整其抑制功能。越来越多的证据表明,Tregs积极参与应激或受损器官的组织重塑和修复。据报道,在受伤的肝脏中,肝内Tregs的频率增加以控制肝脏炎症,但它们是否与其他免疫细胞群相互作用及其具体功能仍不清楚。
使用CCl4诱导和三分之二PHx介导的小鼠肝损伤模型来评估受损肝脏中不同细胞类型之间的相互作用。在这里,作者研究了1型先天淋巴细胞(ILC1)、Treg和巨噬细胞调节的受损肝脏中的细胞和分子特征的动态,以及它们如何共同参与控制肝脏炎症和调节再生过程。作者进一步确定了Treg衍生的IL-10在肝脏重建过程中触发M2巨噬细胞极化的分子机制。
参考消息:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202403849


