中科院上海药物所《自然·通讯》:区域限制性PROTAC纳米平台,可实现时空可调的蛋白质降解和增强癌症治疗
时间:2024-08-11 06:01:01 热度:37.1℃ 作者:网络
PROteolysis靶向嵌合体(PROTACs)的抗肿瘤性能受到其肿瘤特异性不足和药代动力学不良的限制。同时,肿瘤的异质性进一步加剧了这些缺点,尤其是可驱动肿瘤生长和复发癌症干细胞的存在更是提高了治疗的难度。
在此,华东师范大学徐志爱教授、复旦大学中山医院徐辉雄教授和中科院上海药物所于海军研究员等人设计了一种区域受限的PROTAC纳米平台,该平台整合了活性氧(ROS)可激活和乏氧响应性PROTAC前药,用于精确操纵溴结构域和末端外蛋白4的表达以及根除肿瘤。这些PROTAC纳米颗粒通过对基质金属蛋白酶-2的反应选择性地积聚在肿瘤内并深入肿瘤。然后,光活性在酸性细胞内环境中被重新激活,PROTAC由于在常氧微环境中通过光动力疗法产生的ROS而被释放。此外,潜在的乏氧反应性PROTAC前药在过表达硝基还原酶的乏氧癌症干样细胞中恢复,从而区域限制性的有效降解BRD4的能力,显著阻碍了乳腺和头颈部肿瘤模型中的肿瘤进展。相关工作以“A region-confined PROTAC nanoplatform for spatiotemporally tunable protein degradation and enhanced cancer therapy”为题发表在Nature Communications。

【文章要点】
在这项工作中,作者合理地设计了一个区域受限的PROTAC纳米平台,可在常氧(常见肿瘤细胞位于其中)和缺氧(富含CSC)条件下同时降解溴结构域和BET蛋白4(BRD4)。这种统一的PROTAC纳米平台是独一无二的,专门针对由固有肿瘤异质性引起的不同肿瘤微环境做出反应,确保整体肿瘤细胞消除。作者首先通过将对ROS有反应的硫缩酮(TK)基团掺入BRD4 PROTAC(ARV771)中来合成ROS反应性PROTAC前药ARV771-TK。然后,PROTAC前药ARV771-TK通过可逆加成-断裂链转移(RAFT)聚合与酸响应性甲基丙烯酸2-(二异丙氨基)乙酯(DPA)单体共聚。使用类似的方法,作者还合成了另一种含有光敏剂焦脱镁叶绿酸a(PPa)和DPA单体的聚合物。最终,这两类聚合物自组装形成PROTAC纳米颗粒(PGDAT)(图1)。
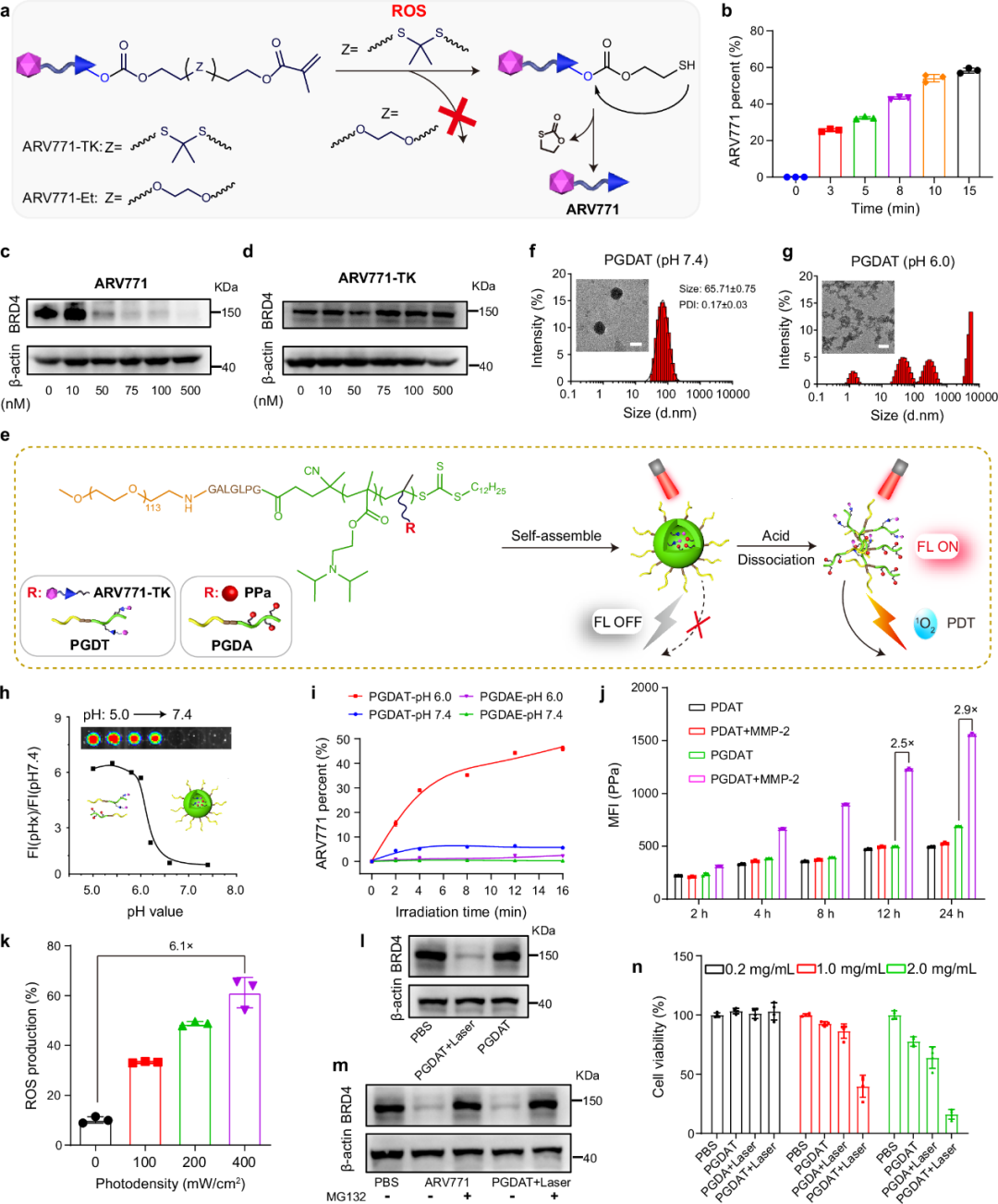
图1 ROS活化PROTAC纳米颗粒的合成与表征
静脉注射后,PGDAT通过增强的渗透性和保留性(EPR)效应选择性地积聚在肿瘤组织中。而基质金属蛋白酶2(MMP-2)在肿瘤中过表达,通过去除聚乙二醇(PEG)冠进一步增强肿瘤靶向性。在肿瘤细胞内的酸性环境中,PPa的光活性恢复,在671nm激光照射下促进大量ROS的产生。这种ROS级联切割TK连接,释放核心ARV771 PROTAC,实现靶向BRD4降解。具体而言,BRD4降解和光动力疗法(PDT)可以显著消除常氧肿瘤细胞。为了解决缺氧肿瘤生态境中的乏氧CSC问题,作者通过用硝基苄基(称为ARV771-Nb)修饰ARV771,进一步设计了一种缺氧反应性PROTAC前药,然后将其掺入上述PROTAC纳米颗粒中(PGDAT@N)。此外,潜在的低氧反应性PROTAC前药在过表达硝基还原酶的缺氧癌症干样细胞中恢复。总体而言,该区域受限的PROTAC纳米平台在常氧和缺氧环境中均能有效降解BRD4,从而阻碍乳腺和头颈部肿瘤模型中的肿瘤进展(图2)。
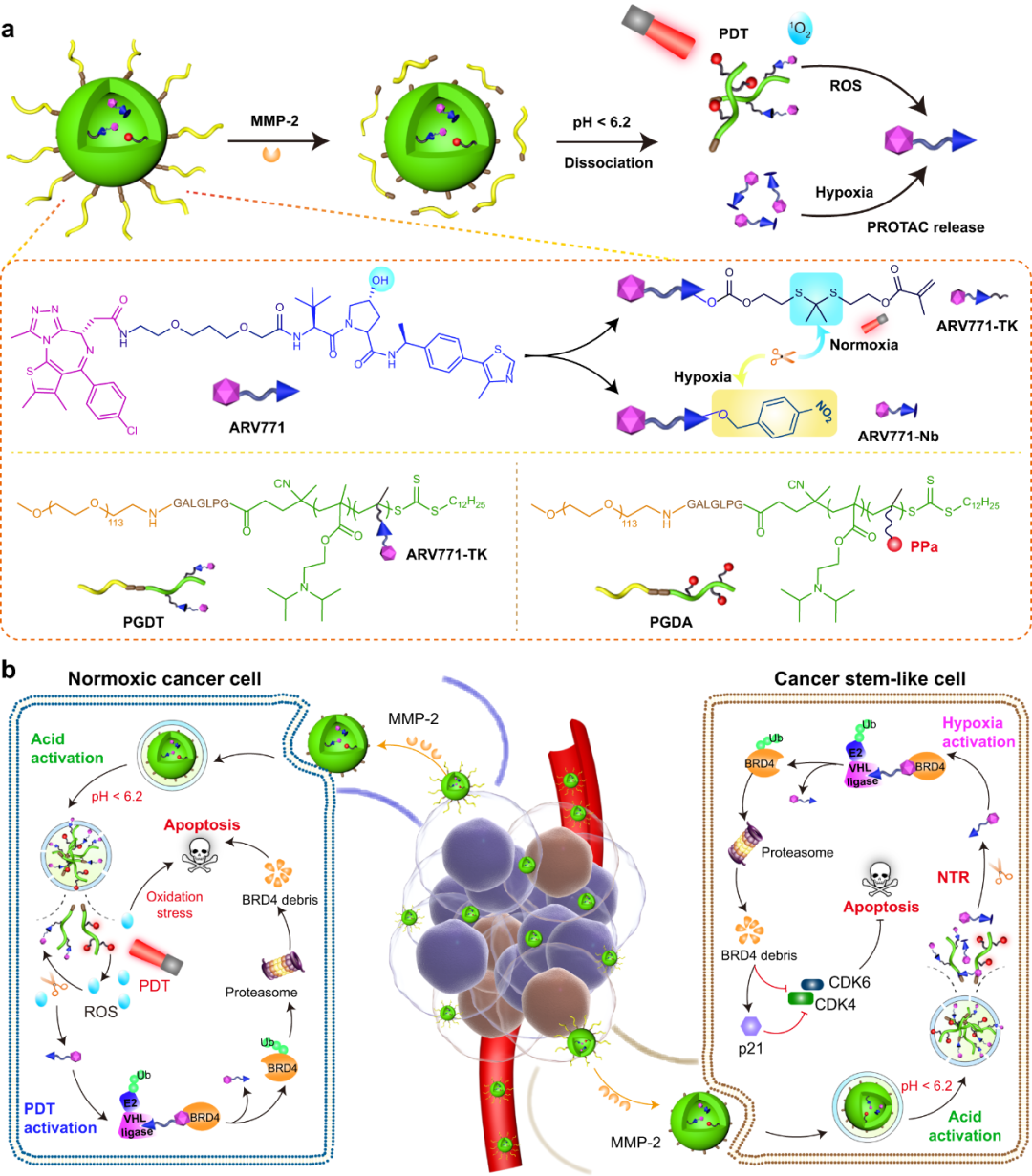
图2 区域限制的PROTAC纳米平台用于时空可调的蛋白质降解和联合癌症治疗
原文链接:
https://www.nature.com/articles/s41467-024-50735-w


