复旦大学吴艳玲等团队《自然·通讯》:发现尼帕病毒保守隐藏表位,研发高效全人源纳米抗体
时间:2024-08-16 18:05:27 热度:37.1℃ 作者:网络
尼帕病毒(Nipah virus, NiV)是一种人畜共患的烈性RNA病毒,最早于1998年在马来西亚被发现,长期以来被世界卫生组织列为全球高风险病原体。NiV和亨德拉病毒(Hendra virus, HeV)均属于副粘病毒科亨尼病毒属,病毒感染后可导致重度脑炎和呼吸系统疾病,致死率高达40%至95%。由于该病毒具有高度的跨种传播能力,其宿主范围非常广泛,已成为全球公共卫生的重大威胁,且近年来在东南亚邻国频发。然而,目前尚无针对该病毒的获批疫苗和抗病毒药物,使得研制特效药物成为我国保障人民健康安全的迫切战略需求。
近日,复旦大学基础医学院吴艳玲等合作团队在《Nature Communications》杂志上发表了一项重要研究,题为“Fully human single-domain antibody targeting a highly conserved cryptic epitope on the Nipah virus G protein”。研究团队利用国际首创的全人源纳米抗体研发平台,成功开发出高效广谱中和NiV和HeV的全人源纳米抗体n425。

进一步,团队利用结构生物学的研究手段,分别解析了该抗体与NiV-G蛋白单体以及四聚体的高分辨率复合物结构,从而解析了隐藏在G蛋白四聚体内部的高度保守表位。该表位相较于其他中和抗体表位在亨尼病毒属中更加保守。研究还表明,该抗体与G蛋白结合后可阻止G蛋白四聚体的构象变化从而使病毒无法进行膜融合,表现出非常强的膜融合抑制活性,远高于临床在研的抗尼帕中和抗体m102.4。实际上,研究团队在流感病毒HA三聚体(Cell Host Microbe, 2017)、新冠病毒三聚体刺突蛋白(Cell, 2022)、肿瘤抗原5T4(Mol Ther, 2022)等靶点上普遍发现了传统抗体较难靶向的隐藏表位,且证实了针对这类表位的抗体往往具有独特的作用机制和广谱活性。这对广谱疫苗和药物的开发具有重要的指导和借鉴意义。
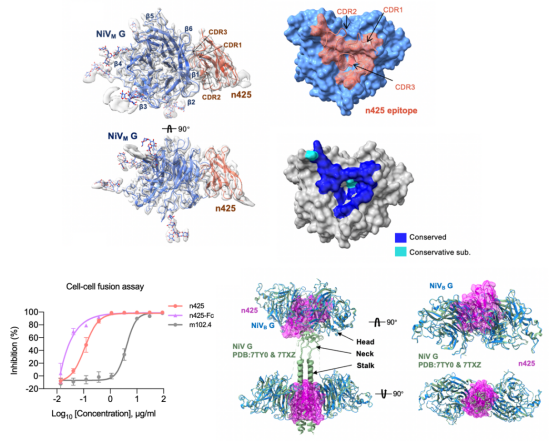
图:全人源纳米抗体n425靶向G蛋白四聚体内部的高度保守表位,且通过阻止四聚体构象变化抑制病毒的膜融合。
此外,全人源抗纳米体由于分子量是传统抗体的1/10,体积尺寸小,并具有比单抗更高的血脑屏障穿透性,在动物模型中可完全清除脑部病毒,展现出显著的抗病毒活性。这也表明小尺寸的全人源纳米抗体对于清除脑部感染病毒具有独特的优势和应用,有望成为安全有效的战略性储备药物,应对未来可能的尼帕病毒暴发流行。
复旦大学基础医学院吴艳玲副研究员、生物医学研究院孙蕾研究员、基础医学院应天雷教授、基础医学院陆路教授、上海市重大传染病和生物安全研究院吴凡教授为该研究的共同通讯作者,复旦大学基础医学院博士生汪雨露、生物医学研究院博士生孙轶芳、基础医学院博士生申赵铃为该研究的共同第一作者。该研究得到国家重点研发计划、国自然基金等资助。
原文链接:
https://www.nature.com/articles/s41467-024-51066-6


