香港浸会大学《自然·通讯》:揭示成骨细胞在肥胖个体的糖代谢紊乱与骨丢失之间的全新联系
时间:2024-10-20 06:02:17 热度:37.1℃ 作者:网络
众所周知,肥胖已经成为全球范围内的重大健康问题,而糖代谢紊乱和骨丢失是肥胖个体面临的两大主要挑战。因此,寻找能够同时解决肥胖患者中的糖代谢问题和骨丢失的治疗靶点至关重要。
香港浸会大学张戈/刘进/吕爱平联合研究团队于2024年10月4日在《Nature Communications》杂志在线发表题为“Targeting osteoblastic 11β-HSD1 to combat high-fat diet-induced bone loss and obesity”(doi: 10.1038/s41467-024-52965-4)的工作。该研究揭示了骨骼中糖皮质激素活化酶11β-羟基类固醇脱氢酶1型(11β-HSD1)在肥胖相关的糖代谢障碍和骨丢失中的关键作用和机制,发现喂养高脂饮食的肥胖小鼠其成骨细胞内高表达的11β-HSD1不仅影响骨骼的葡萄糖摄取和成骨活性,还与肥胖进展及胰岛素抵抗密切相关,提示成骨细胞内11β-HSD1是控制骨骼代谢和全身能量平衡的潜在关键靶点(Zhong et al., 2024)。
糖皮质激素(glucocorticoids)是人体中重要的激素,参与多种生理过程的调节。它在应激反应、免疫调控、代谢调节以及生长发育中发挥关键作用。研究表明,异常的糖皮质激素与肥胖密切相关(Quax et al., 2013)。循环中的糖皮质激素水平受体内下丘脑-垂体-肾上腺(HPA)轴调控,而组织局部的糖皮质激素水平主要被两种11β-羟基类固醇脱氢酶(11β-HSD)调控。其中,11β-HSD1能够将非活化的糖皮质激素活化,11β-HSD2则将活化的糖皮质激素转化为非活化状态。此前研究发现,全身敲除11β-HSD1的小鼠能够抵抗高脂饮食诱导的肥胖,因此11β-HSD1在近十几年来一直被视为治疗肥胖和糖尿病的潜在靶点。然而,哪个组织/器官中的11β-HSD1对抵抗肥胖发挥着主导作用仍然未知,导致这个靶点的药物发现处于停滞状态(Chuanxin et al., 2020)。悉尼大学的周虹教授团队发现,通过在成骨细胞和骨细胞中过表达11β-HSD2来阻断骨骼中的糖皮质激素活化,不仅可以防止高脂饮食引起的体重增加,还能改善高脂饮食小鼠的全身糖代谢并缓解骨丢失(Kim et al., 2021)。这一发现表明,骨骼中的糖皮质激素通路与肥胖中的糖代谢紊乱和骨丢失密切相关。然而,11β-HSD2在骨骼中的表达极少,而11β-HSD1是主要控制骨骼糖皮质激素活性的酶,因此,有必要深入探讨11β-HSD1是否在这些过程中发挥直接作用。
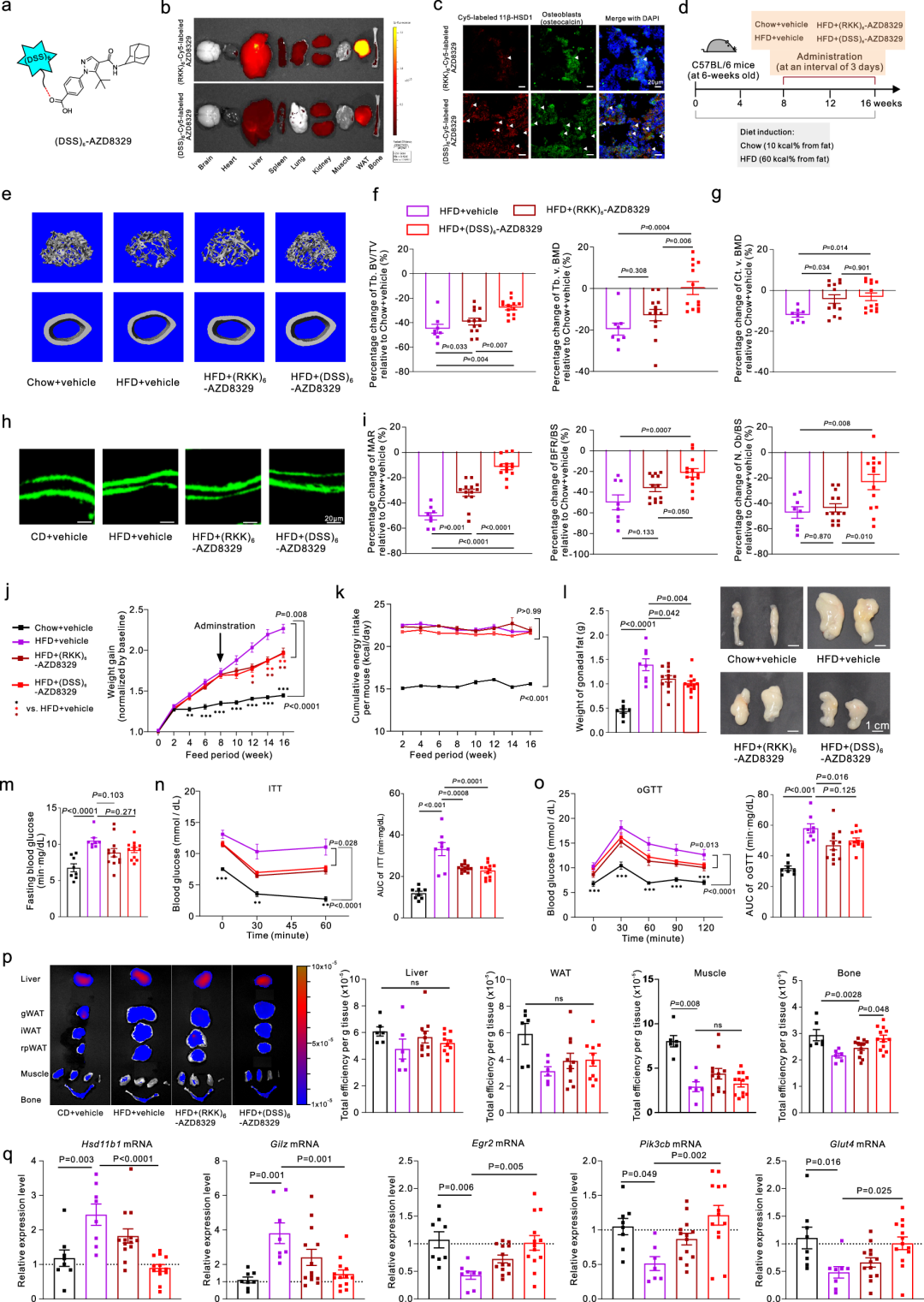
在对人体参与者的初步研究中,研究人员发现骨骼中11β-HSD1的表达增加与超重和高血糖密切相关。基于此,为进一步探索骨骼中的11β-HSD1表达是否与肥胖中的糖代谢紊乱和骨丢失相关,研究者对野生型小鼠进行了16周的高脂饮食和普通饮食喂养。研究结果显示,小鼠在喂养高脂饮食2周后开始出现肥胖和葡萄糖耐受不良,4周后进一步发展为胰岛素抵抗,并且在8到12周后出现明显的松质骨骨小梁流失。值得注意的是,高脂饮食组和普通饮食组之间全身性糖皮质激素水平的并无显著差异,但高脂饮食组的骨骼中局部的11β-HSD1表达和糖皮质激素活性显著升高,而在肝脏、脂肪组织和骨骼肌等其他代谢组织/器官中并未发现类似现象。这一结果表明骨骼中的11β-HSD1表达升高与肥胖中的糖代谢紊乱和骨丢失的进程相关。
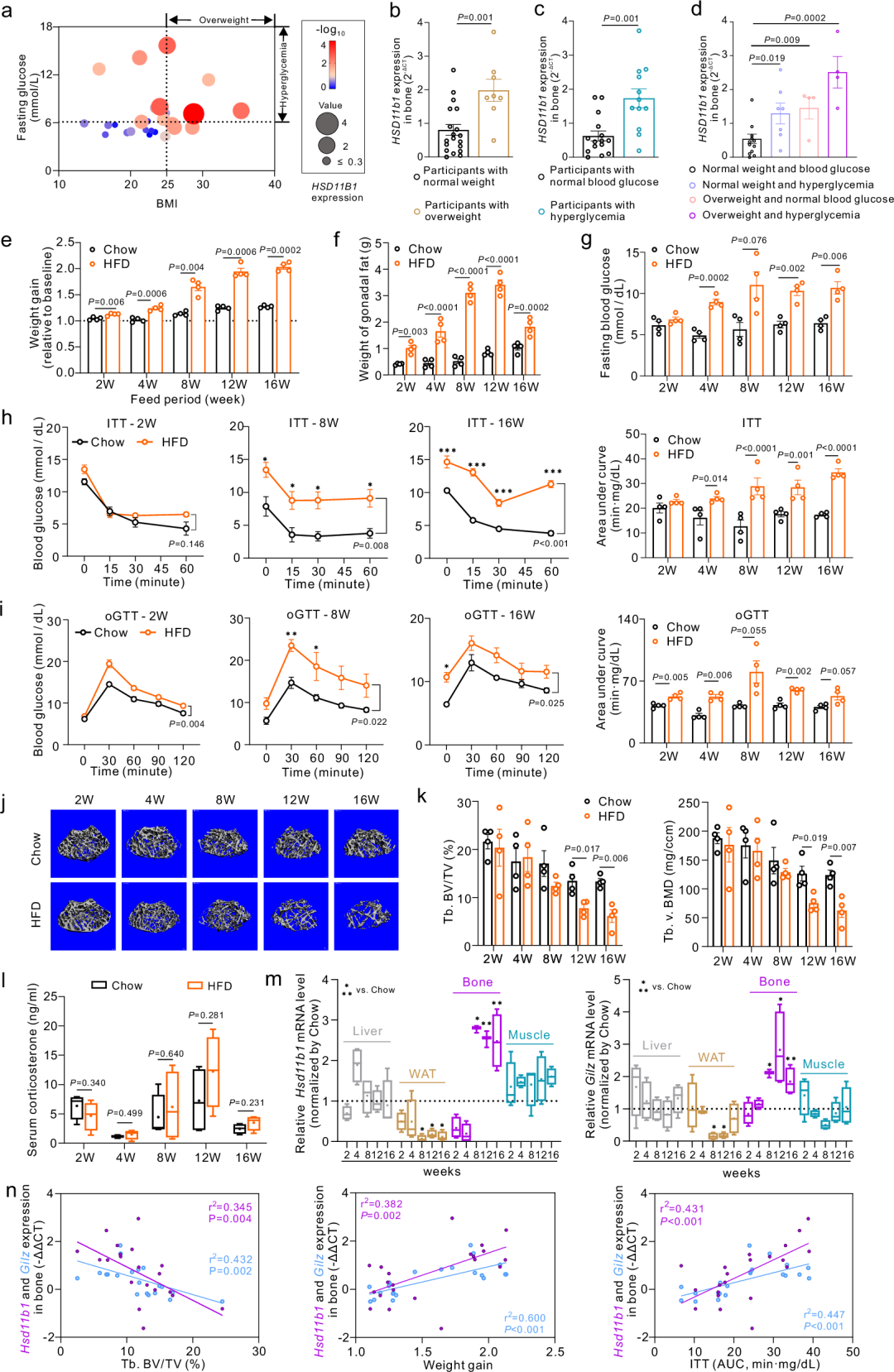
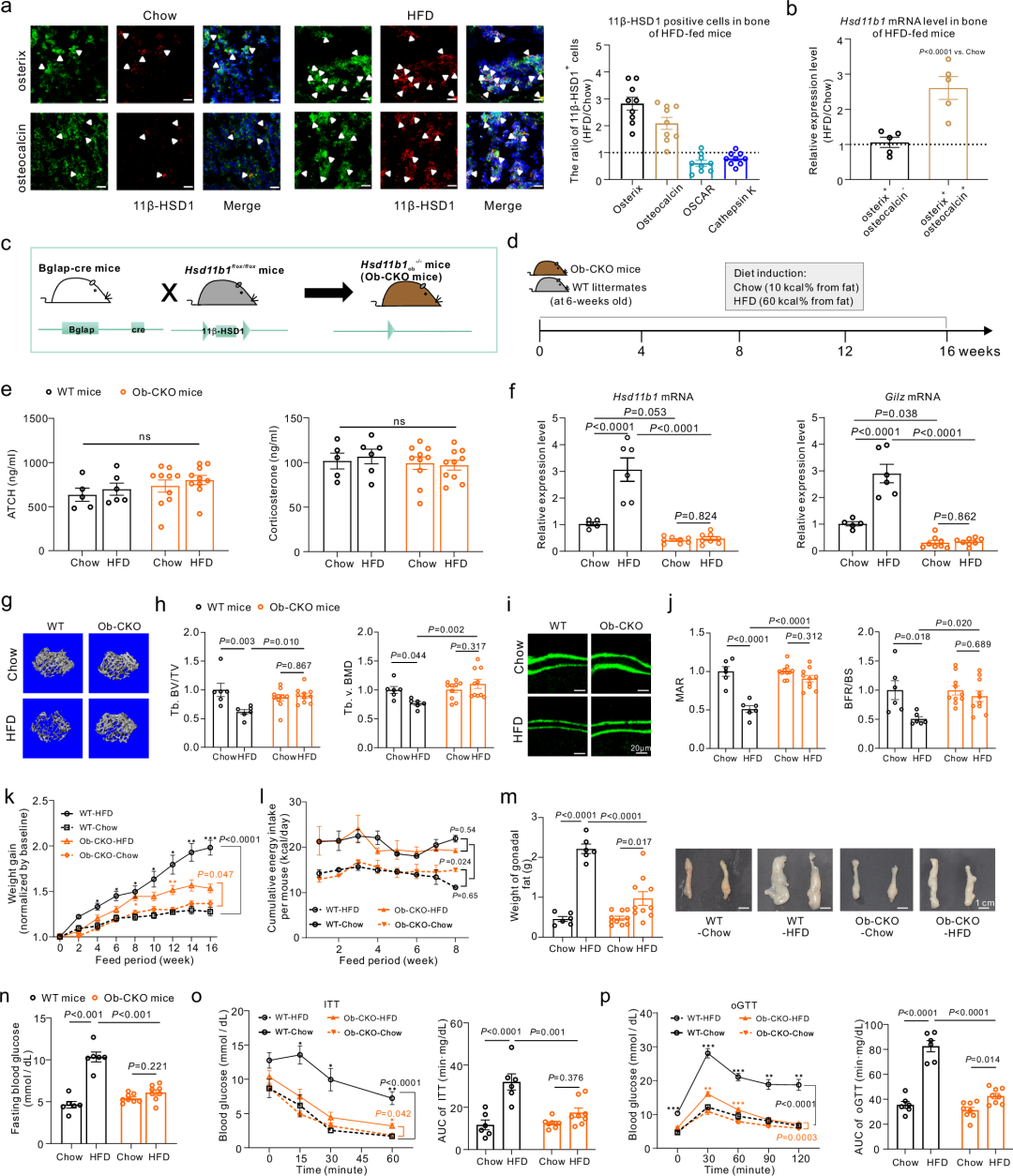
更有趣的是,免疫荧光成像和流式细胞术的结果显示,高脂饮食组的小鼠中,成骨细胞中的11β-HSD1表达显著增加,尤其是在骨钙素阳性(osteocalcin+)的成熟成骨细胞中,这表明成骨细胞中11β-HSD1的升高与肥胖中的糖代谢障碍和骨丢失相关联。为了进一步探讨成骨细胞中11β-HSD1的作用,研究者构建了成骨细胞特异性11β-HSD1敲除小鼠(Ob-CKO小鼠)。相对于同窝对照小鼠,这些小鼠的成骨细胞中11β-HSD1基因表达和酶活性、糖皮质激素活性都显著降低。值得注意的是,高脂饮食喂养后Ob-CKO小鼠未出现明显的骨丢失,并显示出骨形成的改善。此外,与肥胖的同窝对照小鼠相比,它们的体重增加较少,脂肪量和骨髓中的脂肪储存减少,能量消耗增加,糖代谢也得到了改善,且表现出骨骼葡萄糖摄取的增强。研究者还构建了肝脏和脂肪组织特异性11β-HSD1敲除小鼠,结果显示,虽然肝脏和成骨细胞敲除的小鼠都表现出体重增加减少,糖代谢改善,但只有成骨细胞敲除小鼠抵抗了肥胖相关的骨丢失,这些结果突显了成骨细胞中的11β-HSD1对肥胖相关的骨丢失和全身糖代谢紊乱的独特贡献。
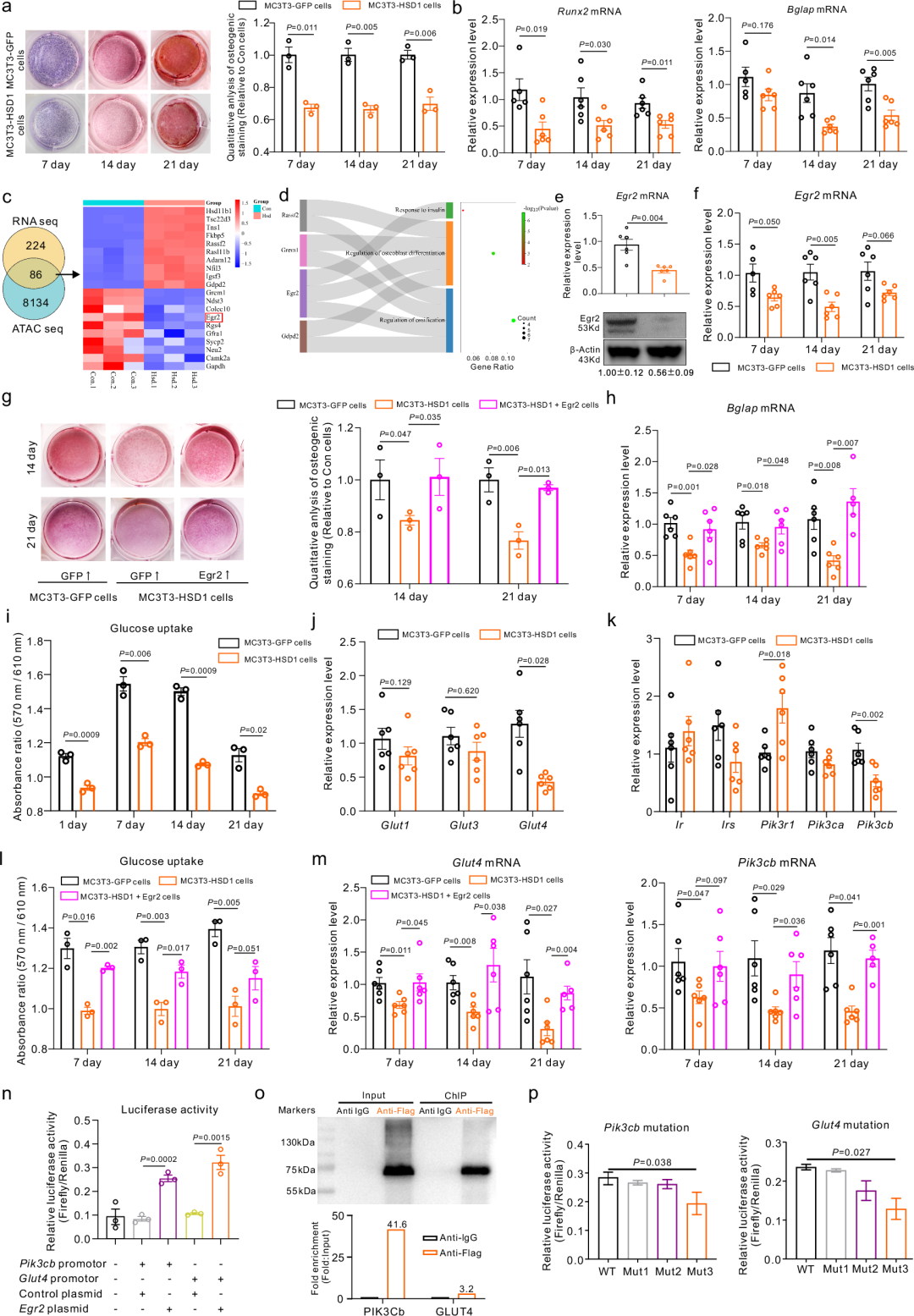
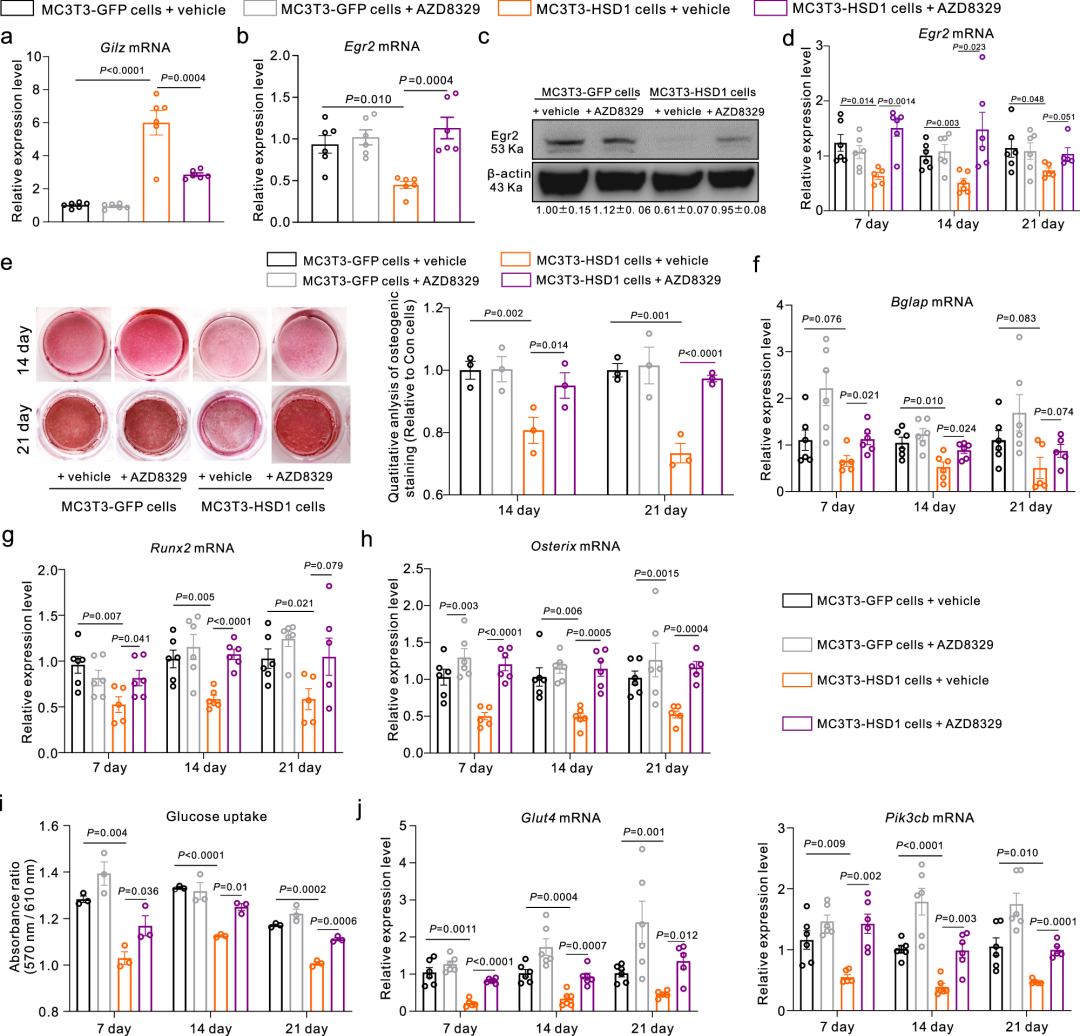
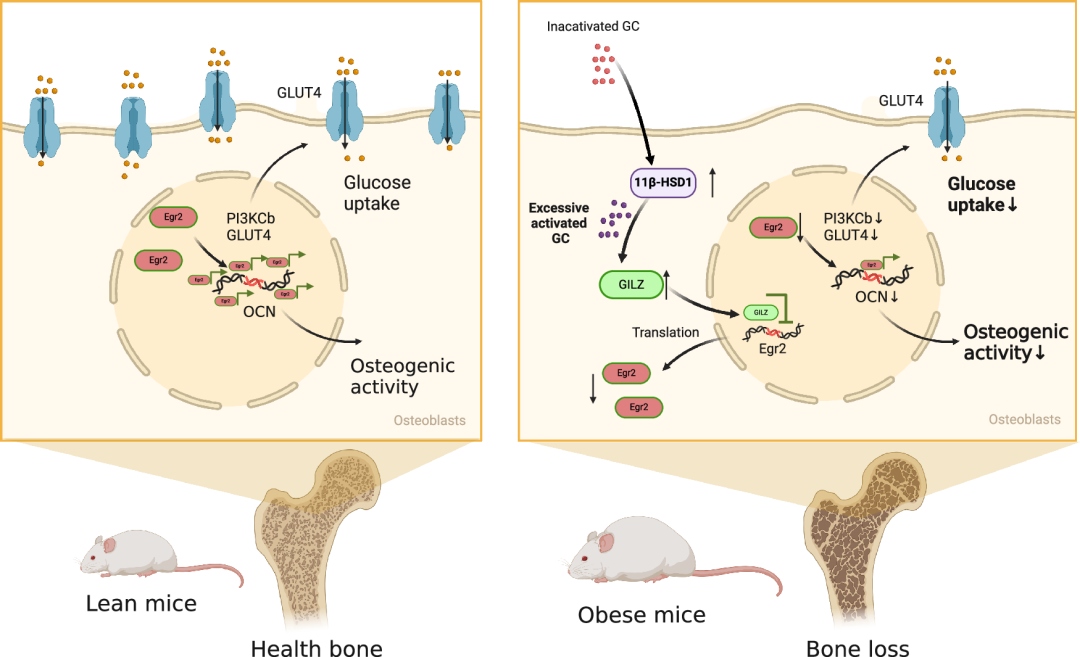
在分子机制方面,研究人员发现成骨细胞中过表达11β-HSD1会减少葡萄糖摄取和成骨活性。通过ATAC-seq和RNA-seq分析,研究人员确定了早期生长反应基因2(Egr2)是其中被显著影响的关键调控因子,其在11β-HSD1升高时被过度激活的糖皮质激素信号通路下调,并进一步导致其调控的下游成骨基因Osteocalcin和糖摄取通路相关基因Glut4和Pik3cb的表达降低。而过表达Egr2则成功恢复了成骨细胞因11β-HSD1过表达而受损的葡萄糖摄取和成骨活性。此外,体外使用11β-HSD1抑制剂AZD8329抑制11β-HSD1活性也能恢复11β-HSD1过表达成骨细胞受损的葡萄糖摄取和成骨活性,进一步证明了其作为治疗靶点的潜力。
最后,研究人员利用团队早年发现的成骨细胞靶向适配子(Zhang et al., 2012)合成了一种成骨细胞靶向的11β-HSD1抑制剂,并探讨了其在治疗高脂饮食引起的肥胖及骨丢失的作用。结果表明,靶向抑制骨内11β-HSD1不仅改善了高脂饮食引起的骨丢失,还减缓了肥胖和糖代谢紊乱的发展。并且,成骨细胞靶向抑制剂显著提高了小鼠的骨形成能力并增强了骨骼的葡萄糖摄取。
综上所述,此研究表明,成骨细胞中的11β-HSD1升高与肥胖中的糖代谢紊乱和骨丢失密切相关。敲除成骨细胞中的11β-HSD1能够增加能量消耗,改善骨骼的葡萄糖摄取,并促进骨形成。而通过成骨细胞靶向11β-HSD1抑制剂抑制成骨细胞中的11β-HSD1能够有效缓解高脂饮食引起的全身糖代谢异常及骨丢失。这一发现为开展同时针对肥胖患者的糖代谢紊乱和骨丢失的药物发现提供了新的思路。
香港浸会大学罗守辉骨与关节疾病转化医学研究所钟传新博士、博士研究生李南茜同学、第四军医大学药学院王胜正教授为本论文的共同第一作者。香港浸会大学罗守辉骨与关节疾病转化医学研究所张戈教授和刘进助理教授、悉尼大学医学研究所周虹教授、南方科技大学材料系任富增教授、香港浸会大学系统医学与健康科学研究所吕爱平教授为本论文的共同通讯作者。汕头大学医学院第一附属医院钟志刚教授团队与南方医科大学附属第三医院黄广鑫教授团队为本研究中临床骨样品的获取与分析提供了宝贵的支持。本项研究获得香港研究资助局“主题研究计划”、“优配研究金”、“杰出青年学者计划”和国家自然科学基金委“自然科学基金”和“广东省基础与应用基础研究基金”等项目资助。
参考文献
1、Chuanxin, Z., Shengzheng, W., Lei, D., Duoli, X., Jin, L., Fuzeng, R., . . . Ge, Z. (2020). Progress in 11beta-HSD1 inhibitors for the treatment of metabolic diseases: A comprehensive guide to their chemical structure diversity in drug development. Eur. J. Med. Chem., 191, 112134. doi:10.1016/j.ejmech.2020.112134
2、Kim, S., Henneicke, H., Cavanagh, L. L., Macfarlane, E., Thai, L. J., Foong, D., . . . Zhou, H. (2021). Osteoblastic glucocorticoid signaling exacerbates high-fat-diet- induced bone loss and obesity. Bone Res., 9(1), 40. doi:10.1038/s41413-021-00159-9
3、Quax, R. A., Manenschijn, L., Koper, J. W., Hazes, J. M., Lamberts, S. W. J., van Rossum, E. F. C., & Feelders, R. A. (2013). Glucocorticoid sensitivity in health and disease. Nat. Rev. Endocrinol., 9(11), 670-686. doi:10.1038/nrendo.2013.183
4、Zhang, G., Guo, B., Wu, H., Tang, T., Zhang, B. T., Zheng, L., . . . Qin, L. (2012). A delivery system targeting bone formation surfaces to facilitate RNAi-based anabolic therapy. Nat Med, 18(2), 307-314. doi:10.1038/nm.2617
5、Zhong, C., Li, N., Wang, S., Li, D., Yang, Z., Du, L., . . . Zhang, G. (2024). Targeting osteoblastic 11beta-HSD1 to combat high-fat diet-induced bone loss and obesity. Nat Commun, 15(1), 8588. doi:10.1038/s41467-024-52965-4
原文链接:
https://www.nature.com/articles/s41467-024-52965-4


