Neuron:深圳大学朱心红团队发现衰老过程中肝脏通过肝可溶性环氧化物水解酶促进阿尔茨海默病进程
时间:2023-07-05 07:08:50 热度:37.1℃ 作者:网络
阿尔茨海默病(AD)是由遗传和环境因素复杂的相互作用引起的。然而,衰老过程中外周器官对环境刺激的反应在AD发病机制中的作用尚不清楚。
2023年7月3日,深圳大学朱心红团队在Neuron 在线发表了题为“Hepatic soluble epoxide hydrolase activity regulates cerebral Aβ metabolism and the pathogenesis of Alzheimer’s disease in mice”的研究论文,该研究发现肝可溶性环氧化物水解酶(sEH)活性随年龄增长而升高。在AD小鼠模型中,肝sEH水平下降能减轻脑淀粉样蛋白-β (Aβ)负担、牛头病和认知缺陷。此外,肝脏sEH调控可双向调节血浆中14,15-环氧二碳三烯酸(-EET)的水平,而14,15-EET可快速穿过血脑屏障,通过多种途径调节脑Aβ代谢。
研究发现大脑中14,15- EET和Aβ水平之间的平衡对于防止Aβ沉积至关重要。在AD模型中,14,15- EET输注在生物学和行为水平上模拟了肝sEH消融的神经保护作用。这些结果强调了肝脏在阿尔茨海默病病理中的关键作用,并且针对肝脑轴响应环境刺激可能是一种有希望的阿尔茨海默病预防治疗方法。

阿尔茨海默病(AD)是痴呆的主要原因,其特征是大脑中淀粉样蛋白β (Aβ)斑块的病理性积累,由磷酸化tau蛋白组成的神经原纤维缠结,以及以进行性认知障碍和痴呆为标志的神经变性。尽管对阿尔茨海默病病理生理学的了解有所进展,但仍需要基于血液的生物标志物,在明显的临床症状出现之前识别阿尔茨海默病病理,并寻求更有效的治疗方法。
长期以来,“Aβ级联假说”一直被认为是AD发病机制的核心。AD是由遗传和环境因素复杂的相互作用引起的。在衰老过程中,大脑和周围器官都发生了病理生理变化。越来越多的证据表明,外周组织中的基因调节与大脑功能和行为有关,如学习和记忆、社会和认知、焦虑、抑郁和大脑自身免疫调节。外周器官参与脑Ab沉积和清除,外周载脂蛋白E (ApoE,由ApoE编码)异构体对脑功能和AD发病有不同的贡献。关于受环境刺激影响的外周器官的年龄相关变化如何影响脑Aβ代谢的知识有限。在这个方向上进行更多的研究可以使研究人员开发出具有临床转化潜力的血液生物标志物和阿尔茨海默病的一级预防。
AD是一种代谢性疾病,而肝脏是人体的中心代谢器官。随着年龄的增长,肝脏体积和血流的减少会影响肝脏的代谢功能。热量限制可以延长寿命,影响肝脏代谢途径。AD患者的肝功能明显高于健康人。此外,肝脏是花生四烯酸(AA)的主要来源,最近的一项横跨小家鼠一生的单细胞转录组图谱显示,肝脏中存在与年龄相关的AA代谢功能障碍。可溶性环氧化物水解酶(Soluble epoxide hydrolase, sEH,由EPHX2编码)是二十烷类生物的关键酶,包括环氧二碳三烯酸(EETs),特别是14,15- EET,它们是由AA通过环氧化酶代谢途径产生的。先前的研究表明,EPHX2基因位于PTK2BCLU位点,这有力地证明了与AD的全基因组联系。与其他研究一起,该研究发现Ephx2缺失或sEH的药理抑制减轻了AD小鼠模型中的AD发病机制。最后,抑郁症是AD的独立危险因素,而肝脏sEH在抑郁症的病理生理中起着关键作用。然而,肝脏在衰老中的作用以及肝脏在环境刺激下的变化如何导致AD的发病机制尚不清楚。
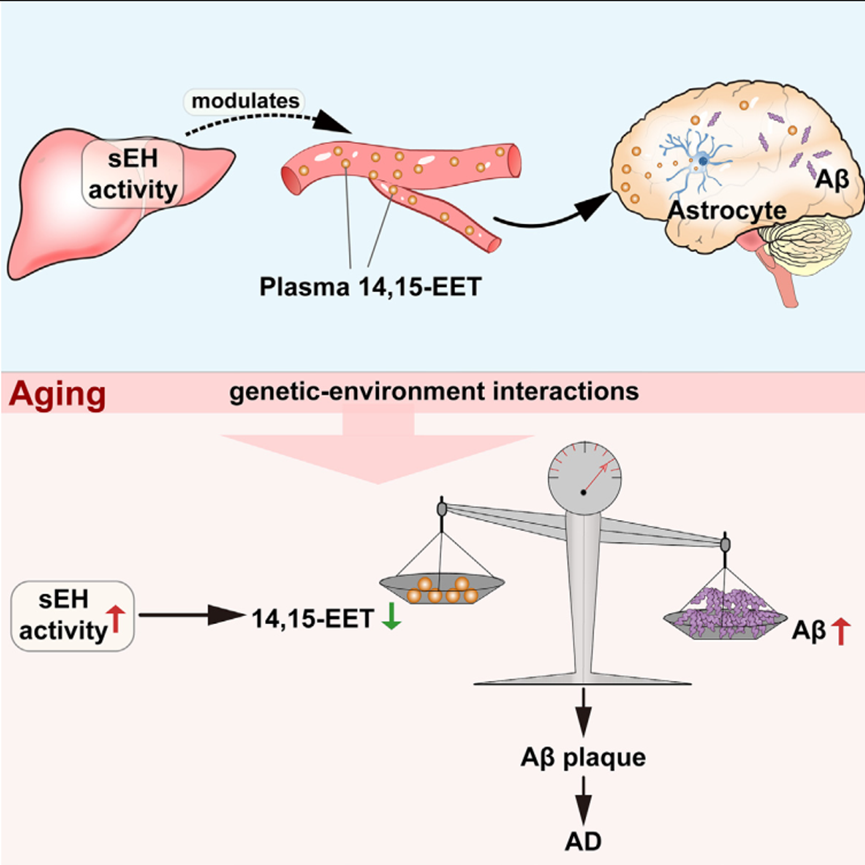
衰老过程中肝脏器官促进阿尔茨海默病进程机制示意图(图源自Neuron )
该研究采用遗传方法对5只家族性AD (53FAD)突变转基因小鼠和三转基因AD (33TgAD)小鼠进行实验。研究发现肝脏sEH活性随着年龄的增长而增加,并调节血浆中14,15- EET的水平,使其快速穿过血脑屏障(BBB)并调节脑Ab代谢。此外,结果结果表明肝脏sEH下降能减弱小鼠AD发病机制,而大脑中14,15- eet和Aβ水平的平衡对Aβ代谢至关重要。该研究还发现通过基因治疗下调肝脏sEH可改善AD的病理。这些研究结果表明,肝脏在阿尔茨海默病的发病机制中起着关键作用,针对肝脑轴响应环境刺激可能是一种有希望的阿尔茨海默病预防治疗方法。
原文链接:
https://www.cell.com/neuron/fulltext/S0896-6273(23)00437-3#%20


