JNCI:近10年儿童抗癌新药临床试验进展分析显示,研发效率仍待提升
时间:2023-07-09 07:08:52 热度:37.1℃ 作者:网络
近二十年来,对癌症生物学的深入了解和肿瘤分析技术的创新促进了许多抗癌新药的研发。然而,药品从首次人体试验到获批上市之间可能面临多重困难,如安全性问题、疗效不佳及患者招募受阻等,都会导致试验停滞。因此,有必要对这些抗癌新药从开展临床试验到获批的历程进行系统性调查回顾,鉴别有待优化的步骤,以提高研发效率和成功率。
调查回顾新药临床试验时需额外考虑儿童这一特殊患者人群。既往抗癌新药的初始或关键临床试验通常将儿童患者排除在外,针对儿童的临床试验往往在成人临床试验完成很久之后才启动。这导致儿童抗癌新药的试验周期长、获批药品匮乏,一些情况下儿童患者不得不在药品核准的标识外使用成人的抗癌药,带来安全性隐患。
近日,哈佛医学院附属波士顿儿童医院及合作机构的研究人员在 Journal of National Cancer Institute 上发表了题为 Clinical development of new drugs for adults and children with cancer, 2010–2020 的文章,该研究对2010~2015年间启动临床试验的抗癌新药进行了纵向分析,并持续追踪至2020年,旨在描述成人和儿童抗癌新药临床试验历程的特征,并依此确立适用于这类抗癌新药研发过程的监管模式。

研究人员从AdisInsight数据库和FDA网站中调取了所有于2010年1月1日至2015年12月31日期间开启I期临床试验(包括混合I/II期临床试验)的抗癌新药的相关信息。这些新药只包括新分子实体(注:即这些新药的化学分子以往未被批准上市过,以下均以抗癌新药指代),不包括其他用于癌症或肿瘤治疗以外的新药(如造影剂和止吐剂等)。研究人员将纳入标准包含18岁以下患者的临床试验定义为符合儿科标准的临床试验,并排除缺少年龄信息的试验。在针对临床试验阶段和成果的分析中,如果一个新药在一项试验启动后6年内既未获批,亦未开启任何新的临床试验,则定义为试验停滞;考虑到抗癌新药的I期和II期临床试验持续时间通常较预期更短,敏感性分析采用4或5年作为试验停滞的判断标准。
这项研究共分析了572个符合上述标准的抗癌新药,其中小分子药物(55.2%)、抗体(25.9%)以及抗体偶联药物(7.7%)占比居多。2010~2020年共计启动6,141项针对这些新药的临床试验,即平均每个新药约12项试验;在这些试验中,约半数(48.4%)为I期临床试验。
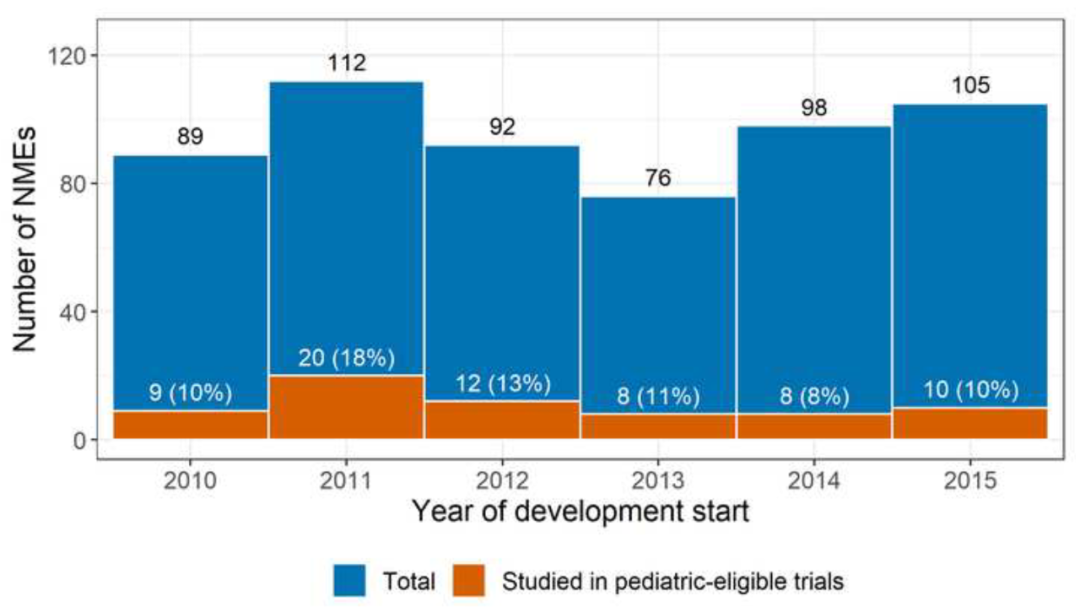
图1:2010~2015年期间首次启动临床试验的新药。蓝色:新药总数;橙色:截至2020年底,进行过至少一项符合儿科标准的临床试验的新药
截至2020年底,572个抗癌新药中共有39个获得FDA批准,这39个新药在获批前平均历经约26项临床试验。经统计,单个新药在临床试验开始后10年内获批的概率为10.4%。未获批的新药中有184个试验停滞,约占研究总数的32.2%,其中绝大部分在I期临床试验后即停滞。经统计,单个新药在临床试验开始后10年内停滞的概率为49.2%;敏感性分析显示,若采用4年作为试验停滞的判断标准,单个新药在10年内发生试验停滞的概率则高达67.2%。
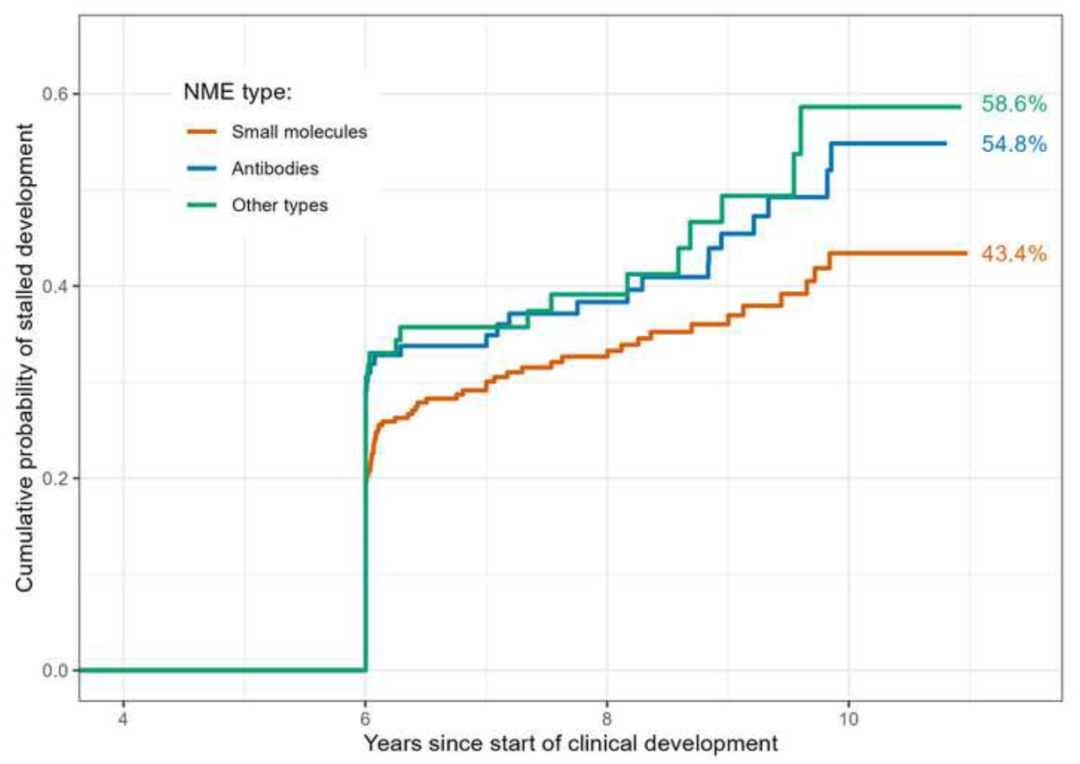
图2:不同类型新药在临床试验启动后10年内发生试验停滞的估计概率。终末曲线高度表示追踪调查期间发生停滞的估计概率(以4年内无新临床试验为停滞标准)
截至2020年底,共有67个新药开展了符合儿科标准的临床试验。这些新药从启动临床试验到首次开展符合儿科标准的试验中位间隔时间为4.6年;其中仅有5个新药在初始临床试验即招募儿童患者,剩余62个新药平均历经14.9项临床试验后才开始纳入儿童患者进行试验。最终获批的39个新药中仅5个获批用于儿童患者。经统计,单个新药在临床试验开始后10年内获批用于儿童患者的概率为1.4%。
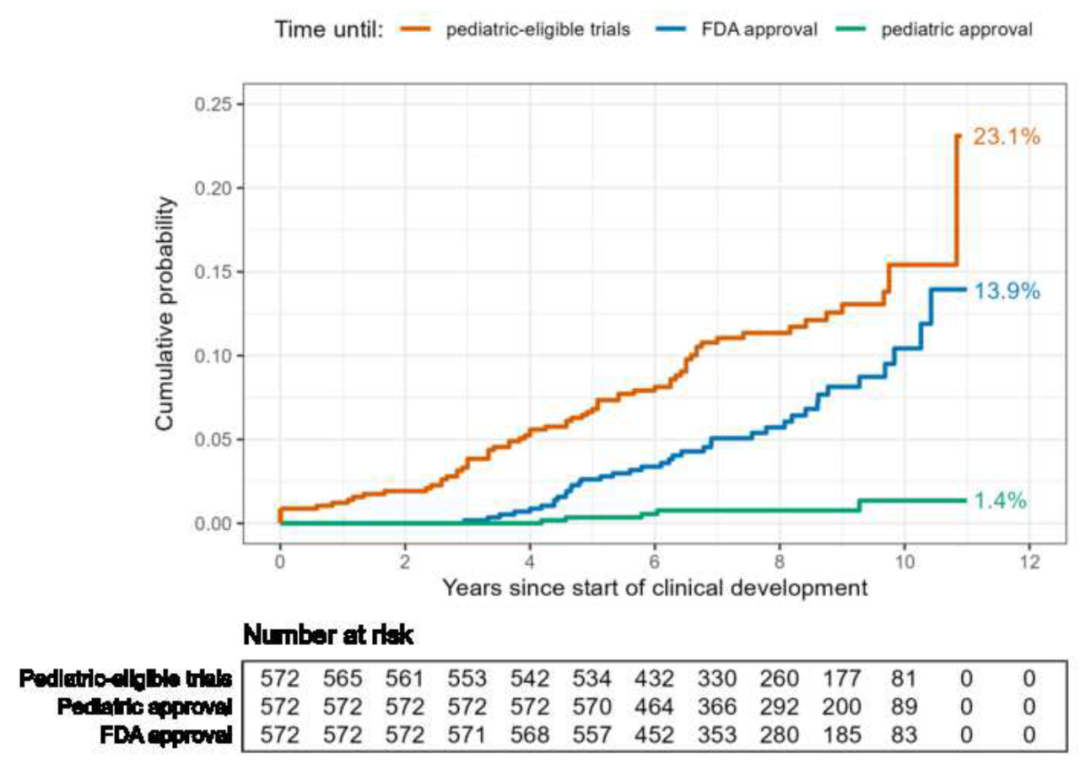
图3:临床试验启动后10年内各结局事件的估计概率。终末曲线高度表示追踪调查期间达到相应结局(即进行符合儿科标准的临床试验、获FDA批准上市及获批用于儿童患者)的估计概率
上述结果显示临床试验的设计和实施策略仍有待优化,尤其是涉及儿童患者的临床试验。
对于新药试验停滞频发这一问题,研究人员提出了相关改善建议:一是提高临床前研究的质量以降低转化失败的风险;二是引入真实世界观察性研究的数据作为外部对照,从而尽可能准确地预估新药的真实药效。此外,对于已经发生停滞的新药试验,研究人员鼓励其负责人披露试验数据及导致试验停滞的潜在原因,为其他新药的研发决策提供参考(如尽早叫停相似无效新药的试验计划)。这不仅有利于提高新药研发的效率,亦可减少试验参与者接触无效或不安全的新药。
FDA曾依据《儿童最佳药品法案》(Best Pharmaceuticals for Children Act)和《儿科研究公平法案》(Pediatric Research Equity Act)实施过儿科试验促进项目,用以推动成人抗癌药品在儿童患者中的试验评估和应用,但该项目收效甚微。本研究亦证实,绝大多数抗癌新药的临床试验未纳入儿童患者,或仅在成人临床试验结束的数年后才启动针对儿童患者的试验。这种模式虽可在一定程度上确保儿童临床试验的安全性和有效性,但易导致儿童癌症患者因药品选择匮乏而超说明书使用药品的情况。
因此,研究人员提出,在合适的情况下,可以适当降低临床试验的最低年龄要求,将青少年甚至儿童与成人一起纳入临床试验,从而加速抗癌药品应用于儿童患者的试验和评估。
DOI: 10.1093/jnci/djad082


