慢性光化性皮炎发病机制的研究进展
时间:2023-07-17 11:15:39 热度:37.1℃ 作者:网络
慢性光化性皮炎(chronic actinic dermatitis,CAD)是一种在中老年男性发病率较高免疫介导的光敏感性皮肤病,包括光敏性湿疹、持久性光反应、光线性类网织细胞增生症、光敏性皮炎等。此病临床表现主要为面、颈、双手等暴光部位为红斑、丘疹、结节伴瘙痒,严重时可累及非暴露部位皮肤,甚至部分严重患者可转换为皮肤淋巴瘤,该病严重影响着患者的身心健康和生活质量。
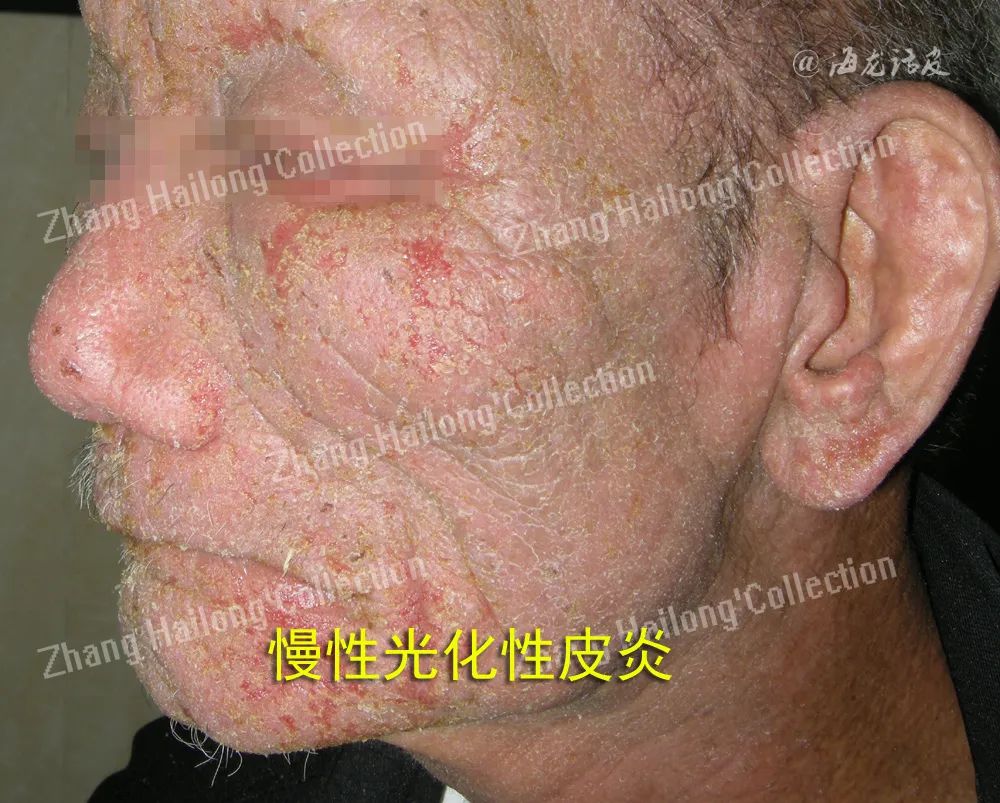
最近研究报道显示,随着气候变化和环境污染增加,慢性光化性皮炎发生率呈明显上升趋势。
一 CAD发病机制
1、环境因素:
CAD患者发病率与日照持续时间和强度、空气温度及可吸人颗粒物PM10存在有相关性。据研究报道CAD患者患病率与空气湿度和日照时间呈正相关,与PM10呈负相关。CAD的发生随着日照时间和日照强度的增加而增多,因此提示环境因素在其中的作用。而光线在所有发病因素中最为关键。CAD的致病光谱较广,日光主要有三种成分组成,即紫外线(UV)、可见光及红外线; 在CAD病人致病因素中紫外线和可见光占据主要部分。
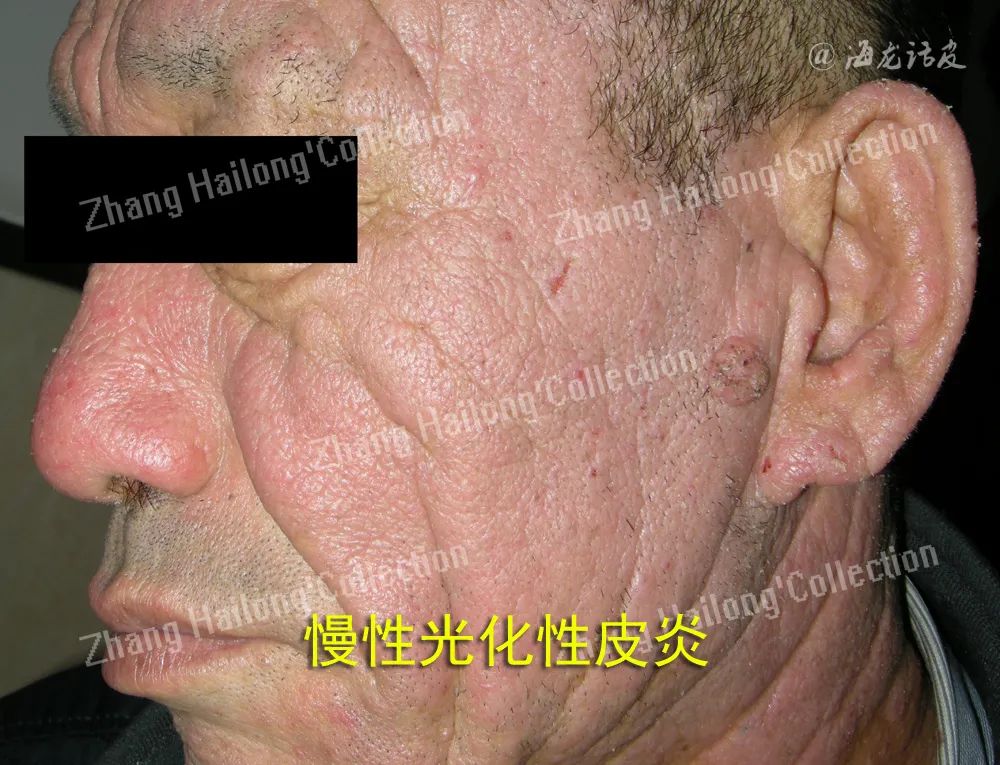
早期认为中波紫外线(ultravioletradi-ationb,UVB)为主要作用光谱,后发现长波紫外线(ultraviolet radiation a,UVA)、可见光、短波紫外线(ultraviolet radiation c,UVC)均可诱导发病,其中UVA可能占有更为重要的地位,CAD患者的致病光谱常具有一定的波动性,病情较重的患者致病光谱可能更为广泛日常使用的人工照明设施如荧光灯和节能灯也可产生紫外线,剂量虽小但可被人体感知,长期暴露可诱导CAD发生。
紫外线照射可以导致机体产生过多的氧化反应活性物质,这些物质会对细胞的核酸及蛋白等产生一系列的影响,如造成DNA碱基破坏、解螺旋,甚至发生变形、断裂等。紫外线照射可激活体内酶活性变化导致DNA和蛋白质等发生修饰,这些被修饰过的物质形成一种新生抗原,它们继而引起迟发性超敏反应。
2、光敏物质:
光敏物质是诱发CAD的另一重要因素研究表明,75%的CAD患者皮肤中存在着一种或多种光敏物质,外源性光敏物质经皮肤接触或吸收后经UVA或UVB照射,与皮肤中某些正常成分形成半抗原,并进一步与机体载体蛋白共价结合形成全抗原,引发迟发型超敏反应,随着疾病的进一步发展,即使不需要外源性光化学物质的刺激,任何部位皮肤一旦受紫外线照射即可产生足量的内源性抗原,通过持续刺激机体引发迟发型超敏反应,常见的光敏物质有倍半烯内酯、橡胶、树脂、香料、芳香剂等,部分食物和药物也存在光敏性,食物中有木耳、灰菜、泥螺、无花果等,药物如磺胺类、四环素类、吩噻嗪类、非甾体抗炎类等,一些非光敏物质如肉桂醇因存在相似的光敏性化学结构,通过交叉反应也可引发光过敏。
光介导的迟发性超敏反应:机体组织受到长期大剂量紫外线照射后,会发生一些修饰变化,如蛋白质修饰、DNA突变等,被修饰的核酸及蛋白类物质会形成一种新生的内源性抗原。一开始引起机体过被修饰的核酸及蛋白类物质会形成一种新生的内源性抗原。引起机体过敏的是外源性光化学物质,其作为半抗原进到机体内与载体蛋白结合形成完全抗原,最终发展到CAD时,短暂的紫外线照射便能引起载体蛋白变化形成新的内源性抗原而引起迟发性超敏反应。皮损处大量淋巴细胞浸润,反复的外界抗原刺激激活了这些免疫细胞,使这些免疫细胞带有记忆性而更加活跃,因此,当起初的外源性光毒性物质除去后,机体在接受短暂紫外线照射后很快复发加重。
大多认为本病发生与机体免疫反应有关,即皮肤接触光及光敏物质后由T淋巴细胞介导的Ⅳ型迟发型超敏反应(delayed type hypersenitivi-tyDTH)正常健康个体的皮肤经UV照射后可产生局部免疫抑制,而CAD患者因缺乏免疫抑制,可允许光诱导抗原刺激产生超敏反应从而产生皮肤病变。皮肤中丰富存在的发色团DNA可吸收紫外线辐射被认为是致病相关关键的抗原之一此外光过敏原和CAD患者的内源性抗原之间存在的交叉反应也可能参与了免疫机制。
3、免疫失衡:
CAD患者的淋巴细胞比例失衡,有研究发现在皮损真皮浅层浸润的淋巴细胞早期以CD4+淋巴细胞为主,而晚期则以CD8+淋巴细胞为主,出现由Th2/Th1平衡向Th2免疫的转变。Dong-YeobKo等人发现CAD重度组总IgE水平和外周血嗜酸性粒细胞百分比均高于其它各组。Th2细胞属于CD4+细胞亚群,其分泌的细胞因子一方面可以促进Th2细胞增殖,另一方面也可以抑制Th1的增殖,并辅助B淋巴细胞活化,从而激活免疫反应。紫外线照射可抑制Th1细胞抗原提呈,而活化Th2抗原提呈,这与CAD患者的免疫细胞变化是相一致的。
研究表明CAD的发展可能与Caspase-14的异常表达有一定程度的相关,UV可刺激皮肤产生过量的活性氧(ROS) ,导致多种受MAPK调节,MAPK可影响Caspase-14的表达。
4、其他研究:
CAD患者皮肤屏障功能受损,且皮损组织中AIM2的表达水平明显升高,表明AIM2炎性小体可能在CAD持续的慢性炎症中起作用。研究表明RP11-356I2.4在CAD患者皮损中明显下调。紫外线能诱导RP11-356I2.4启动子区甲基化进而导致其表达降低,RP11-356I2.4低表达可导致细胞对紫外线的敏感性增加,过表达RP11-356I2.4可以修复紫外线诱导的小鼠屏障损伤模型。IFI16在CAD患者皮损组织表达上调,提示其可能通过调节角质形成细胞功能、影响表皮增殖而参与疾病的发生、发展。IFI16经UVB诱导可发生从细胞核向细胞质的移位,细胞核内IFI16的减少可通过下调P53-BAX/BCL-2通路减缓细胞周期阻滞和凋亡。
二 总结及展望
随着人们对CAD研究的不断深入,对其发生机制机理的认识也会进一步完善。研究发现该病的发生发展与免疫反应、炎症反应及紫外线等因素密切相关。由于CAD具有顽固难愈的特点,在临床治疗时不仅结合患者自身情况以及防晒为基础,还需要通过辅助传统方法治疗。本文主要以近几年CAD的相关研究为基础,探讨了CAD的发病机制机理。通过研究将来对CAD的发病机制机理研究以及临床治疗方法的发展提供新思路。
参考文献:
1. 斯其贡,张小峰,燕红霞等.慢性光化性皮炎发病机制研究概况[J].皮肤科学通报, 2023, 40(3):269-272.
2.孙思昊,李晔,农祥等.慢性光化性皮炎发病机制及治疗[J].皮肤病与性病,2021,43(3) : 345-347.
3.代子佳.IFI16在慢性光化性皮炎皮损中的表达和意义[D].昆明医科大学,2022.
4.邓丹琪,胡晗菲,赵静等.慢性光线性皮炎发病机理和光生物学实验研究[C].中华医学会,中华医学会皮肤性病学分会.中华医学会第十八次全国皮肤性病学术年会论文汇编.2012: 2.
5.李凌佳,刘彤云.胱天蛋白酶14在慢性光化性皮炎患者皮损中的表达及中波紫外线对其 mRNA和蛋白在HaCaT细胞中表达的影响[J].中华皮肤科杂志,2019,52(7) : 486-490.

