6大HER2靶点ADC类药物直面竞争,谁是终极王者?
时间:2023-03-26 20:57:43 热度:37.1℃ 作者:网络
近期HER2 ADC赛道热闹非凡,先是2月24日NMPA官网最新公示DS-8201正式在中国获批上市,适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者,再是3月16日,CDE 官网公布拟将恒瑞HER2 ADC 注射用SHR-A1811拟纳入突破性疗法,用于单药治疗既往含铂化疗失败的HER2突变的晚期非小细胞肺癌患者。还有一个好消息是:3月1日ARX788治疗乳腺癌的Ⅱ/Ⅲ期临床期中分析达到界值,新码生物拟申请提前终止研究并向CDE递交上市申请。
HER2赛道抢跑之战已持续久矣,多家企业一方面加速研发,争取抢先上市,一方面布局多适应症,开拓差异化路径。究竟谁能笑傲江湖,让我们拭目以待
01、T-DXd(DS-8201)
2023年2月24日,中国国家药监局(NMPA)官网最新公示,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合开发的注射用德曲妥珠单抗(Enhertu,DS-8201, T-DXd)正式在中国获批上市。适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。

本次获批是基于III期临床试验DESTINY-Breast03的积极结果。DESTINY-Breast03是一项随机、开放、注册全球III期临床试验,旨在头对头评估德曲妥珠单抗相较于恩美曲妥珠单抗(靶向HER2的ADC,T-DM1)治疗HER2阳性、既往接受过曲妥珠单抗和紫杉类药物治疗的不可切除和/或转移性乳腺癌患者的安全性和有效性。与T-DM1相比,T-DXd将患者的疾病进展或死亡风险降低了72%(HR=0.28;95% CI 0.22-0.37;p<0.0001),如此显著的PFS改善在乳腺癌领域的临床研究中前所未有。

02、Kadcyla(T-DM1)
Kadcyla由罗氏和ImmunoGen共同研发,于2013年2月22日被FDA批准用于HER2阳性转移性乳腺癌。Kadcyla由微管抑制剂DM1通过不可清除的硫醚键连接子与靶向HER2的人源化IgG1偶联,经过受体介导的内化被溶酶体溶解,使DM1降解产物在肿瘤细胞内释放致使细胞凋亡。2020年NMPA批准上市,成为国内第一款上市的ADC。
2020年1月21日,基于III期KATHERINE研究结果,T-DM1在国内获批上市用于接受了紫杉烷类联合曲妥珠单抗为基础的新辅助治疗后仍残存侵袭性病灶的HER2阳性早期乳腺癌患者的辅助治疗,成为国内首款获批的ADC药物,开启了中国抗体药物偶联物(ADC)治疗的新时代。
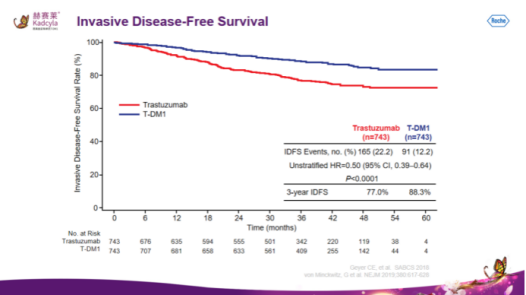
2021年6月23日,基于Ⅲ期EMILIA研究,国家药品监督管理局(NMPA)正式批准罗氏的ADC药物赫赛莱:registered:(英文商品名:Kadcyla:registered:,通用名:恩美曲妥珠单抗,T-DM1)适用于HER2阳性晚期乳腺癌。
EMILIA为随机、国际、非盲的Ⅲ期研究,共入组991例≥18岁、局部晚期或转移性乳腺癌、HER2阳性、无法切除、既往曲妥珠单抗和紫杉类治疗失败的男性和女性患者。入组的患者按1∶1随机分配,接受静脉注射T-DM1或口服对照药物(卡培他滨+拉帕替尼)。在第二次中期分析总生存期OS时超越了预设的总生存有效性分界线后,允许患者从对照组交叉至T-DM1组治疗。
结果显示,T-DM1组的中位PFS是9.6个月,拉帕替尼+卡培他滨组为6.4个月(HR=0.65,95%CI:0.55-0.77,P<0.001);T-DM1组的中位OS是29.9个月,拉帕替尼+卡培他滨组为25.9个月(HR=0.75,95%CI:0.64-0.88,描述性分析无P值)。第二次中期总生存分析后,在对照组(n=496)中有136例(27%)患者交叉至T-DM1组。
03、爱地希(维迪西妥单抗)
2021年6月国家药监局(NMPA)宣布,批准荣昌生物注射用维迪西妥单抗(商品名:爱地希)上市,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃癌(包括胃食管结合部腺癌)患者的治疗。维迪西妥单抗是首款由中国公司自主研发的ADC。
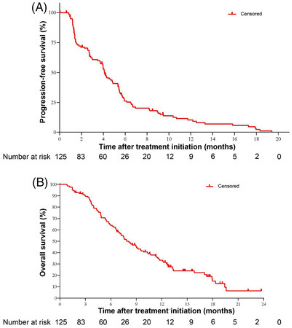
此次获批是基于C008研究结果,对于≥2线标准治疗失败的HER2 IHC2+/3+晚期胃癌患者,接受维迪西妥单抗药物治疗的ORR达到24.8%,疾病控制率(DCR)达42.4%,中位无进展生存期(PFS)为4.1个月,中位OS达到7.9个月。
04、ARX788
ARX788 是一种均质且高度稳定的ADC,靶向HER2受体。2021年,FDA授予ARX788快速通道资格用于治疗HER2阳性转移性乳腺癌。ARX788还被授予孤儿药资格治疗胃癌;被纳入中国国家药监局药品审评中心(CDE)突破性治疗品种,适应症为:HER2阳性晚期乳腺癌二线治疗。
虽然曲妥珠单抗 deruxtecan(Enheurtu;T-DXd)已显示对乳腺癌患者有益,但数据显示,24.2% 的患者在服用该药物后 12 个月内病情进展。在 12 个月时,T-DXd 的无进展生存期 (PFS) 为 75.8 个月(95% CI,69.8-80.7),曲妥珠单抗 emtansine(Kadcyla;T-DM1)为 34.1 个月(95% CI,27.7-40.5)疾病进展的风险比为 0.28(95% CI,0.22-0.37;P < 0.001)。因此,研究人员认为 ARX788 可能会填补这一空白。[1]
3月1日,浙江医药发布公告,其子公司新码生物(NovoCodex)研发的注射用重组人源化抗HER2单抗-AS269偶联物ARX788,在关键临床ACE-Breast-02研究的预定中期分析中,已达主要疗效终点。据此结果,新码生物拟申请提前终止研究并向国家药品监督管理局药品审评中心(CDE)提交新药上市申请。

此前,ACE-Breast-01试验证实,在接受 ARX788 治疗的 29 名 HER2 阳性乳腺癌患者中,有 16 名 (66%) 的 ORR 为 ORR。在 1.5 mg/kg 队列中观察到的疾病控制率 (DCR) 为 100%。这项研究表明,ARX788 总体上具有良好的耐受性,大多数不良事件为 1 级或 2 级且可控。
ACE-Breast-03 是一项全球性、单臂、2 期研究,评估 ARX788 在转移性 HER2 阳性乳腺癌患者中的抗癌活性和安全性。在 2022 年圣安东尼奥乳腺癌研讨会上公布了ACE-Breast-03 研究第2阶段的初步结果,经 RECIST v1.1证实ORR为57.1%,在接受过大量预治疗的HER2患者中的DCR为100%。治疗的中位时间为7.2个月,并且治疗仍在进行中。
05、SYD985
2022年7月18日,欧洲药品管理局(EMA)受理新一代靶向HER2的抗体偶联药物(ADC)trastuzumab duocarmazine(SYD985)治疗不可切除的HER2阳性局部晚期或转移性乳腺癌患者的上市申请。此前FDA接受了该药的生物制剂许可申请(BLA),并计划在2023年5月12日之前就此次BLA作出决定。基于I期数据(NCT02277717),SYD985已于2018年1月获得了FDA的快速通道认证,用于重度预治疗的HER2阳性MBC患者。
BLA是基于关键的III期TULIP试验(NCT03262935)的积极结果:与医生选择治疗(PC)相比,SYD985为目标患者人群带来无进展生存(PFS)的显著改善,达到试验的主要终点。TULIP研究(NCT03262935)将既往接受过≥2种MBC治疗方案或既往接受过T-DM1治疗的HER2阳性MBC患者随机2:1分配至SYD985(1.2 mg/kg,每3周一次)治疗组(n=291)和PC(n=146)。主要终点是盲态中心审查评估PFS。
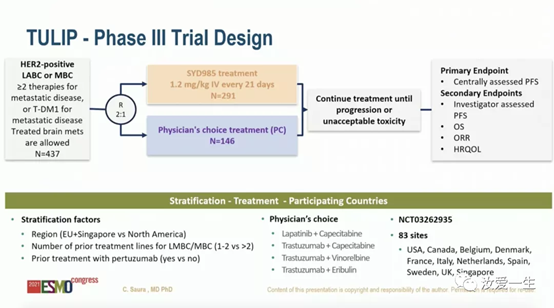
结果显示,中心审查的SYD985组中位PFS为7.0个月 (95%CI,5.4-7.2),PC组为4.9个月(95%CI,4.0-5.5)(HR=0.64;95%CI,0.49-0.84;P = .002)。同样,研究者评估PFS分别为6.9个月(95%CI,6.0-7.2)和4.6个月(4.0-5.6)(HR=0.60;95%CI,0.47-0.77;P < .001)。在首次OS分析中,SYD985组与PC组的中位OS分别为20.4个月(95%CI,18.0-23.7)与16.3个月(95%CI,13.4-22.8)(HR=0.83;95%CI,0.62-1.09;P = .153)。未观察到ORR(27.8% vs 29.5%)或HRQoL存在显著差异。

06、SHR-A1811
注射用SHR-A1811是恒瑞医药自主研发的、以HER2为靶点的ADC。3月16日,CDE官网公示注射用SHR-A1811纳入突破性治疗品种,拟定适应症为:注射用SHR-A1811单药治疗既往含铂化疗失败的HER2突变的晚期非小细胞肺癌患者。
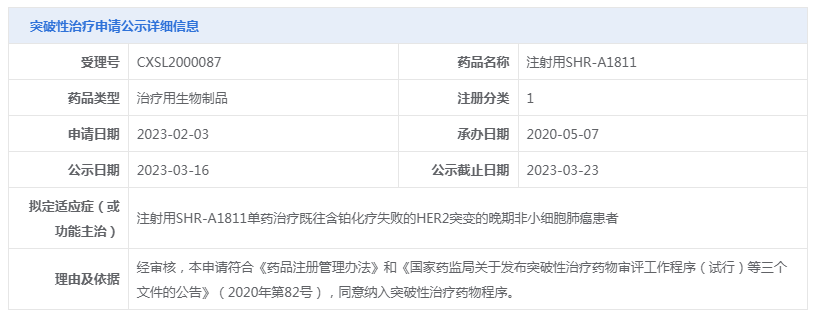
在今年2月份,注射用SHR-A1811分别针对于HER2低表达的复发或转移性乳腺癌及HER2阳性的复发或转移性乳腺癌两项适应症已被CDE纳入突破性治疗品种。
参考来源:
[1] https://www.targetedonc.com/view/emerging-data-behind-2-antibody-drug-conjugates-for-breast-and-prostate-cancer


