Gut:中山大学郑健/林东昕/林俊忠通过单细胞转录组学分析解读结直肠癌及其器官特异性转移中的异质癌干细胞样细胞
时间:2023-12-06 14:34:05 热度:37.1℃ 作者:网络
转移是癌症死亡的主要原因。然而,原发肿瘤中的异质癌细胞类型以及它们如何转移到靶器官在很大程度上仍未被发现。
2023年12月1日,中山大学郑健、林东昕及林俊忠共同通讯在Gut在线发表题为“Single-cell transcriptomic analysis deciphers heterogenous cancer stem-like cells in colorectal cancer and their organ-specific metastasis”的研究论文,该研究利用单细胞转录组学分析解读了结直肠癌及其器官特异性转移中的异质癌干细胞样细胞。对上皮细胞的综合分析显示,一个具有高蛋白酪氨酸磷酸酶受体O型(PTPRO)和无毛鳞片样2 (ASCL2 )表达的干细胞簇是转移的罪魁祸首。这个细胞群由不同的亚群组成,显示出不同的肝脏或卵巢转移偏好。
高表达delta-样配体4 (DLL4)和MAF bZIP转录因子A (MAFA)的Population 1 (P1)细胞在原发性结直肠癌和oCRC中富集,因此可能与卵巢转移有关。P3细胞与胆管细胞具有相似的表达模式,主要见于原发性CRC和lCRC,可能是特异性转移到肝脏的罪魁祸首。干细胞样细胞通过DLL4-NOTCH信号通路与癌症相关成纤维细胞和内皮细胞相互作用,从原发性结直肠癌转移到卵巢。在oCRC微环境中,肌成纤维细胞为癌细胞提供谷氨酰胺并进行代谢重编程,这可能是癌细胞在卵巢中定位和发展所必需的。

结直肠癌(CRC)是世界上第三大最常见和致命的癌症肿瘤转移占结直肠癌死亡的90%,据报道5年生存率 < 20%。虽然CRC最常见的转移部位是淋巴结、肝脏和肺部,但也有一部分CRC可以转移到骨骼和卵巢CRC的卵巢转移被认为是由恶性细胞通过腹水从浆膜表面扩散到腹膜腔直接定植的。在过去的五十年中,对各种类型癌症的研究表明,尽管肿瘤中存在许多异质细胞,但只有某些类型的恶性细胞可以驱动复发和远处转移。然而,迄今为止,似乎没有系统的研究表明哪种亚型的异质性CRC细胞倾向于远处转移。
单细胞RNA测序(scRNA-seq)可以解剖异质性肿瘤并破译细胞组成。最近的研究比较了原发性结直肠癌和肝转移性结直肠癌(lCRC)微环境中的细胞组成,发现与原发性结直肠癌相比,某些免疫细胞亚型,如肿瘤相关巨噬细胞和周细胞,在lCRC中显著富集。另一项研究报道,与原发性结直肠癌相比,lCRC中未成熟浆细胞增加,但活化B细胞减少在CRC和lCRC的微环境中,仍不清楚哪种亚型的恶性细胞是转移的罪魁祸首。此外,卵巢转移性结直肠癌(oCRC)的肿瘤微环境和细胞组成尚未被探索。
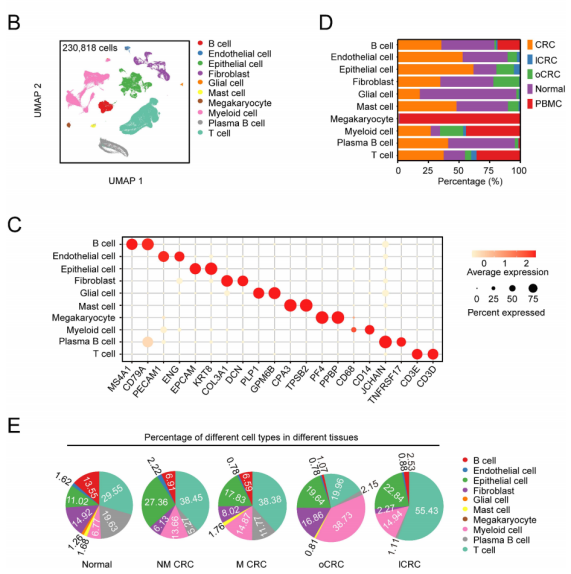
人类结直肠癌的单细胞转录组景观(图源自Gut )
该研究对原发性CRC和lCRC或oCRC进行了scRNA-seq和空间转录组学分析,发现表达蛋白酪氨酸磷酸酶受体O型(PTPRO)的干细胞样细胞簇是CRC的转移起始物。这些干细胞样细胞在决定细胞转移到肝脏或卵巢的转录模式方面也表现出异质性。oCRC的发展依赖于转移细胞与癌相关成纤维细胞(cancer-associated fibroblasts, CAFs)或内皮细胞之间NOTCH信号通路的相互作用网络,肌成纤维细胞也在微环境中产生代谢活跃状态,帮助oCRC生长。总的来说,该研究为CRC转移到卵巢和肝脏提供了重要的见解,并确定了CRC细胞的器官特异性转移亚型。这些结果可能为结直肠癌器官特异性转移提供重要的理论依据。
原文链接:
https://gut.bmj.com/content/early/2023/11/30/gutjnl-2023-330243


