更准确识别寡转移性NSCLC,ctDNA液体活检指导风险分层和治疗决策
时间:2023-12-14 19:50:27 热度:37.1℃ 作者:网络
寡转移性非小细胞肺癌(NSCLC)患者的最佳治疗范式尚不清楚。一些寡转移性疾病患者在局部巩固放疗(RT)后缓解时间较长,而另一些患者具有微转移性疾病(低于影像学检测限),从全身治疗中获益。为了进行风险分层,识别最有可能从局部巩固RT中获益的患者,我们开展了一项多机构队列研究,分析了 1487 例接受循环肿瘤 DNA(ctDNA)液体活检的寡转移性 NSCLC 患者。共 1880 次液体活检,约 20% 的患者(n = 309)在诊断为寡转移性疾病之后在RT之前进行了 ctDNA 检测。RT前未检测到ctDNA(使用Tempus xF测定血浆中致病性或可能致病性变异)的患者无进展生存期(PFS)(P = 0.004)和总生存期(OS)(P = 0.030)显著较优。RT前ctDNA最高变异丰度(VAF)和RT前ctDNA突变负荷与PFS(最高VAF P=0.008,突变负荷 P=0.003)和OS(最高VAF P=0.007,突变负荷 P=0.045)呈显著负相关。这些发现经多变量Cox比例风险模型证实,该模型包括八个额外的临床和基因组参数。总体而言,这些数据表明,在寡转移性 NSCLC 患者中,RT前 ctDNA 或可识别最有可能从局部巩固RT中获益,PFS 和 OS 较长的患者。类似地,ctDNA可能有助于识别未诊断的微转移性疾病,这类患者可能适合优先考虑全身治疗。
研究背景
寡转移性非小细胞肺癌(NSCLC)为个体化液体活检指导治疗提供了独特的机会。具有广泛转移性疾病的 NSCLC 患者无法治愈,通常预后较差,而转移性疾病负荷较低的患者有时可以通过全身药物联合局部巩固疗法(如 RT)对原发肿瘤和转移灶进行根治性治疗后获得长期缓解。
然而,识别真正患有寡转移性疾病,最有可能从局部巩固RT中获益的患者具有挑战性。许多影像学显示的寡转移性 NSCLC 患者可能携带未被发现的低于当前影像学技术检测限的广泛转移性疾病(微转移性疾病)。确定新的液体活检生物标志物,将真正患有寡转移性疾病的患者与患有广泛微转移性疾病的患者区分开来,可能会改变治疗方法。对于有微转移性疾病迹象的患者,除了避免与局部巩固治疗相关的费用、全身治疗中断和潜在副作用外,还可以将患者分流到早期全身治疗或参加临床试验。类似地,临床医生可以就延长缓解时间的可能性向患者提供更具体的指导,并可能为液体活检未显示微转移性疾病的真正寡转移患者提供更积极的局部巩固治疗。
我们之前表明,在局限性 NSCLC 中,RT后血浆循环肿瘤 DNA(ctDNA)具有很强的预后意义。本研究中,我们假设 ctDNA 分析可以更早地(RT前)应用于寡转移性 NSCLC 患者的风险分层,指导局部巩固放疗vs全身治疗的个体化决策。
研究结果
本研究使用了一个多机构真实世界队列,包括来自学术和社区诊所的 1487 例被诊断为寡转移性 NSCLC 的患者。2016 年至 2022 年期间收集了外周血样本用于液体活检。队列平均年龄(SD)为 64.7岁(10.1岁),男性和女性患者数量相似(女性784例 [53%],男性703例 [47%])[表1]。约 73% 的患者为腺癌,18% 为鳞状细胞癌,9% 没有组织学亚型信息或为其他 NSCLC 亚型。每位患者在不同时间点使用Tempus xF进行ctDNA分析,共1880次ctDNA检测 [表2]。选出了一组明确在诊断为寡转移性疾病之后在RT之前进行ctDNA液体活检的患者(n = 309)进行分析。为了控制选择偏倚,对所有该队列之外的患者(n = 1178)进行了重复分析,证明了按ctDNA结果分层的OS和PFS的类似显著发现。
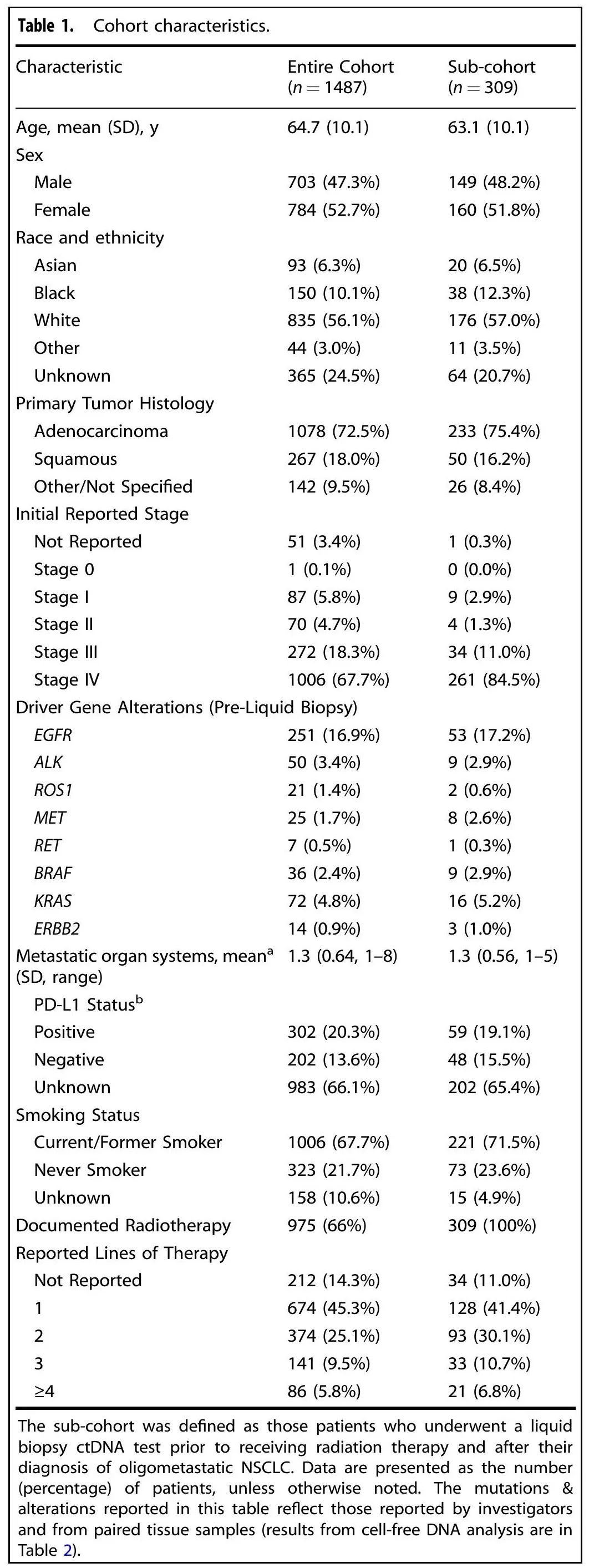

表1
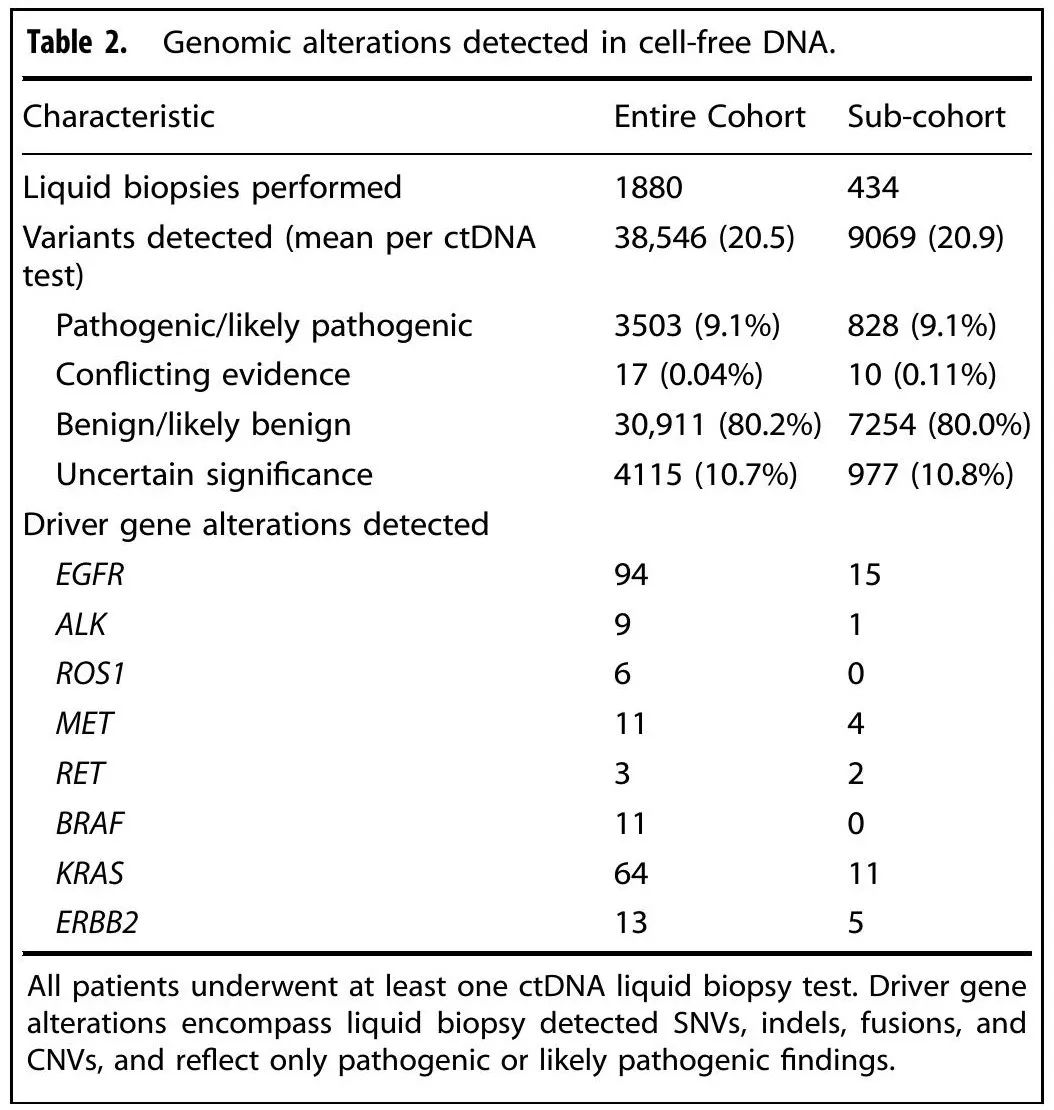
表2
ctDNA分析
初始采血用于液体活检后的中位随访时间为10.3个月。在所有 ctDNA 检测中,共识别 3503 个致病性或可能致病性变异(平均 1.8 个变异/样本)。在诊断为寡转移性疾病之后RT之前接受液体活检的 309 例患者中,48%(n = 151)在研究期间出现疾病进展,11%(n = 34)在研究期间死亡。ctDNA定量基于血浆中致病性或可能致病性变异的检出。74% 的寡转移性 NSCLC 患者在RT前(n = 230)检测到 ctDNA,而其余 26%(n = 79)在RT前未检测到 ctDNA。在 230 例 ctDNA 可检测到的患者中,76%(n = 175)有 1-3 个变异,而其余(n = 55)有 ≥4 个致病性或可能致病性变异。
RT 前检测到 ctDNA 的寡转移性 NSCLC 患者无进展生存期(PFS)和总生存期(OS)均显著差于RT 前未检测到 ctDNA 的患者。RT 前检测到和未检测到 ctDNA 的患者的中位PFS分别为5.4个月和8.8个月(p = 0.004,HR = 1.57,置信区间 [CI] = 1.15–2.13)[图1a]。总生存期也观察到类似的结果,中位OS分别为16.8个月和 25个月(p = 0.030,HR = 1.65,CI = 1.05–2.61)[图1b]。

图1
ctDNA水平(由VAF定义)显示出显著的风险相关性,RT前最高ctDNA VAF与疾病进展(p = 0.008)和死亡(p = 0.007)风险较高相关。PFS(p = 0.025,HR = 3.78,CI = 1.08–11.30)[图2a] 和OS(p = 0.006,HR = 5.42,CI = 1.49–17.03)[图2b] 多变量Cox比例风险模型证实了这些发现。值得注意的是,除了RT前ctDNA水平外,OS多变量Cox模型仅显示患者接受的治疗线数的显著影响(p = 0.044),而关于PFS,鳞状组织学和诊断年龄也显示出显著性。其他临床和基因组参数,包括性别、吸烟状况、转移负荷、初始疾病分期以及已知常见突变和变异的存在,与生存结局的相关性不显著。
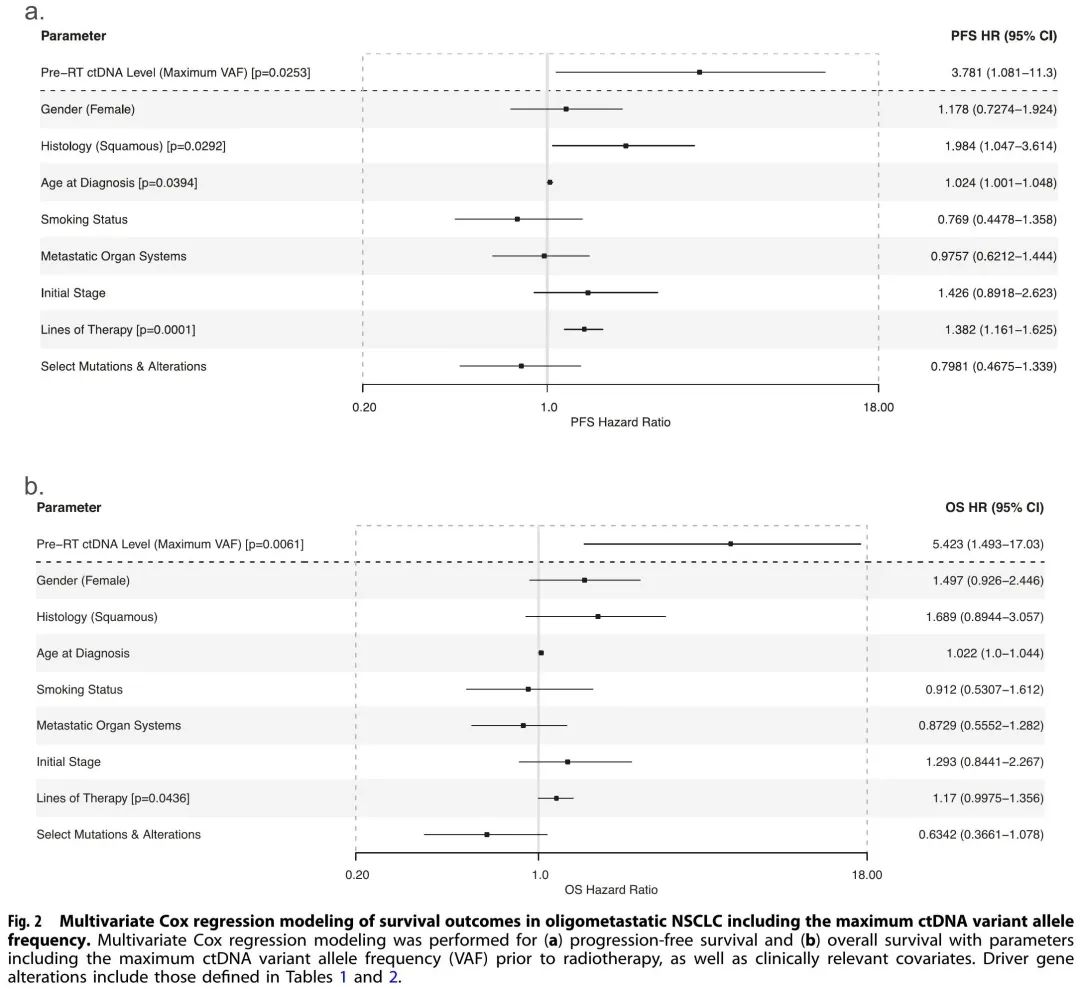
图2
当根据RT前ctDNA突变负荷(血浆中检测到的致病性或可能致病性变异的数量)对患者进行分层时,观察到类似的发现,ctDNA突变负荷较高与进展(p = 0.003)和死亡(p = 0.045)相关。PFS(p = 0.004,HR = 1.14,CI = 1.03–1.24)和OS(p = 0.014,HR = 1.13,CI = 1.02–1.23)多变量Cox比例风险模型再次证实了这些发现。除了RT前ctDNA突变负荷外,在多变量分析中,患者接受的治疗线数再次与OS显著相关(p = 0.039),而其他临床和基因组参数则不然。
转化意义
自 1995 年 Hellman 和 Weichselbaum 首次提出寡转移性疾病以来,其定义一直较为主观。最初,仅考虑对脑或肾上腺孤立转移的特定 NSCLC 患者进行局部疾病控制治疗。最近,纳入了具有 3 或 5 个以下转移性病灶患者的 2 期研究显示,接受局部消融RT后生存结局改善。目前的试验正在探索这种以放疗为导向的范式是否也可能使转移性病灶数量更多的患者获益,突出了需要更准确的患者选择方法。本研究结果表明,RT前ctDNA液体活检可作为首个客观地重新定义寡转移性疾病的精确生物标志物,能够使肿瘤学家为患者提供更具体的关于RT控制疾病的建议,对于ctDNA显示侵袭性微转移性疾病的患者,优先考虑全身治疗。
据我们所知,本研究是迄今为止关于寡转移性 NSCLC 液体活检的最大真实世界分析,使用了多机构 1487 例接受 1880 次液体活检的患者的数据集。我们的分析表明,RT前ctDNA检测可以对真正的寡转移性NSCLC患者与可能患有广泛微转移性疾病(低于当前影像学检测限)的患者进行风险分层,其他最近的研究也支持这一发现。我们的模型表明,ctDNA定量,包括突变负荷或VAF代表的ctDNA总量,能够为疾病进展和生存风险提供信息。
应开展重新定义寡转移性 NSCLC 的临床试验,纳入包括低或无法检测到的 ctDNA 水平的液体活检指标,来前瞻性评估这种方法。对于那些接受早期NSCLC根治性治疗,但随后发生寡转移性疾病(被认为“寡复发”),正在权衡个体化治疗决策的患者,该技术也可能很有价值。
局限性
这是一项真实世界研究,数据收集自多个临床机构,包括学术和社区诊所。包括转移和RT在内的临床数据由临床医生提供。由于寡转移性疾病诊断和RT确切时间的数据不完整,我们关注在RT之前明确进行液体活检的寡转移性 NSCLC 患者。进展状态由不同的临床医生评估,没有标准。有器官系统水平的转移数据,可能无法真实反映疾病负荷。值得注意的是,ctDNA水平与转移负荷无关。这一发现,加上ctDNA与OS和PFS显著相关,提示ctDNA可能比传统的基于影像学的转移负荷测定方法更客观地反映疾病负荷、侵袭性和潜在生物学。放疗计划由不同的临床医生决定,不一定针对所有转移部位。尽管这导致数据集的临床异质性,但也可能更准确地捕获真实世界的临床实践模式,提示我们的临床相关液体活检结果具有更广泛的可扩展性。此外,在该真实世界队列中,我们显著的PFS数据得到了同样显著的OS数据的证实。
总之,本研究表明,RT前ctDNA 可能是一种强大的生物标志物,可以准确识别寡转移性 NSCLC 患者的微转移性疾病。使用该液体活检生物标志物进行早期风险分层可以支持未来的临床试验基于每位患者的ctDNA风险状况做出个体化决策。具有高风险 ctDNA 特征的患者可以优先接受全身治疗并潜在升级(避免 RT 相关全身治疗中断和潜在的 RT 毒性),而 ctDNA 检测不到或低风险 ctDNA 特征的患者可以接受局部立体定向巩固RT。
参考文献:
Semenkovich NP, Badiyan SN, Samson PP, Stowe HB, Wang YE, Star R, Devarakonda S, Govindan R, Waqar SN, Robinson CG, Vlacich G, Pellini B, Chaudhuri AA. Pre-radiotherapy ctDNA liquid biopsy for risk stratification of oligometastatic non-small cell lung cancer. NPJ Precis Oncol. 2023 Oct 2;7(1):100. doi: 10.1038/s41698-023-00440-6. PMID: 37783809; PMCID: PMC10545784.


