【衡道丨病例】诊断明确,就是“完美”的病理报告了吗?——1例胃体多发性息肉的病理诊断思路
时间:2024-01-12 20:44:22 热度:37.1℃ 作者:网络
病例资料
患者女性,52岁,因体检发现胃底体部多发性息肉住院后行内镜下息肉切除术(ESD/EMR,图1)。
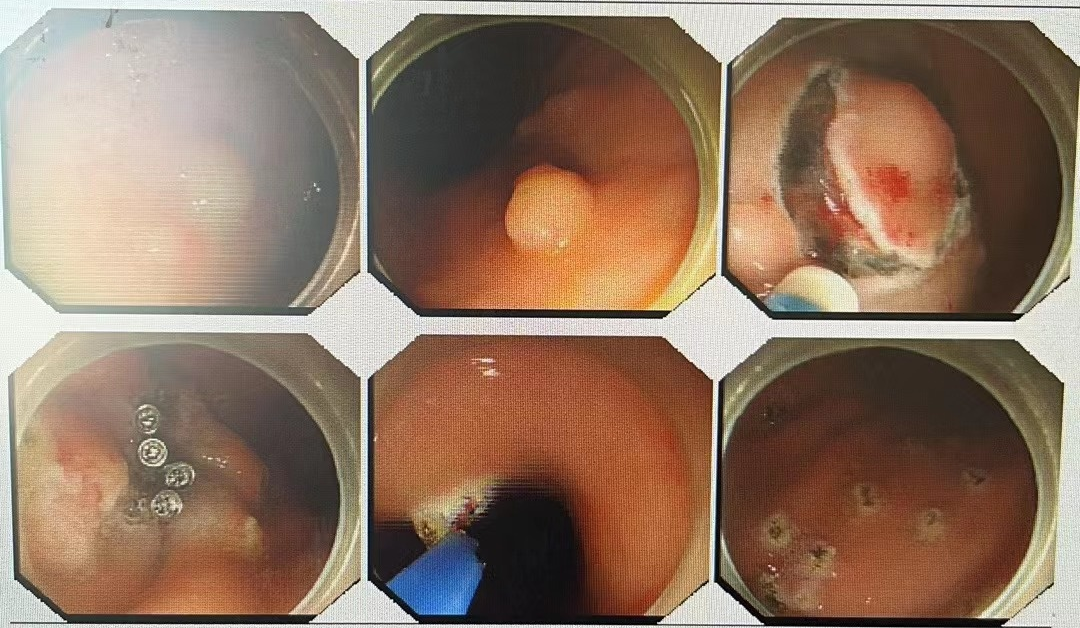
图1
大体:(胃底体部)送检灰红色息肉样组织10块,直径0.4-1.2cm,分两个蜡块取材。
病理形态镜下表现:
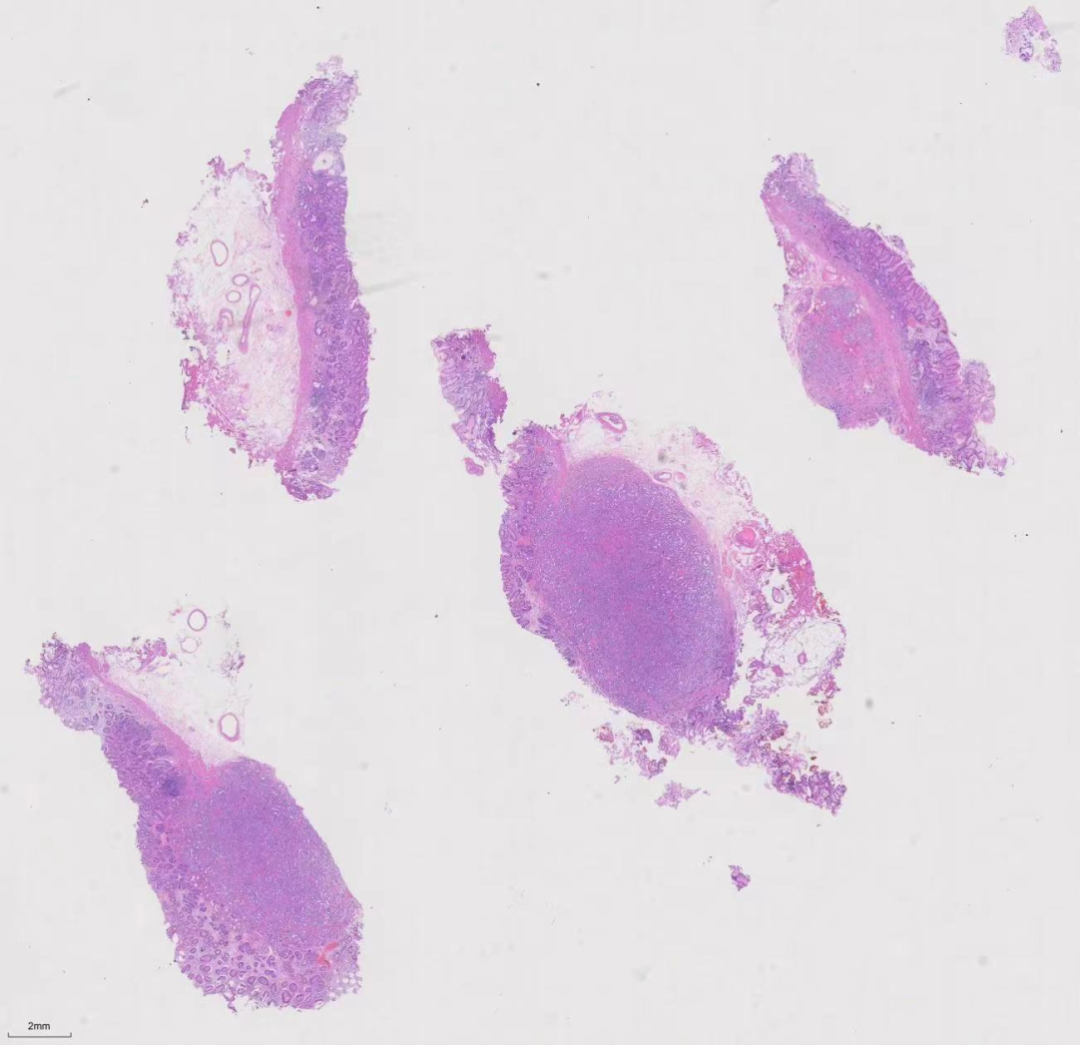
图2.低倍镜下可见病变主要位于黏膜下层和黏膜层的基底部
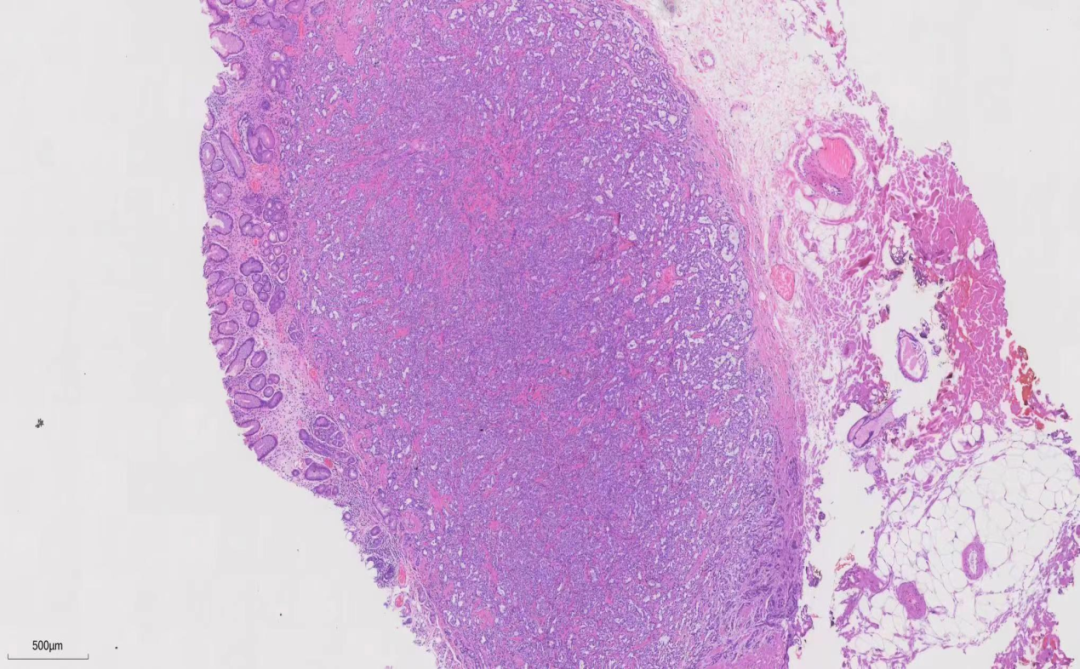
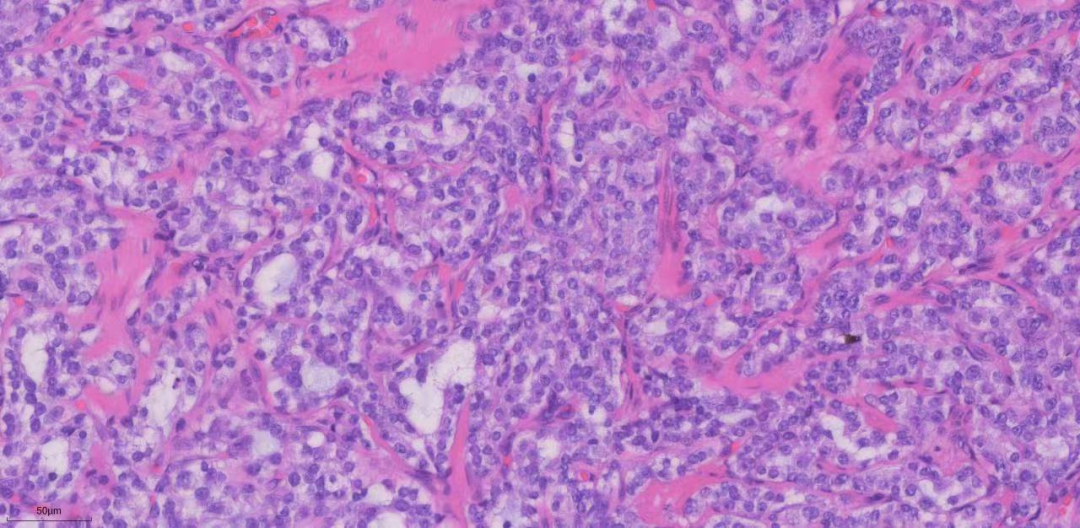
图3.图4.高倍镜下所有的病变形态一致,肿瘤细胞排列呈小巢状或腺管样结构,细胞核圆形或卵圆形,核形态一致,染色质呈细颗粒状/胡椒盐样,偶尔可见小核仁,未见核分裂像,间质促纤维增生不明显,形态学考虑神经内分泌肿瘤。
免疫组化
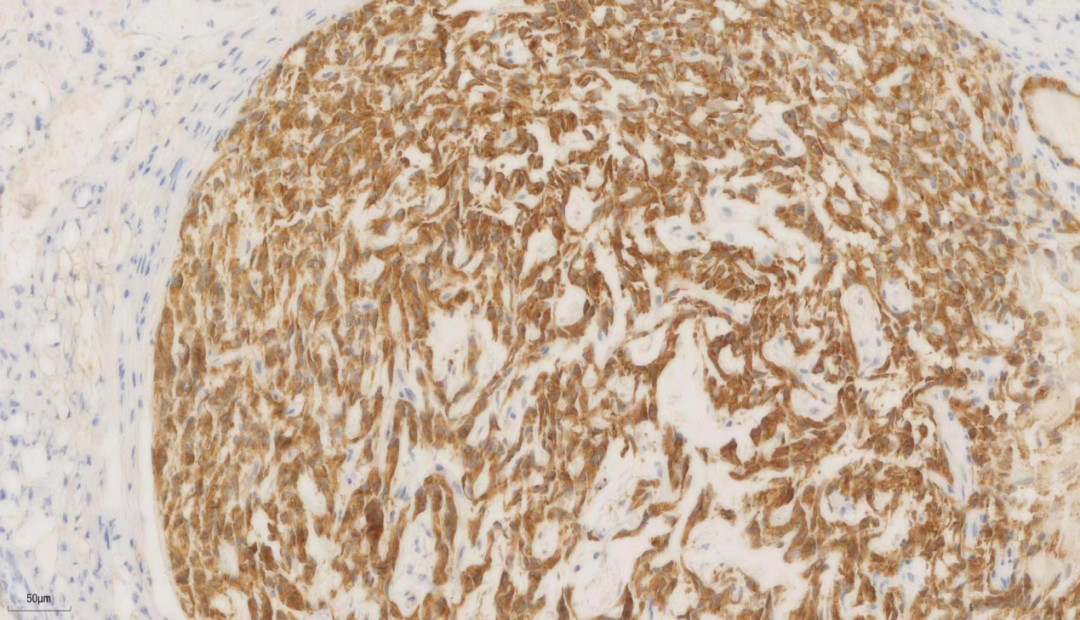
图5.syn
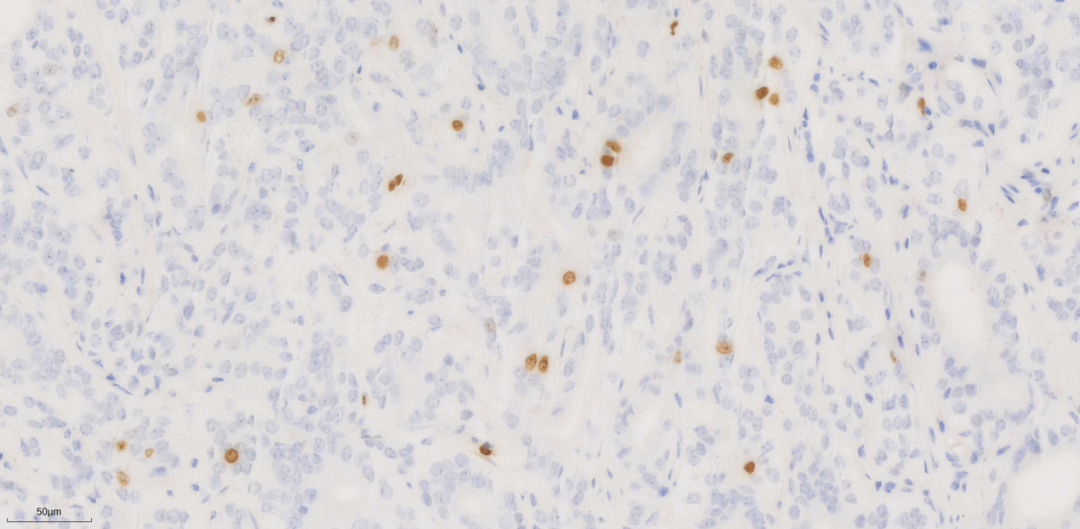
图6.Ki67
免疫组化结果:
syn弥漫阳性(图5),AE1/AE3+、CgA+、CD56+、SSTR2+(未显示),ki67(5%,图6)。
病理诊断
结合组织学形态和免疫组化结果,神经内分泌瘤,G2。基底部切缘阴性。
诊断明确,病理报告也发了出去,但这样的一份病理报告是否就是完美的病理报告了?——病理人要时常自我反省,查漏补缺。接着往下看:
进一步诊断
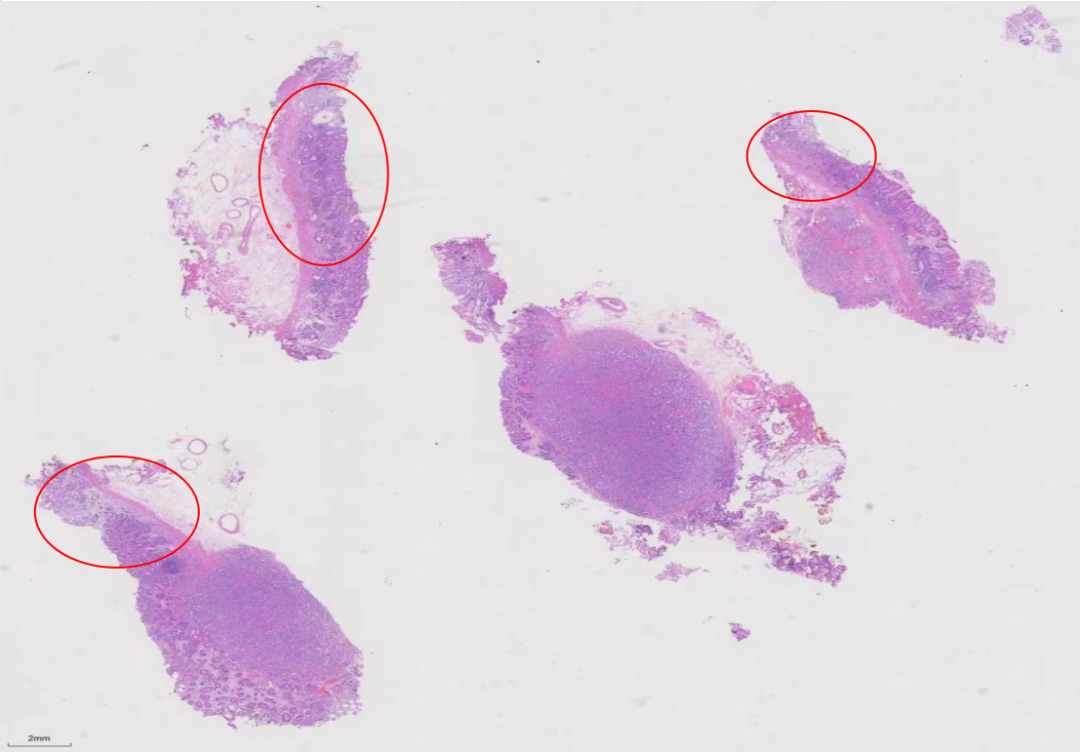
图7.在组织的周边和肿瘤表面都带有良性的正常黏膜组织
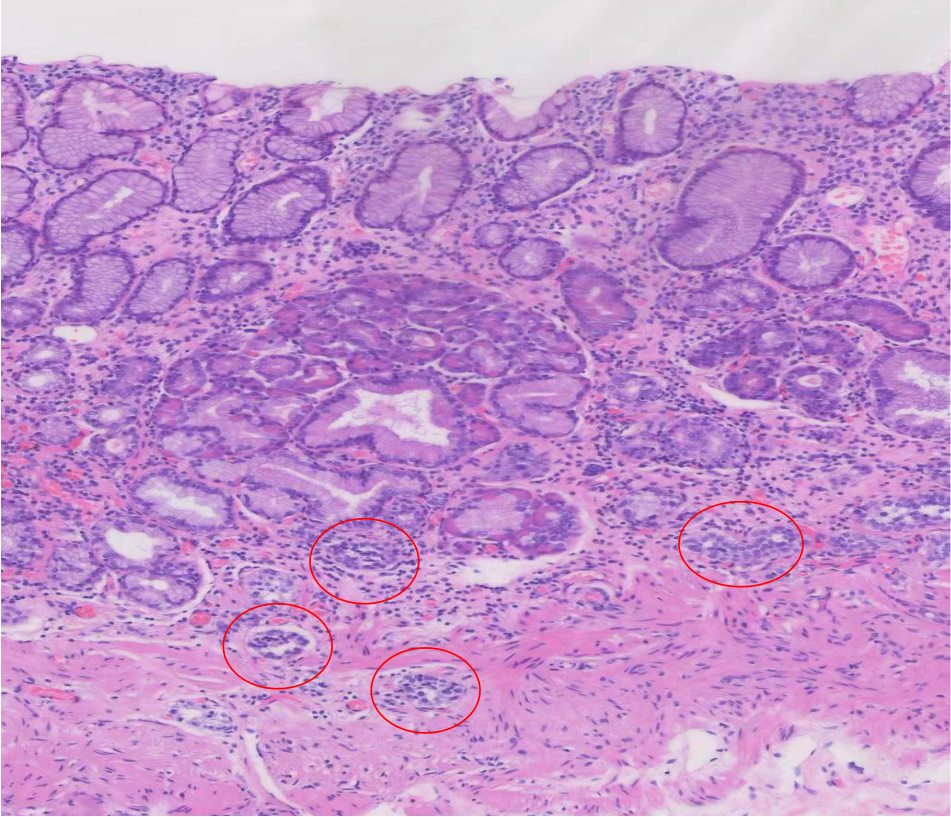

图8.图9.周围黏膜。
如果临床不告诉我是取自于胃底体部,还以为是胃窦部黏膜,显著的变化是胃底腺(主细胞+壁细胞)数量明显减少甚至消失,代之是出现了幽门腺,另一方面在远离肿瘤主体的黏膜层基底部及黏膜肌层内可见小巢状或腺管样分布的上皮样细胞,细胞形态和肿瘤主体的肿瘤细胞类似,核形态温和,这些小巢团部分形态不规则,部分有融合。
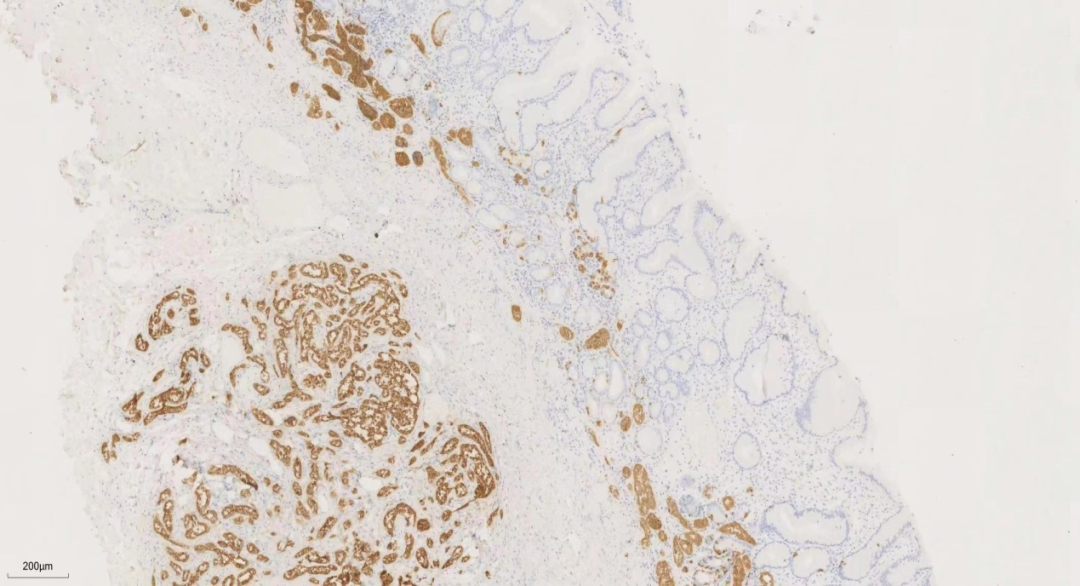
图10.syn
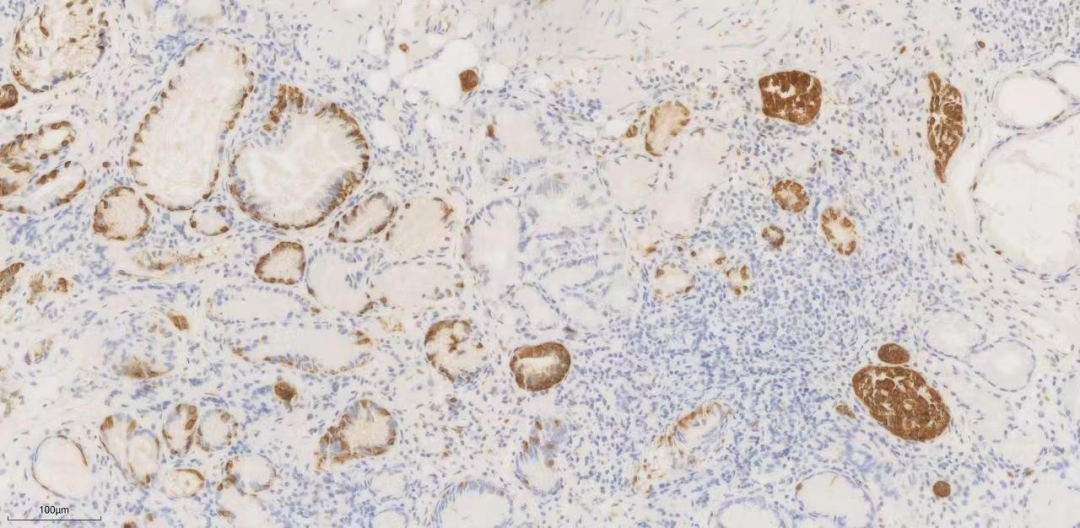
图11.syn
SYN免疫组化可见在周围黏膜基底部及黏膜肌层内分布的小巢团均阳性,提示有神经内分泌细胞的微结节状增生、线性增生及不典型增生。
查看电子病历患者的病史及实验室检查结果:
血常规:
红细胞计数2.29*109/L(3.8-5.1),HB 101g/L(115-150), 平均血红蛋白含量、平均血红蛋白浓度、平均红细胞容积均升高——提示巨幼贫 。
术后一个月患者因神经症状在神经内科住院,诊断脊髓亚急性联合变性(因B12缺乏引起的神经变性症状),患者长期在门诊行B12治疗。
自此患者的诊断才算大白:
自身免疫性萎缩性胃炎,1型多发性神经内分泌瘤,G2。继发维生素B12缺乏引起的巨幼红细胞性贫血及脊髓亚急性联合变性。
遗憾的是这个患者在消化科被诊断为多发性神经内分泌瘤,在神经内科被诊断为脊髓亚急性联合变性,却一致没有把真正的病因自身免疫性萎缩性胃炎诊断明确,也没有查血清胃泌素水平。
讨论
2019消化系统第五版WHO将胃的神经内分泌瘤除了根据核分裂像和KI67指数分级之外,还要根据病因和起源不同分为1型、2型和3型(图12)。
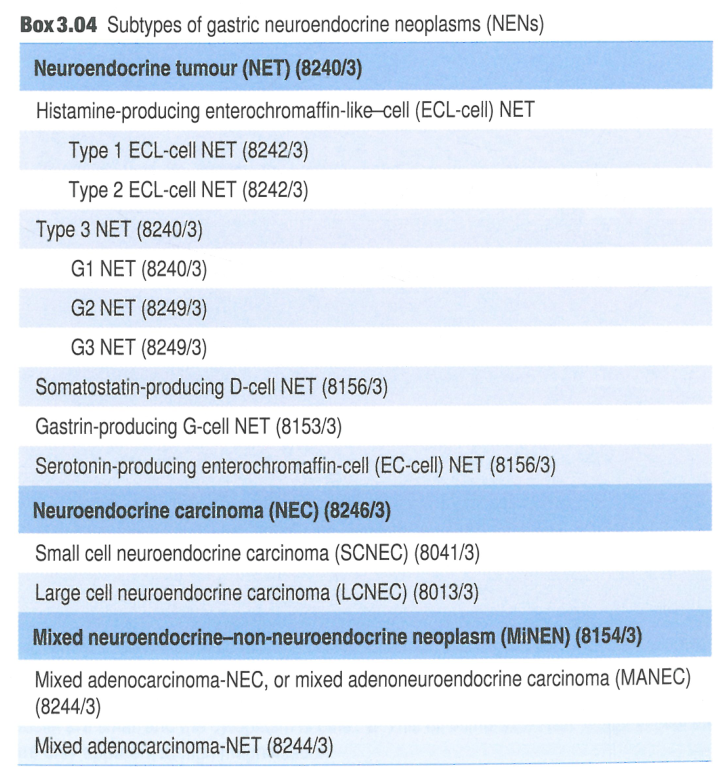
图12
1型和2型都是起源于胃底体部的ECL细胞。
1型与自身免疫型萎缩性胃炎相关,患者出现泌酸腺减少,胃酸缺乏,高胃泌素血症以及周围黏膜的神经内分泌细胞增生变化。
2型与多发性神经内分泌瘤综合征1型(MEN1)相关的胰腺和十二指肠胃泌素瘤发生有关,异位胃泌素瘤导致高胃泌素血症和神经内分泌细胞增生,但因患者无泌酸腺的破坏,泌酸腺在高胃泌素的刺激下会导致增生和胃黏膜的肥厚(有助于与1型鉴别)。
3型胃散发性神经内分泌瘤,可以发生与胃底体部或者胃窦部,肿瘤周围胃黏膜正常,无萎缩或者肥厚,血清胃泌素水平正常,肿瘤周围胃黏膜不会出现神经内分泌细胞增生性改变(线性增生、微结节状增生、异型增生,鉴别见图13)。
三者的鉴别至关重要(见图14),因为其预后和治疗方法均不一样。其中3型预后最差,2型次之,1型预后较好。
治疗上:
1型需要临床终身随访,每6-12个月做一次胃镜。 连续的病变或直径大于0.5cm内镜下切除,补充B12。只有当内窥镜切除不可行或存在不良预后因素时,才需要手术治疗 ;
2型的治疗包括定位和切除胃泌素瘤,对于胃病变,除非有预后不良的因素,内镜下切除就足够了;
3型病变应积极地进行全胃或次全胃切除术(取决于部位)和淋巴结切除术,如果有可切除的转移性病变,也应该进行治疗,对于不可切除的肝转移灶,局部治疗如动脉栓塞或放射消融术,如果有肝外转移或有症状的疾病复发,可以采用细胞毒性化疗或分子靶向药物进行全身治疗。
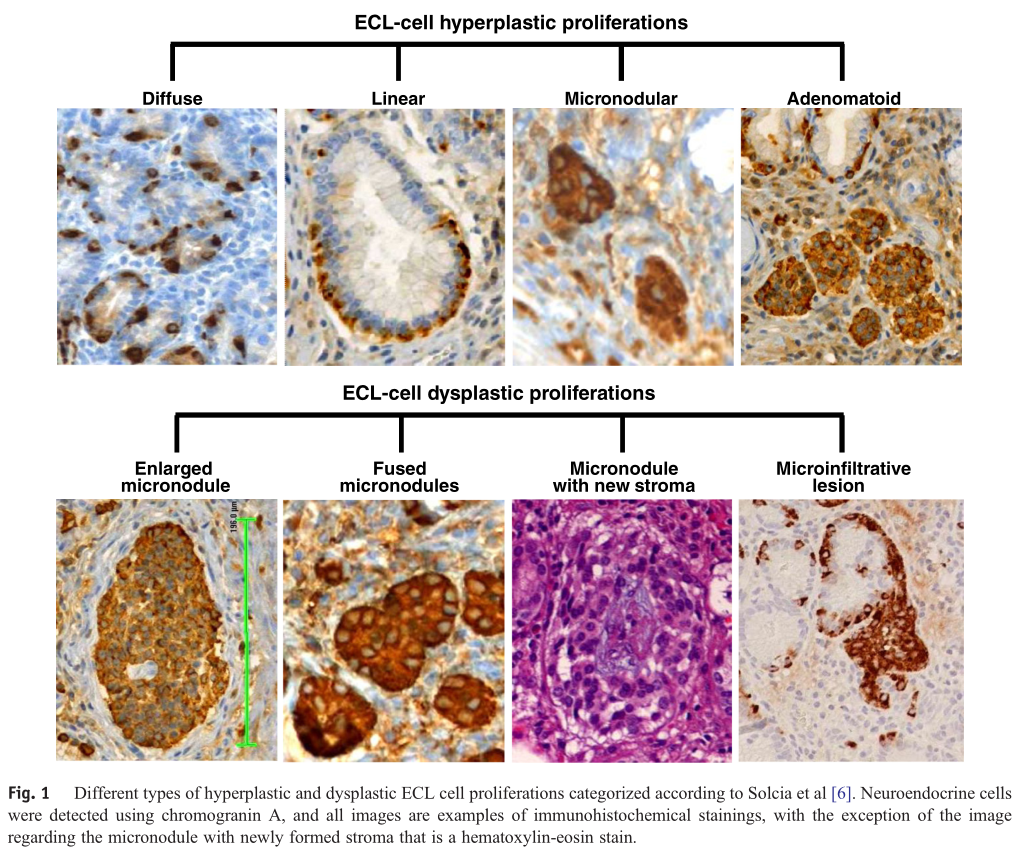
图13
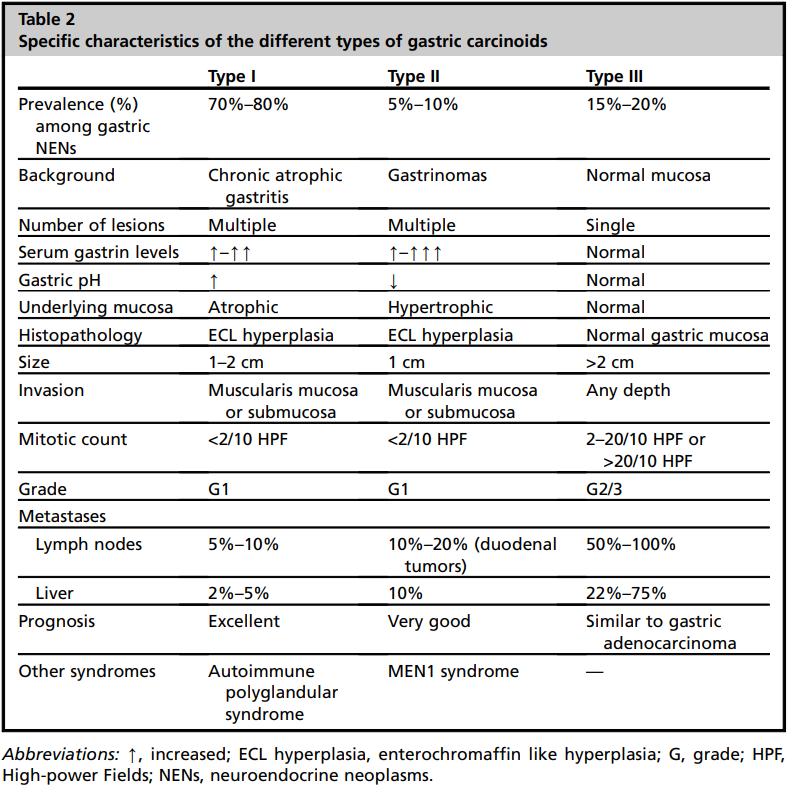
图14
参考书籍及文献:
1.La Rosa S, Vanoli A. Gastric neuroendocrine neoplasms. In:Fukayama M, Rugge M, Washington M, eds. Digestive System Tumours. WHO Classification of Tumours, Vol. 1. IARC Press; 2019:104-109
2.Vanoli A, La Rosa S, Luinetti O, Klersy C, Manca R, Alvisi C, Rossi S, Trespi E, Zangrandi A, Sessa F, Capella C, Solcia E. Histologic changes in type A chronic atrophic gastritis indicating increased risk of neuroendocrine tumor development: the predictive role of dysplastic and severely hyperplastic enterochromaffin-like cell lesions. Hum Pathol. 2013 Sep;44(9):1827-37. doi: 10.1016/j.humpath.2013.02.005. Epub 2013 May 2. PMID: 23642738.
3. Grozinsky-Glasberg S, Alexandraki KI, Angelousi A, Chatzellis E, Sougioultzis S, Kaltsas G. Gastric Carcinoids. Endocrinol Metab Clin North Am. 2018 Sep;47(3):645-660. doi: 10.1016/j.ecl.2018.04.013. Epub 2018 Jul 11. PMID: 30098721.


