Mol Neurodegener:Aβ特异性调节性T细胞减轻阿尔茨海默病病理
时间:2024-01-12 20:56:17 热度:37.1℃ 作者:网络
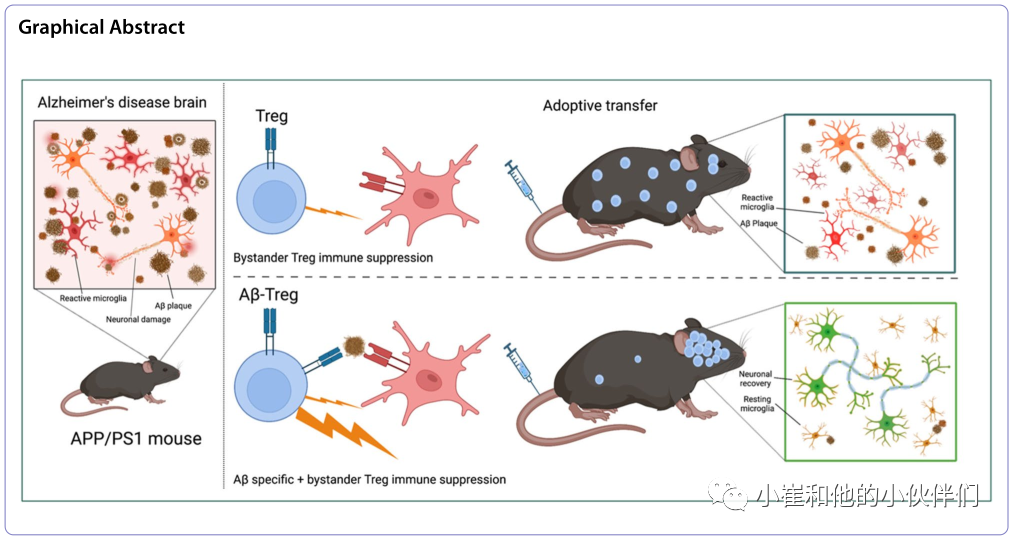
调节性T细胞(Tregs)维持免疫耐受。虽然Treg介导的神经保护活性现在已经被广泛接受,但缺乏明确的抗原特异性限制了它们的治疗潜力。在神经退行性疾病中,需要细胞进入受损的大脑区域,以实现疾病特异性靶向治疗和改善愈后,为了解决这一问题,近期,《Molecular Neurodegeneration》上发表了题为“Amyloid-β specific regulatory T cells attenuate Alzheimer’s disease pathobiology in APP/PS1 mice”的研究性文章,作者团队通过对Aβ(TCRAβ)特异性的T细胞受体(TCR)进行工程设计,将Aβ抗原特异性赋予Treg反应。过继转移TCRAβ-Tregs导致持续的免疫抑制,减少小胶质细胞反应和淀粉样蛋白负荷,恢复了大脑的稳态,并改善了学习和记忆,支持了抗原特异性Treg免疫疗法对AD的更多治疗益处。

1、研究背景
阿尔茨海默病(AD)是最常见的神经退行性疾病,在临床上表现为进行性认知功能衰退。病理上,疾病进展与细胞外淀粉样蛋白(Aβ)斑块沉积、细胞内神经原纤维缠结和神经炎症有关。目前的药物治疗方案只能提供症状方面的益处,在阻止疾病进展方面无效。疾病修饰疗法使用主动或被动免疫来清除Aβ斑块。虽然每一种方法在减少动物的斑块负担和认知缺陷方面都被证明是成功的,但在人体试验出现了不良反应。在主动免疫后,由于少数接受治疗的患者出现脑膜脑炎,研究被终止,这归因于效应T细胞(Teffs)的出现。Aβ疫苗诱导的CD4+Teffs细胞产生疾病相关的Aβ特异性Th1细胞。
因此,主动免疫的有效性目前仍不确定。最佳神经保护性免疫反应的发展,特别是在免疫系统减弱或受损的老年患者中,仍然具有挑战性。目前两种被动的Aβ特异性单抗疗法aducanumab和lecanemab已经获得美国食品和药物管理局(FDA)的批准,用于AD治疗,但由于淀粉样蛋白相关成像异常(ARIA)水肿和积液,显示出有限的成功率和不良事件的高发生率。
考虑到基于免疫的疾病修饰AD疗法的这些局限性,T细胞和基于嵌合抗原受体的疗法(TCR和CAR-T)是有吸引力的治疗选择。然而,鉴于在主动免疫策略中观察到的Th1诱导的不良事件,基于T细胞的AD治疗需要一个新的指导方针。众所周知Treg在疾病期间保持免疫耐受性,但这种耐受性可能会改变。在疾病状态下,Teffs对错误折叠的Aβ沉积产生反应,克隆性扩张,然后影响神经炎症和AD神经病理。在AD患者出现疾病症状之前就观察到了这种反应。
未来侧重于利用CD4+Tregs进行神经保护。这一新颖的想法提供了一种Treg的抗炎和免疫抑制活性在改善疾病中的特异性免疫信号。Treg诱导剂或多克隆Treg过继转移在不同的神经退行性疾病中提供保护。然而,这种多克隆Tregs也可能导致全身免疫抑制,从而增加传染病或肿瘤疾病的流行。因此,针对Aβ等致病病理蛋白的Treg可以克服非特异性免疫失调,是推动疾病特异性Treg治疗的理想药物,可以在广泛的神经退行性疾病中进一步推广。
因此作者团队研究了表达Aβ特异性TCR的Tregs(TCRAβ-Tregs)是否可以减轻APP/PS1小鼠的病理。作者假设TCRAβ-Treg靶向大脑中淀粉样蛋白丰富的区域,从而导致神经保护结果。在AD模型上,作者证明TCR Aβ - tregs靶向APP/PS1小鼠大脑,导致反应性小胶质细胞数量和组成减少,同时增加淀粉样斑块清除和改善认知功能。
2、结果一:Aβ特异性Tregs的制备
作者先前的研究证实了Aβ特异性T效应细胞(Aβ-Teffs)在APP/PS1小鼠中的病理生物学作用。用Aβ1-42免疫小鼠获得了高亲和力的Aβ-Teff克隆。从Aβ-Teff克隆中鉴定出TCR用于设计TCRAβ载体,用于慢病毒转导Treg受体细胞。作为工程化的第一步,利用CRISPR-Cas9技术删除了多克隆Treg初级分离物的内源TCRs。编码TCR的α-和β-链的gRNAs被电穿孔到从非转基因小鼠分离的多克隆Tregs中(图1A)。这导致超过95%的Tregs上的TCRs被删除。对TCR敲除Treg细胞(TCR---Treg)进行流式分选,并在一个多月内每周通过流式细胞术分析确认TCR缺失的稳定性。慢病毒方法被用来促进TCRAβ进入TCR−−-Treg。所生产的慢病毒载体能够用TCRAβ转染人PBMC、CEMS和HEK293细胞。然而,由于慢病毒对小鼠T细胞的转导很差,用TCRAβ慢病毒构建物稳定地转导小鼠Treg是不成功的。为了克服这一限制,将TCRAβ编码质粒(图1B)电穿孔到TCRA−−-Tregs中,产生TCRAβ-Tregs。TCRAβ编码基因的电穿孔在24 h内导致细胞死亡显著,而第二天恢复的存活细胞和流式细胞仪分析表明TCR在电穿孔后的4-6天内稳定表达(图1C,D)。通过TCRAβ的流式细胞术和MHCII-IAb-KLVFFAEDVG-SNKGA四聚体的染色增加,证实了TCRAβ的特异性(图1E)。
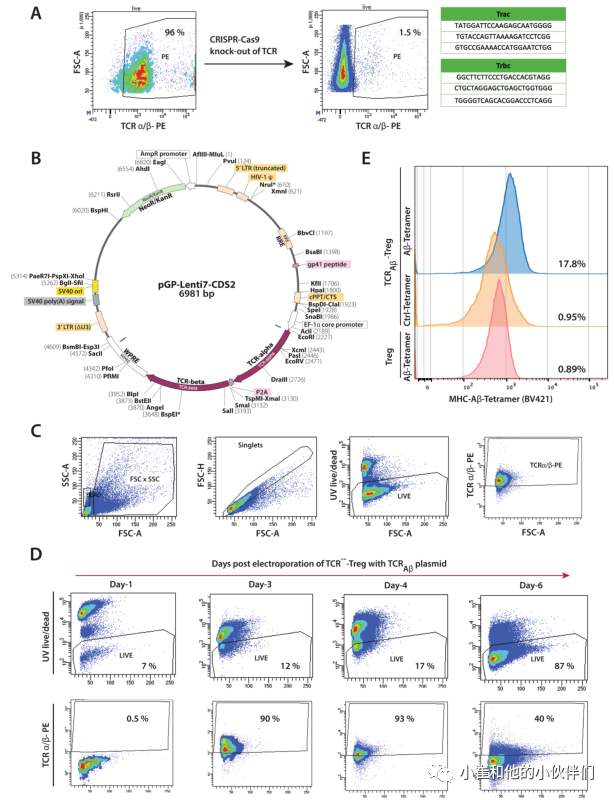
图1:TCRAβ-Treg的制备。
为了评估TCRAβ-Treg的功能,作者确定了它们抑制T反应细胞(Tresp)增殖的能力。在小鼠T细胞激活剂CD3/CD28存在下,通过将Aβ-Treg与CSFE标记的Tresp细胞共同孵育来评估其对Tresp的抑制功能。与多克隆Treg相比,敲除TCR(TCR---Tregs)抑制Tresp细胞增殖的能力没有显著降低(图2B),而TCRAβ-Treg显示出抑制Tresp细胞增殖的能力显著增加(图2A,B)。抑制功能的增加与电穿孔TCRAβ质粒的量呈剂量依赖关系。与接受0.25μL质粒的细胞相比,接受0.50μL TCRAβ质粒的细胞显示出更高的抑制功能。为了进一步证实Aβ特异性Treg抑制功能,进行了一种改良的Treg功能测定。用CD3/CD28预刺激CFSE标记的Tresps过夜,去除珠子,并在单独存在Aβ-四聚体作为刺激物的情况下,将受刺激的Tresps与TCRAβTregs共培养三天。与TCR---Treg相比,多克隆Treg对Teff细胞显示出类似的抑制作用(图2D,E)。与多克隆Tregs相比,TCRAβ-Treg显示Aβ-四聚体依赖性Teff抑制功能显著增加(图2D,E)。此外,作者使用小鼠细胞因子阵列试剂盒研究了用PMA和离子霉素刺激的工程TCR Aβ-Treg的细胞因子谱。与多克隆Tregs相比,TCRAβ-Tregs产生增加的Th2极化细胞因子(图2C)。此外,TCRAβ-Tregs显示IL-4的分泌增加,这支持IFN-γ的产生减少。参与体内Treg募集的趋化因子CCL2和CCL5也升高(图2C)。
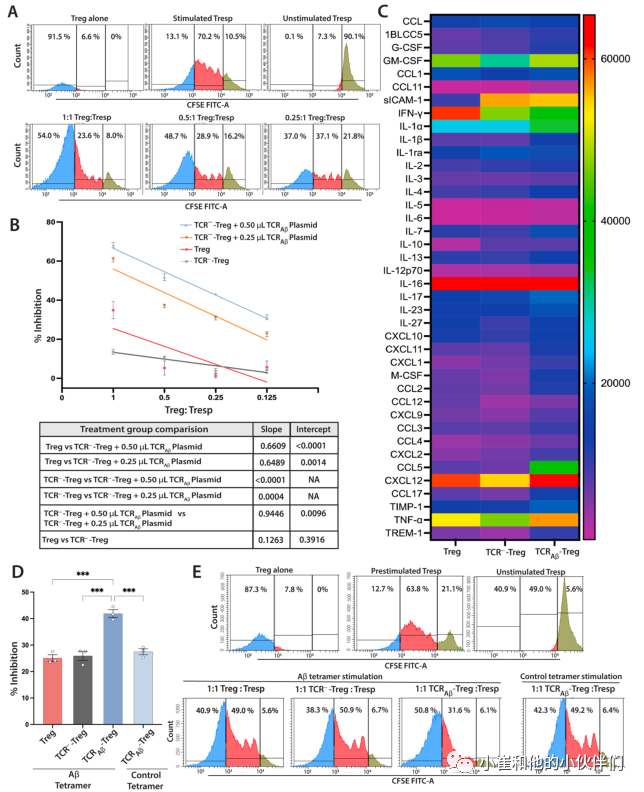
图2:TCRAβ-Treg免疫抑制功能的表征。
3、结果二:TCRAβ-Treg过继转移改善了记忆的形成
作者团队之前已证明过继转移1×106单克隆Aβ特异性Teff克隆会加速记忆损伤。由于电穿孔产生的TCRAβ-Treg仅瞬时表达TCRAβ,但具有功能性,作者过继转移1×106个细胞,每周一次,持续3周,并在最后的过继转移后的第二天进行RAWM和Y迷宫测试评估小鼠的空间学习和记忆。在Y迷宫测试中,与非转基因小鼠相比,APP/PS1小鼠表现出记忆障碍,臂进入次数显著减少(p<0.01)。接受TCRAβ-Tregs治疗的APP/PS1小鼠的臂进入次数增加。虽然与未经处理的APP/PS1小鼠相比,条目数量没有达到显著性,但与Treg或EV-Treg处理的APP/PS1小鼠相比,它们与non-Tg小鼠的条目数量没有统计学差异(图3A、B)。用多克隆Tregs或EV-Tregs(用空质粒载体电穿孔的TCR---Treg)处理的APP/PS1小鼠在测试的记忆结果上与未处理的APP/PS1小鼠没有差异。
在RAWM试验中,与非转基因小鼠相比,APP/PS1小鼠表现出记忆障碍的迹象,如后期保留试验T5中错误数量的显著增加所证明(图3C)。值得注意的是,与未经治疗的APP/PS1小鼠相比,用TCRAβ-Tregs治疗APP/PS1显示出记忆结果的显著改善,如晚期保留试验T5中的错误显著减少所示(第1组p<0.05,第3组p<0.01)。用多克隆Tregs或对照EV-Tregs处理的APP/PS1小鼠未显示RAWM测试中记忆结果的任何改善。总体结果表明,与多克隆Tregs治疗相比,TCRAβ-Tregs治疗改善了APP/PS1小鼠的记忆功能。
脑葡萄糖代谢低下是AD的一个突出特征。大脑葡萄糖摄取和代谢的改善是记忆改善的生物标志物。18F-FDG PET成像通常用于诊断AD患者和临床前动物模型中的痴呆状态。与非转基因小鼠相比,APP/PS1小鼠显示出脑葡萄糖摄取减少(图3D和E)。与未经治疗或用多克隆Tregs或EV-Tregs治疗的APP/PS1小鼠相比,用TCRAβ-Tregs治疗APP/PS1小鼠显示葡萄糖摄取显著增加(p<0.05)。与未经治疗的APP/PS1小鼠相比,用多克隆Tregs或EV-Tregs治疗未显示出脑葡萄糖摄取的显著改善。总之,TCRAβ-Tregs治疗后大脑葡萄糖摄取的增加与Y迷宫和RAWM测试中记忆结果的改善相似。
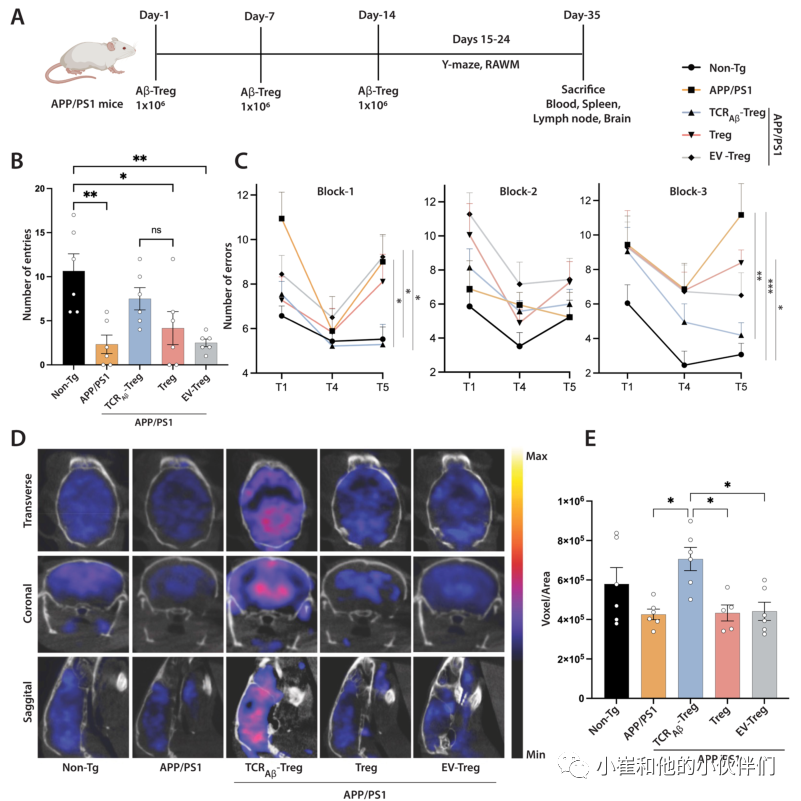
图3:TCRAβ-Tregs过继转移改善APP/PS1小鼠的记忆功能。
4、结果三:TCRAβ-Treg促进Treg靶向大脑
作者的中心假设是,考虑到工程化Tregs的Aβ反应性,这些Tregs将迁移到富含淀粉样蛋白的大脑区域并积累。然后,这些细胞将产生具有神经保护作用的抗炎作用。最初为了评估这一点,作者通过流式细胞术评估了在最后过继转移后2周处死的小鼠总Treg(CD4+CD25+FoxP3+)在WT小鼠、未经治疗的APP/PS1小鼠或用TCRAβ-Treg、多克隆-Treg或EV-Treg治疗的APP/PS1小鼠受体的脾脏、淋巴结、血液和大脑中的分布(图4A)。在每个治疗组的脾脏和淋巴结中,总Treg的频率没有显著差异(图4B)。在血液中,与非转基因小鼠相比,未经处理的APP/PS1小鼠显示出总Treg频率降低,但并不显著。值得注意的是,与未经处理的APP/PS1小鼠相比,用多克隆Tregs处理的APP/PS1小鼠显示出总Tregs的频率显著增加。然而,用TCRAβ-Treg或EV-Treg治疗的APP/PS1小鼠在总Treg频率上没有显示出显著差异。有趣的是,与所有治疗组相比,用TCR Aβ-Tregs治疗的APP/PS1小鼠大脑中的总Tregs显著增加。此外,与所有组相比,用对照EV-Tregs治疗的小鼠显示出总Tregs的显著减少。总之,用TCRAβ-Tregs、多克隆-Tregs或EV Tregs治疗对脾脏、淋巴结和血液中总Tregs的分布几乎没有影响,这表明大多数Tregs主要保留在循环系统中,而用TCRAβ-Tregs治疗由于其Aβ反应性,很容易渗入病理性淀粉样蛋白沉积和神经炎症的主要部位—大脑。
为了进一步证实工程化Tregs的脑靶向功效,作者将18F-FDG放射性标记的野生型多克隆Tregs或TCRAβ-Treg过继转移到APP/PS1小鼠,并在转移后0.5、2、4和6小时通过PET成像评估其生物分布。有趣的是,与野生型Tregs相比,TCRAβ-Treg在转移后0.5小时在大脑中产生显著的信号(图4C和D)。TCRAβ-Treg向大脑的渗透增加持续了4-6小时。总之,与多克隆Tregs相比,这些数据显示TCRAβ-Treg更有效的大脑靶向作用。
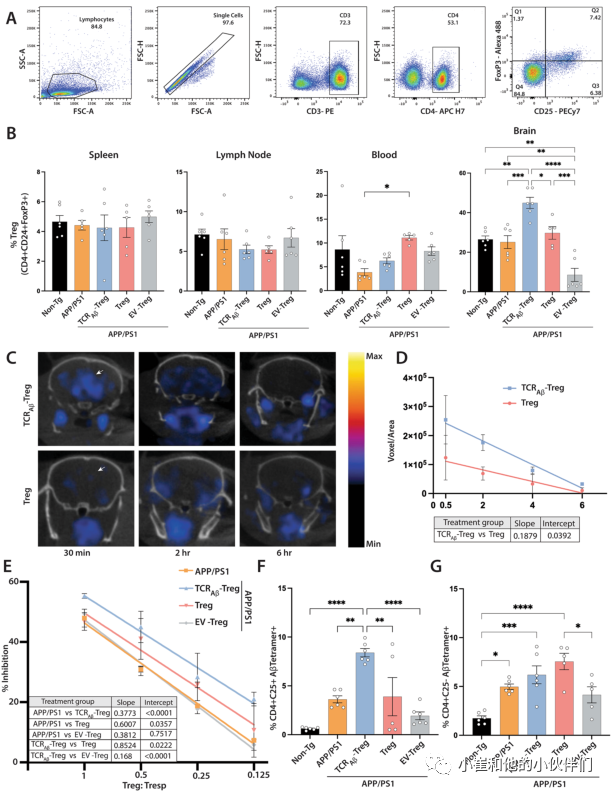
图4:TCRAβ-Treg的过继转移增强Treg靶向大脑和Treg功能。
5、结果四:TCRAβ-Tregs与系统性免疫功能
Tregs在维持免疫耐受中发挥重要作用,Tregs功能障碍与AD病理学的进展有关。研究表明,离体扩增Tregs在AD中具有保护作用。在此,作者评估了将TCRAβ-Tregs、多克隆-Tregs或EV-Tregs过继转移到APP/PS1受体后外周Tregs抑制功能的变化。与未经处理的APP/PS1小鼠的Tregs相比,用TCRAβ-Treg或多克隆Tregs处理的APP/PS1小鼠显示出升高的抑制功能,其中TCR Aβ-Tregs导致最高的抑制(图4E)。相反,来自接受EV-Tregs的小鼠的Tregs在功能上类似于未经治疗的APP/PS1小鼠。
此外,考虑到TCRAβ-Treg表达的瞬时性,作者检测了将TCRAβ-Tregs、多克隆-Tregs或EV-Tregs过继转移到APP/PS1受体动物后的TCRAβ表达。为了进行这些评估,用最后一次转移后2周处死时分离的脾细胞在饲养细胞(照射的脾细胞比例为1:5)和低剂量IL-2(20U/mL)的存在下用Aβ42肽刺激一周。刺激后,用荧光标记的Aβ-四聚体(MHCII-IAb–KLVFFAEDVGSNKGA)对细胞进行染色,以评估TCRAβ反应性CD4+CD25+Tregs的频率。正如预期的那样,由于AD小鼠模型中存在Aβ沉积,在未经处理的APP/PS1小鼠中观察到TCR Aβ反应性Tregs的水平高于非转基因小鼠(图4F)。然而,与未治疗的APP/PS1小鼠或用多克隆Tregs或EV Tregs治疗的小鼠相比,只有用TCR Aβ-Tregs治疗的APP/PS1小鼠显示出Aβ四聚体反应性Tregs(CD4+CD25+)的频率显著增加。用多克隆Tregs或EV Tregs治疗APP/PS1小鼠未诱导Aβ四聚体反应性Tregs的频率显著增加。此外,与APP/PS1小鼠相比,在所有治疗中,Aβ四聚体反应性CD4+CD25-细胞群没有显著变化。
6、结果五:TCRAβ-Tregs降低淀粉样蛋白负荷
接下来,作者评估了TCRAβ-Tregs对AD小鼠皮层和海马淀粉样蛋白负荷的影响。虽然APP/PS1小鼠显示出显著的淀粉样蛋白沉积和负载,但TCRAβ-Treg的过继转移减少了皮质中Aβ的可溶性和不溶性片段,而多克隆Treg治疗略微但不显著地减少了Aβ沉积(图5A)。与未经治疗的APP/PS1小鼠相比,EV-Tregs治疗对淀粉样蛋白负荷没有显著影响。然后,通过免疫组织化学评估Treg对小鼠大脑中淀粉样斑块沉积的影响。与未经治疗的APP/PS1小鼠相比,用TCRAβ-Tregs治疗减少了皮层中的淀粉样斑块,并且通过泛Aβ染色测定,TCRAβ-Tregs或多克隆Tregs的过继转移减少了海马组织中的总Aβ斑块(图5B和D)。EV-Tregs治疗对皮层或海马体均无显著影响。接下来,作者使用硫黄素-S免疫组织化学测定了Tregs对致密淀粉样斑块占据的大脑区域的影响。与未经处理的APP/PS1小鼠相比,将TCRAβ-Tregs或多克隆Tregs过继转移到APP/PS1鼠减少了皮质和海马中的致密淀粉样斑块沉积(图5C和D)。与APP/PS1小鼠的皮层或海马组织相比,EV-Tregs治疗在皮层或海马结构中没有显示出显著差异。
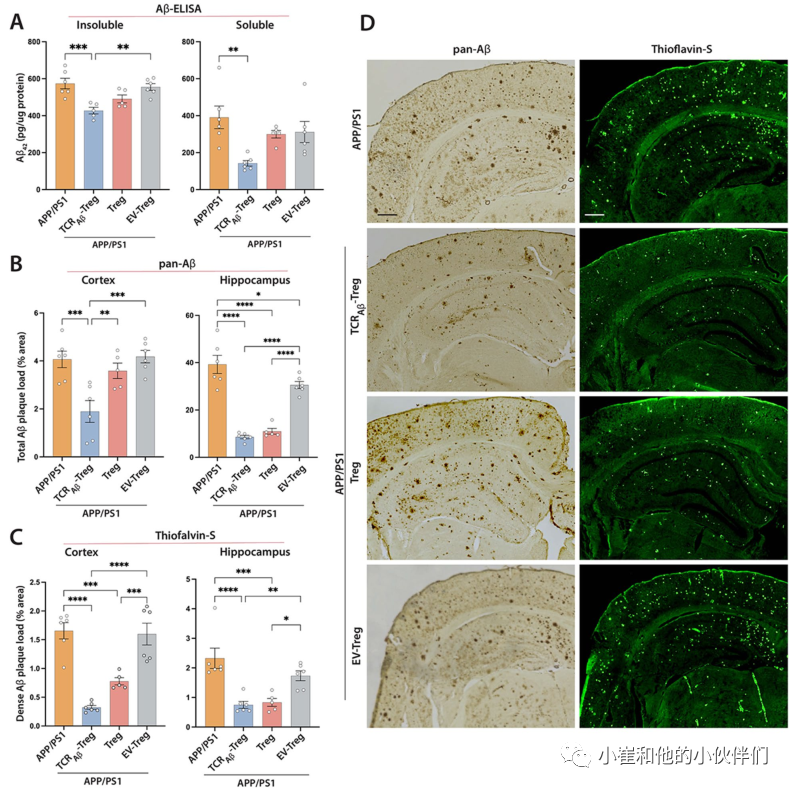
图5:TCRAβ-Treg过继转移可降低APP/PS1小鼠的淀粉样蛋白负荷。
7、结果六:TCRAβ-Tregs减少反应性小胶质细胞
小胶质细胞活化是AD患者和动物模型中观察到的神经炎症的常见标志。为了确定TCRAβ-Treg对反应性小胶质细胞反应的影响,我们在将TCRAβ-Tregs、多克隆-Tregs或EV-Tregs过继转移到APP/PS1受体后,对皮层和海马中具有变形虫形态的Iba-1反应性细胞进行计数。免疫组织化学显示,与非转基因小鼠相比,未经处理的APP/PS1小鼠的皮层和海马组织中Iba1+变形虫样细胞的数量显著增加,这表明AD小鼠中小胶质细胞的激活增加(图6A)。与未经治疗的AD小鼠相比,用TCRAβ-Tregs或多克隆Tregs治疗减少了APP/PS1 AD小鼠皮层和海马中Iba1+反应性小胶质细胞的数量,TCRAβ-Tregs产生的皮层组织的减少更大(图6A和B)。用EV-Tregs治疗APP/PS1小鼠的海马或皮层中的反应性小胶质细胞数量没有显著减少。为了进一步表征TCRAβ-Treg治疗后的小胶质细胞特征,作者评估了疾病相关小胶质细胞(DAM)标记物如Clec7A、Itgax和TREM2的转录变化。与反应性小胶质细胞表型降低一致,作者观察到多克隆Treg和TCRAβ-Treg处理的TREM2表达降低(图6C)。然而,与未治疗和EV-Treg治疗的APP/PS1小鼠相比,只有TCRAβ-Treg治疗具有显著性。此外,在TCRAβ-Treg处理后Clec7A和Itgax表达的趋势没有观察到显著变化(图6C)。除了小胶质细胞,星形胶质细胞也参与了阿尔茨海默病的神经炎症。通过评估GFAP表达来评估反应性星形胶质细胞。Treg和TCRAβ-Treg处理均显示GFAP表达显著降低。然而,与未治疗和EV Treg治疗的APP/PS1小鼠相比,只有TCRAβ-Treg治疗显示出最高的减少(图6C)。

图6:TCRAβ-Tregs过继转移减少APP/PS1小鼠的反应性小胶质细胞。
8、讨 论
作者团队认为Aβ特异性Tregs(TCRAβ-Tregs)可以作为AD的一种疾病改良疗法。在本研究中,作者在APP/PS1小鼠AD模型中比较了TCRAβ-Tregs和多克隆Tregs的神经保护作用。使用从Aβ反应性单克隆Teff细胞中鉴定的TCRAβ工程改造Aβ-Tregs细胞。抗原特异性被证明可以增强Tregs介导的神经保护反应。TCRAβ-Tregs和多克隆Tregs之间的比较显示神经保护反应得到改善,其表现为反应性小胶质细胞减少、淀粉样蛋白沉积减少和记忆形成改善。值得注意的是,与多克隆Tregs弥漫性全身性分布不同,TCRAβ-Tregs特异性积累到大脑中并引发抗炎反应。TCRAβ-Tregs通过旁侧效应和抗原介导的免疫抑制活性发挥抗炎活性。
值得注意的是,先前的研究已经确定了具有促炎或调节活性的CD4+和CD8+T细胞亚群对神经退行性疾病产生了混合的疾病结果。而CD4+T细胞亚群具有明确的细胞表面标记物、转录因子和细胞因子以将它们分类为亚型,如Th1、Th17和Treg;但CD8+T细胞对疾病的影响仍不明确。先前的报道表明,AD的免疫特征是CD8+T效应记忆CD45RA+(TEMRA)细胞数量的增加与认知负相关,单细胞RNA测序显示了它们对TCR信号的影响。相反,作者实验室的研究已经证明CD4+Treg在控制神经炎症和影响神经元修复中的功能作用。CD4+CD25+Foxp3+Treg已显示通过抑制T细胞活化来控制Teff免疫应答。这导致脑组织稳态的维持和修复,并被证明在广泛的神经退行性疾病中有效,包括肌萎缩侧索硬化症、中风、帕金森病和AD。健康大脑中存在脑驻留CD69+Treg,在神经炎症过程中观察到快速扩张,通过双调节蛋白控制星形胶质细胞增生,并通过IL-10将小胶质细胞转化为神经保护信号。另一方面,Tregs已被证明在AD的临床前小鼠模型中具有有益作用。Tregs的短暂耗竭加速了认知能力的下降,而Tregs的扩增,包括使用低剂量IL-2,改善了本报告中使用的APP/PS1小鼠的认知结果。进一步的研究表明,使用治疗剂诱导Tregs或过继转移多克隆Tregs对AD、PD和多发性硬化症(MS)具有神经保护作用。通过自身免疫性疾病和移植排斥反应领域的大量临床试验,已经确定了多克隆Treg疗法的安全性和可行性。然而,多克隆Treg治疗依赖于Treg以不依赖抗原的方式归巢到不同组织中的旁侧效应,从而导致全身免疫抑制。自身免疫性疾病的临床前研究表明,抗原特异性Tregs通过以疾病特异性的方式控制病理免疫反应可能更有效。抗原特异性Tregs向同源抗原表达位点迁移和积累,在那里它们发挥旁侧效应和抗原特异性免疫反应,并减少与广泛免疫抑制相关的并发症。Tregs进入患病的大脑区域以获得神经保护和抗炎反应在AD中是有利的。
由于Tregs前体频率低和缺乏有效的扩增,识别内源性疾病反应性Tregs或通过免疫开发它们变得更加复杂。最近,通过对Tregs耗竭小鼠的Aβ免疫产生了特定的Aβ反应性Treg。然而,由于免疫后抗原反应性Tregs的前体频率较低,因此产生的Tregs不是单克隆限制了这种方法。此外,研究中缺乏与多克隆Tregs治疗的比较,这使抗原特异性Tregs治疗潜在优势的解释变得复杂。目前开发抗原特异性Tregs的努力依赖于将从Teff细胞鉴定的抗原特异性TCR转导到Treg细胞中。尽管这种方法被有效地用于操纵人类Treg细胞,但小鼠Treg细胞极难转导。值得注意的是,作者的TCR Aβ慢病毒构建体虽然成功地用TCRAβ转导CEMSS、3T3和人PBMC,但在转导小鼠Tregs方面效果较差。为了克服这一限制,作者通过电穿孔编码TCRAβ的质粒,产生了瞬时表达Aβ特异性TCR的TCRAβ-Treg。这种方法背后的理由,在治疗环境中,过继转移的Treg不需要无限期地持续,而是足够长的时间,通过一种称为“感染耐受”的现象,赋予位于受影响组织的其他免疫细胞抑制能力。因此,瞬时表达TCRAβ的Treg细胞将产生必要的开发用于治疗评估的人类TCRAβ-Tregs的概念验证反应。
在目前的研究中,单克隆TCRAβ-Treg是通过结合从作者实验室先前开发的高反应性单克隆Aβ-Teff细胞中鉴定的Aβ特异性TCR而产生的。从具有纯合MHC背景(B6;129)的小鼠中分离脾Tregs,并使用CRISPR-Cas9技术消除内源性TCRs以避免非特异性免疫反应。电穿孔编码TCR Aβ的质粒产生瞬时表达Aβ特异性TCR的抗原特异性Treg。通过MHC-Aβ肽四聚体的识别,证明了工程TCRAβ-Tregs的Aβ-特异性。由于高反应性TCR Aβ的转移,TCRAβ-Treg表现出显著更高的免疫抑制作用。然而,Tregs可以显示出占主导地位的旁侧效应,它们以抗原非特异性的方式抑制Teffs。当MHC-Aβ-四聚体用作Treg兴奋剂时,工程TCRAβTreg显示出Aβ-特异性免疫抑制功能。对细胞因子谱的进一步评估表明,与多克隆Tregs相比,TCR Aβ-Tregs表达的促炎细胞因子如IFN-γ减少,粒细胞-巨噬细胞集落刺激因子(GM-CSF)增加。这有助于支持它们通过耐受性树突状细胞从幼稚的T细胞诱导Treg分化的能力,耐受性树突细胞用于使T细胞向Th2表型极化。此外,IL-4产量的增加支持分泌IFN-γ的CD4+T细胞的TCR Aβ-Treg免疫抑制功能,而CCL2和CCL5是体内Treg募集中的潜在趋化因子。作者的数据表明,结合由疾病反应性Teffs鉴定的TCR是以抗原驱动的方式构建免疫抑制的抗原特异性Treg的可行策略。
在健康的大脑中,外周淋巴细胞的浸润得到了很好的控制。然而,随着AD的进展,Aβ淋巴引流受到损害,并导致外周免疫细胞浸润增加,从而加剧AD病理。开发AD抗原特异性Treg疗法的核心假设是将Aβ特异性细胞靶向富含淀粉样蛋白的大脑部位。在目前的研究中,发现在APP/PS1小鼠中,过继转移的TCRAβ-Tregs显著浸润大脑,而转移的多克隆Tregs主要保留在外周循环中。18F-FDG放射性标记的细胞追踪突出了TCRAβ-Treg以抗原依赖方式的脑靶向功效。尽管TCRAβ-Treg靶向APP/PS1小鼠的大脑,但由于TCR Aβ结合到细胞中的高亲和力,它们能够显著增加全身Treg功能。值得注意的是,尽管工程化的TCRAβ-Treg仅短暂表达Aβ特异性TCR,但用人Aβ肽刺激Tregs在用TCRAβ-treg治疗的小鼠中显示出更高的MHC-Aβ四聚体反应性Tregs。这些数据表明幼稚Tregs的疾病特异性启动。18F-FDG PET评估的认知功能被认为是AD的成像生物标志物。18F-FDG摄取的减少代表神经元能量需求的减少,主要由患者淀粉样蛋白病理引起的突触损失引起。与多克隆Tregs治疗相比,TCRAβ-Tregs的过继转移也增加了脑葡萄糖摄取。值得注意的是,在RAWM和Y迷宫行为测试中,TCRAβ-Treg治疗后大脑葡萄糖摄取增加与记忆结果改善相关。总之,这些结果表明,即使TCRAβ-Tregs瞬时表达TCRAβ,也能够靶向大脑,改善大脑功能和记忆。
此外,小胶质细胞在处理和呈递自身抗原(包括Aβ)以维持免疫耐受方面发挥着关键作用。未活化的小胶质细胞表现出分支形态,可通过吞噬作用清除Aβ沉积。然而,随着疾病的进展,小胶质细胞变得更加活跃,并获得变形虫样形态,吞噬能力受损,神经毒性升高。研究表明,脑Tregs可以抑制小胶质细胞的炎症反应,体外扩增的多克隆Tregs治疗可以抑制小神经细胞的炎症。作者的结果表明,在减少皮层和海马中的反应性小胶质细胞方面,TCRAβ-Tregs比多克隆Tregs更有效。与多克隆Treg治疗相比,TCRAβ-Tregs的脑靶向能力和随后脑Tregs百分比的增加导致小胶质细胞炎症表型的更大降低。除了将小胶质细胞转化为非反应性表型外,作者的研究结果表明,TCRAβ-Tregs在减少大脑海马和皮层区域的淀粉样蛋白沉积方面更有效,通过ELISA和Aβ斑块定量IHC测定的可溶性和不溶性Aβ1-42载量的减少证明了这一点。值得注意的是,与多克隆Tregs相比,TCRAβ-Tregs在减少致密的病理性硫黄素-S阳性Aβ沉积方面更有效。总体而言,作者的研究结果表明,TCRAβ-Tregs的脑靶向作用和疾病特异性免疫抑制功能可改善神经炎症反应性小胶质细胞的减少,从而进一步增强淀粉样斑块的清除率。
目前的研究结果证明了临床前数据,其中疾病特异性TCRAβ-Tregs比多克隆Tregs在病理上减少淀粉样蛋白和改善认知结果方面更有效。工程化TCRAβ-Tregs瞬时表达TCRAβ是本研究的一个显著限制。然而,尽管TCRAβ短暂表达,但在APP/PS1小鼠中显示出强大的神经保护作用,这是“长寿命”TCRAβ-Tregs可实现的显著治疗潜力的基础。值得注意的是,该结果证实了开发稳定表达的人类TCRAβ-Tregs的临床转化策略。第二个限制是TCRAβ-Tregs和Treg治疗对海马淀粉样蛋白负荷没有显著差异,而皮质中记录到显著减少。作者推测海马的定量受到可供测试的组织区域数量的限制。总之,这些数据支持这样一种假设,即作为嵌合抗原受体(CARs)设计的TCRs将有助于进一步开发Treg疗法治疗AD。
原文链接:
Yeapuri P, Machhi J, Lu Y, Abdelmoaty MM, Kadry R, Patel M, Bhattarai S, Lu E, Namminga KL, Olson KE, Foster EG, Mosley RL, Gendelman HE. Amyloid-β specific regulatory T cells attenuate Alzheimer's disease pathobiology in APP/PS1 mice. Mol Neurodegener. 2023 Dec 18;18(1):97. doi: 10.1186/s13024-023-00692-7.


