山东大学姜新义/陈晨/赵坤/张彩团队《AM》:腔内喷涂纳米调节剂包裹的水凝胶可用于术后胶质母细胞瘤免疫治疗
时间:2024-01-12 21:04:20 热度:37.1℃ 作者:网络
众所周知,多形性胶质母细胞瘤(GBM)由于其复杂的肿瘤微环境(TME)而对免疫治疗具有抵抗力。胆固醇代谢失调与免疫抑制性肿瘤微环境有关,并促进肿瘤进展。在这里,山东大学姜新义/陈晨/赵坤/张彩发现GBM组织中的胆固醇水平异常高,而胶质瘤支持性巨噬细胞(GSMs)作为重要的“胆固醇工厂”,表现出异常活跃的胆固醇代谢和外流,提供胆固醇来促进GBM生长并诱导CD8+T细胞耗竭。因此,该研究报道了一种腔内可喷雾纳米调节剂包裹的水凝胶系统来调节GSMs的胆固醇代谢。可降解纳米调节剂介导的GSMs中DHCR7的消融有效抑制了胆固醇供应并激活了T细胞免疫。此外,Toll样受体7/8(TLR7/8)激动剂的组合显著促进GSMs极化为抗肿瘤表型,并改善免疫抑制性TME。混合系统治疗在原位GBM肿瘤模型和术后复发模型中表现出优异的抗肿瘤效果。总而言之,该研究结果揭示了GSMsDHCR7/胆固醇信号在免疫抑制性TME调节中的作用,提出了一种潜在的GBM治疗策略,值得进一步的临床试验。该研究题为“Intracavitary Spraying of Nanoregulator-Encased Hydrogel Modulates Cholesterol Metabolism of Glioma-Supportive Macrophage for Postoperative Glioblastoma Immunotherapy”发表在《Advanced Materials》。

【GBM生态位中GSMs衍生胆固醇的积累促进肿瘤浸润CD8+T细胞耗竭】
CD8+T细胞在TME中总是会失去其细胞毒性效率。正如预期的那样,随着肿瘤发生,正交异性颅内GBM模型中的肿瘤浸润CD8+T细胞显示出程序性细胞死亡蛋白1(PD-1)和淋巴细胞激活基因3(LAG3)的表达明显上调。此外,干扰素-γ(IFN-γ)和肿瘤坏死因子-α(TNF-α)在肿瘤进展第15天下调,并在肿瘤进展第20天大幅下调,表明出现了独特的耗尽CD8+T(Tex)肿瘤发展后期的细胞表型。为了进一步研究GBM环境中胆固醇代谢对CD8+T细胞的作用,首先检查了肿瘤组织中的胆固醇水平。结果表明GBM微环境中胆固醇水平升高,导致CD8+T细胞耗竭并抑制其增殖。GSMs是大脑TME中最丰富的免疫细胞,出现在肿瘤边缘和内部。胆固醇水平与TME中GSMs的比例呈正相关。此外,CD8+T细胞中PD-1和LAG3的表达与GSM比例呈正相关。结果证实GSMs比例与胆固醇水平密切相关。此外,GSMs的消耗降低了肿瘤组织中的胆固醇水平并逆转了CD8+T细胞的耗竭。
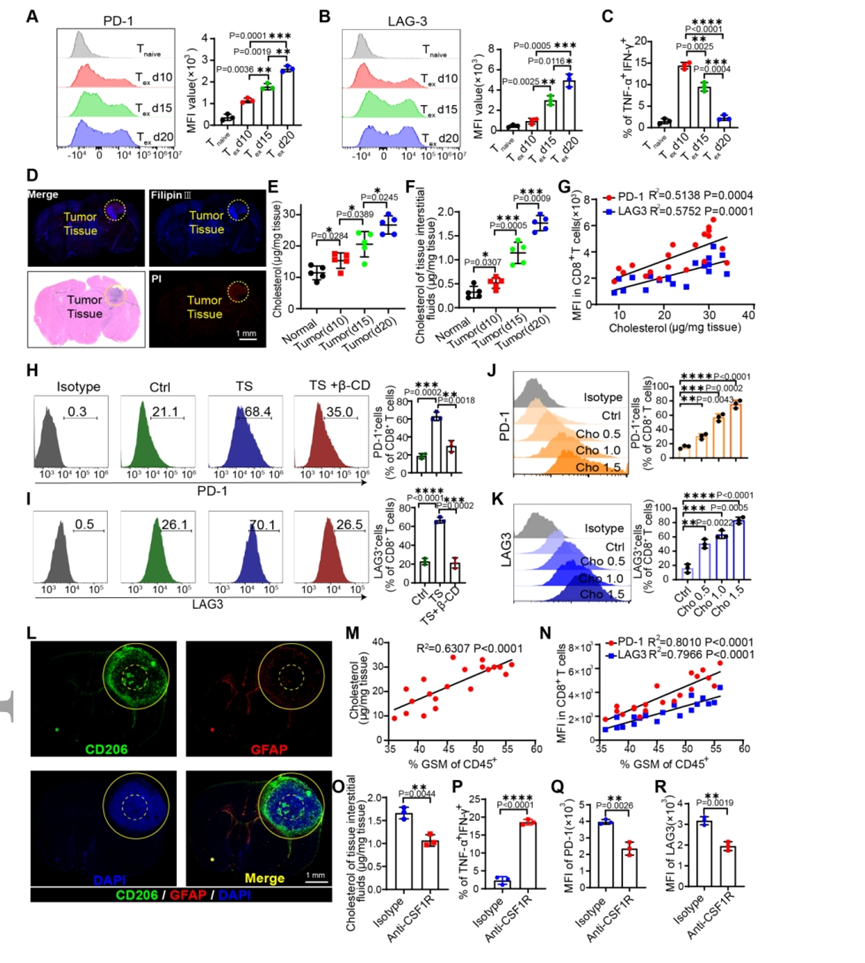
图1.CD8+T细胞耗竭是由TME内GSMs衍生胆固醇的积累引起的
【DHCR7高表达的GSMs充当胆固醇工厂,显示胆固醇代谢活性和外流显著增加】
肿瘤相关巨噬细胞中胆固醇代谢的重编程参与其自身极化的调节。首先,该研究发现M2样骨髓源性巨噬细胞(BMDMs)中的膜胆固醇和细胞裂解物中的胆固醇水平降低。引人注目的是,M2样BMDMs中的外流胆固醇水平显著较高。这些数据表明,GSMs表现出显著升高的胆固醇流出,并充当TME中重要的胆固醇供应商。DHCR7是胆固醇合成的关键限速酶,但其在GBM中的表达模式和治疗价值仍不清楚。实验结果提供了直接证据,表明异常升高的DHCR7表达对GBM患者产生负面影响,并且与GBM的免疫抑制微环境明显相关,因为它提高了胆固醇生物合成并抑制了免疫相关途径。总的来说,这些结果表明DHCR7水平在GBM患者中异常升高,并且与较差的生存率相关。此外,还表明DHCR7表达在GSM中上调。
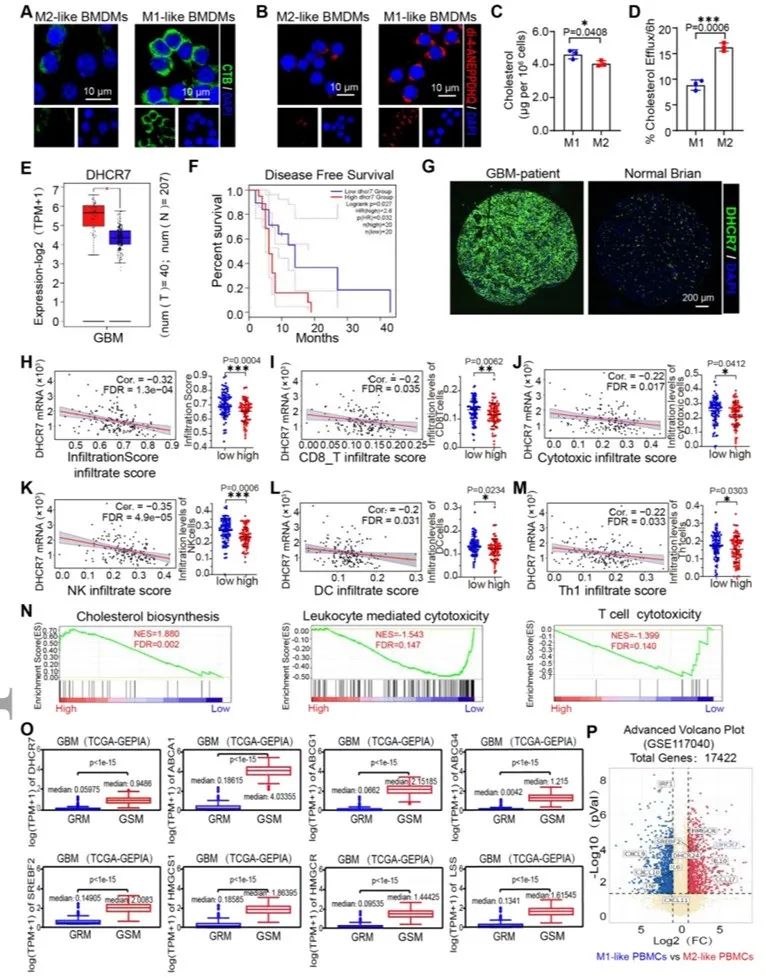
图2.TME中的GSMs表现出高水平的DHCR7和增强的胆固醇流出活性
【通过“芯片上肿瘤有机体”微流控平台优化的GSMs靶向NRs对DHCR7的沉默作用对胆固醇代谢的影响】
为了实现核靶向,PBAE447通过核定位信号(NLS)进行功能化,定义为PN。然后,使用微流体将有机脂质成分(CSP、PN、DOPE和DSPE-PEG-MAN)与shDHCR7水溶液混合,构建shDHCR7纳米调节剂(NRs)。为了更好地模拟人类GBM微环境,筛选优化的NRs配方,并以组织样方式探索GSMs和CD8+T细胞之间的串扰机制,建立了“肿瘤类器官芯片”微流控平台来模拟GBM生理条件,以提供体内治疗的可靠预测结果。数据表明,含有46.2mol% PN、30.8mol% CSP和3.0mol% DSPE-PEG-MAN的制剂表现出优异的递送性能,具有最高的转染效率和最低的GBOs胆固醇荧光强度。然后,全面表征了优化后的shDHCR7-NRs。用shDHCR7-NRs处理后,M2样BMDMs中DHCR7蛋白和基因表达水平显著降低,胆固醇外流得到有效抑制。此外,瘤内注射shDHCR7-NRs显著降低了肿瘤组织中的胆固醇水平。
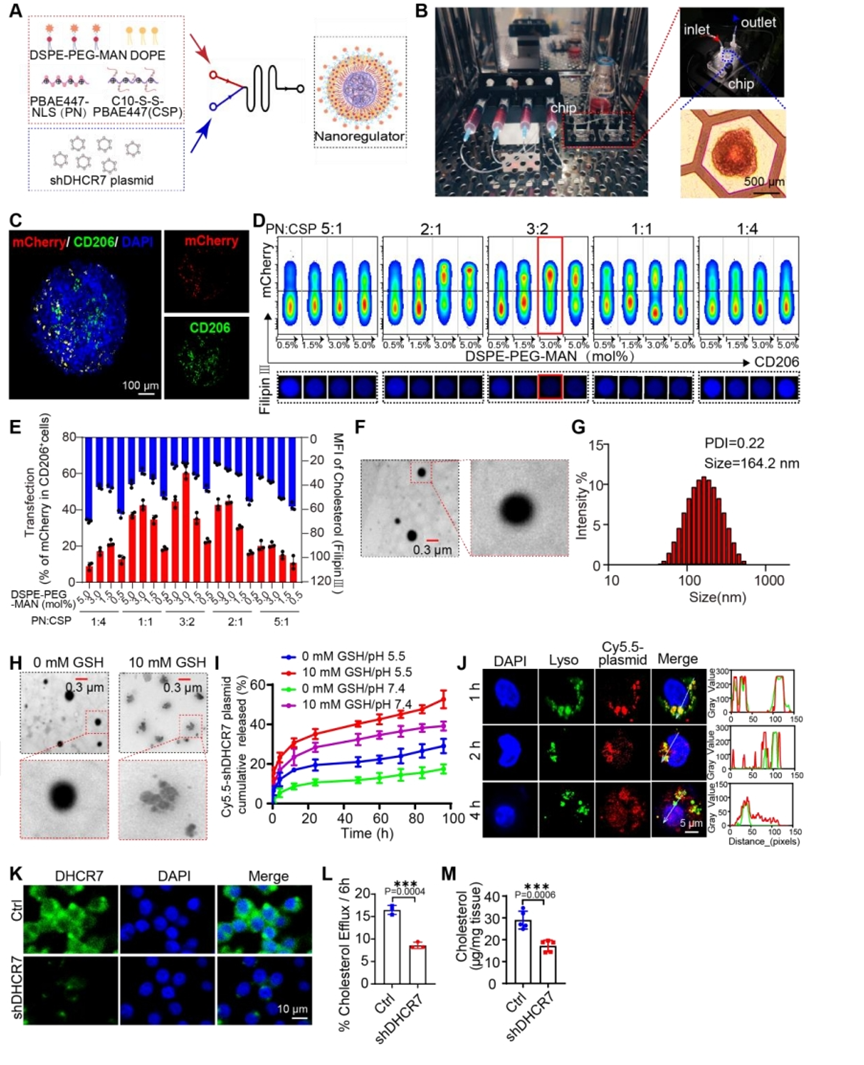
图3.构建“肿瘤类器官芯片”微流控平台,筛选最佳NRs配方
【最佳GSM靶向NRs有效沉默GSMs中的DHCR7表达,促进肿瘤细胞凋亡并逆转CD8+T细胞耗竭】
接下来,研究了使用shDHCR7调节GSMs中胆固醇代谢时对肿瘤进展的影响。结果证明,通过shDHCR7-NRs敲低DHCR7可以通过在细胞水平上有效调节M2样巨噬细胞中的胆固醇流出水平来改善CD8+T细胞的免疫抑制状态。
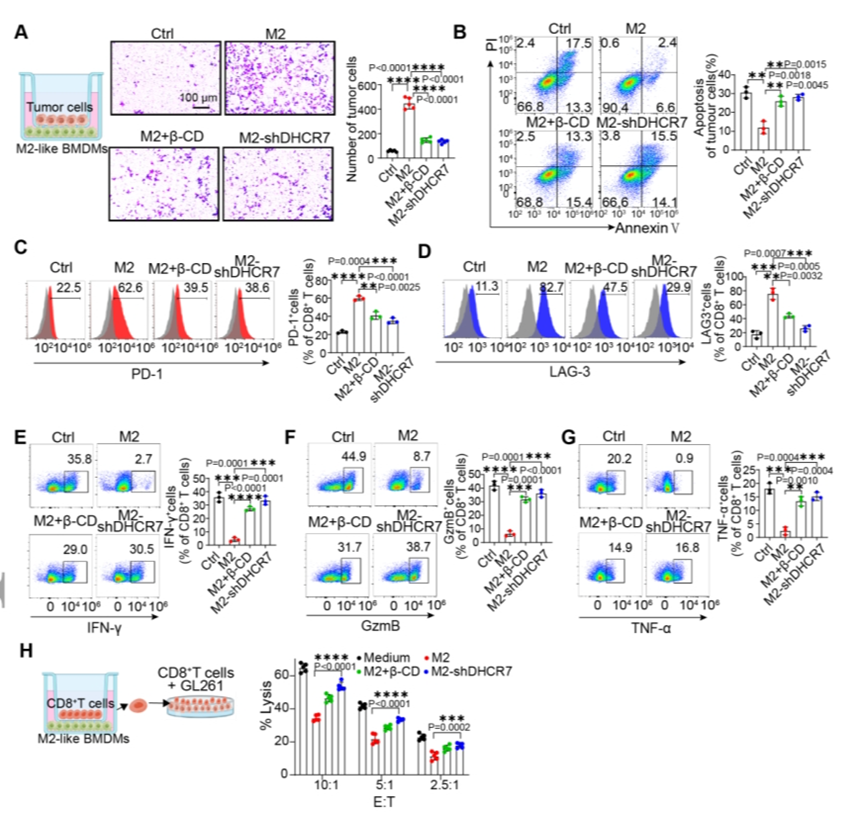
图4.最佳的GSM靶向NRs有效逆转CD8+T细胞耗竭,抑制肿瘤细胞迁移并促进肿瘤细胞凋亡
【shDHCR7和免疫刺激性ssRNA的组合显著逆转了M2样巨噬细胞的极化,使其具有抗肿瘤表型】
此外,该研究发现DHCR7敲低有效阻碍了肿瘤细胞或IL-4/IL-13诱导的M2表型极化,表明DHCR7的存在促进巨噬细胞极化为M2样巨噬细胞表型。DHCR7的敲低确实“重塑”了M2样巨噬细胞,上调IFN-β分泌和CD86表达,下调IL-10分泌和CD206表达。总的来说,证明了在GSMs中高表达的DHCR7不仅是胆固醇生物合成的关键酶,而且还是促进M2样巨噬细胞极化的重要调节因子。这些证据支持了胆固醇代谢的调节将直接影响巨噬细胞表型分化的观点。TLR7/8识别特定的病毒ssRNA序列并激活IRF7和核因子-κB,从而诱导I型IFN和炎性细胞因子的产生并引发强烈的抗肿瘤免疫反应。
为了有效逆转M2样巨噬细胞表型,该研究构建了编码shDHCR7和ssRNA序列的双功能载体并成功制备了shDHCR7+ssRNA-NRs。因此,shDHCR7介导的胆固醇代谢调节增强了ssRNA疗法将M2样巨噬细胞极化为M1样巨噬细胞的有效性,有助于协同改善免疫抑制性TME。总之,联合治疗通过将GSMs极性逆转为抗肿瘤表型来改善免疫抑制性TME,从而显著抑制GBOs生长。

图5.shDHCR7+ssRNA@NRs逆转GSMs极化以获得抗肿瘤表型并抑制GBO生长
【shDHCR7+ssRNA@NRs改善免疫抑制TME并抑制肿瘤进展】
将小鼠随机分组,并在接种Luci+GL261细胞后12天用每种制剂进行治疗。据预示着联合治疗有利于招募CD8+T细胞并减少肿瘤内Foxp3+Treg的比例。重要的是,观察到联合治疗后GRMs与GSMs的比率(GRMs/GSMs>1)显著增加。此外,联合治疗组中CD8+T细胞和CD4+T细胞中CD69的表达水平显著增加。联合治疗组的细胞凋亡率最高,增殖率最低。
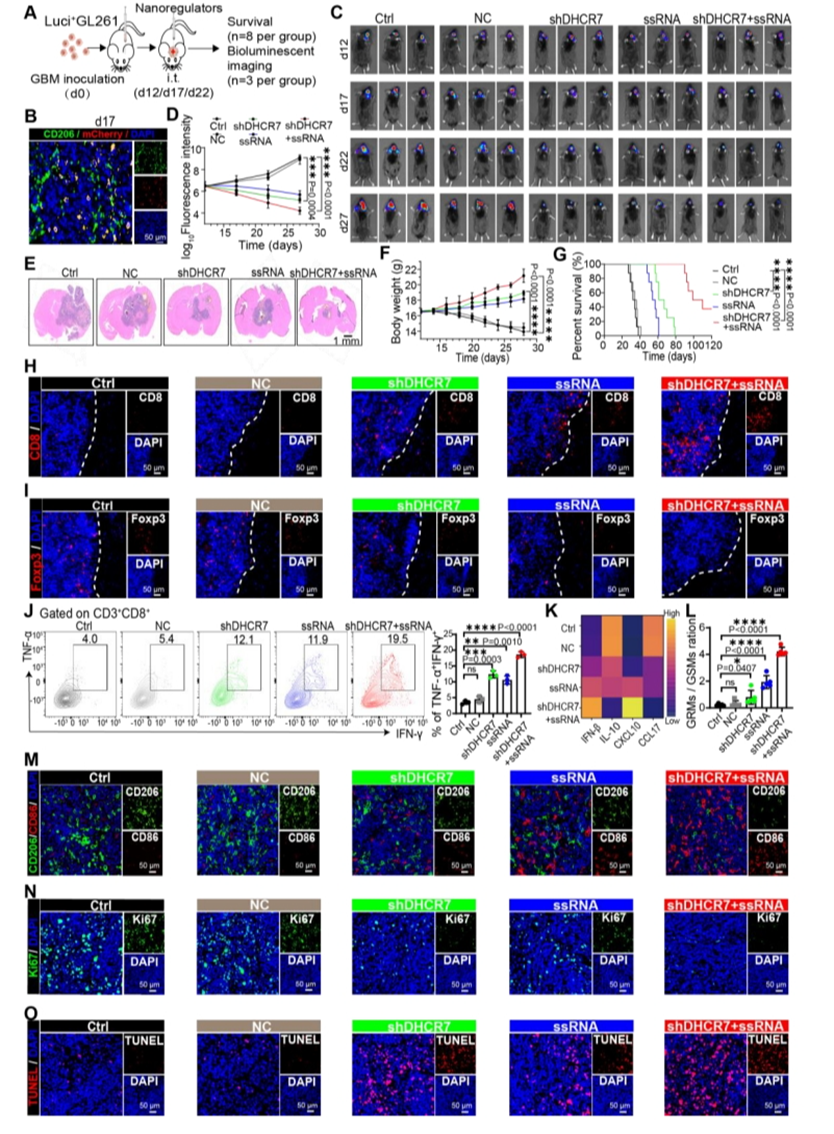
图6.shDHCR7+ssRNA@NRs治疗改善免疫抑制性TME并抑制瘤内注射后的肿瘤进展
【shDHCR7+ssRNA-NRs@Gel超系统腔内喷雾可有效抑制术后脑肿瘤复发并延长生存期】
[21] 为了建立术后GBM模型,该研究在给小鼠接种Luci+GL261细胞后第12天在立体镜下进行了手术切除。该研究合成了一种基于COL1A1结合肽(C1BP)的喷雾水凝胶,以将NRs浓缩在切除腔内。C1BP与残留肿瘤灶表面的胶原蛋白紧密结合。水凝胶在体内表现出卓越的耐久性并且几乎没有细胞毒性。IVIS监测表明shDHCR7+ssRNA-NRs@Gel治疗对肿瘤复发显示出最强的抑制作用。shDHCR7+ssRNA-NRs@Gel治疗是延长生存期且体重稳定增加的最有效疗法。
接下来,研究了空腔喷涂-NRs-水凝胶超结构的体内抗肿瘤机制。结果表明shDHCR7+ssRNA-NRs@Gel治疗增加了抗肿瘤免疫应答者的比例并抑制了肿瘤促进者的比例,从而协同加强术后腔周围的杀瘤免疫反应,杀死残留的肿瘤细胞并抑制术后复发。
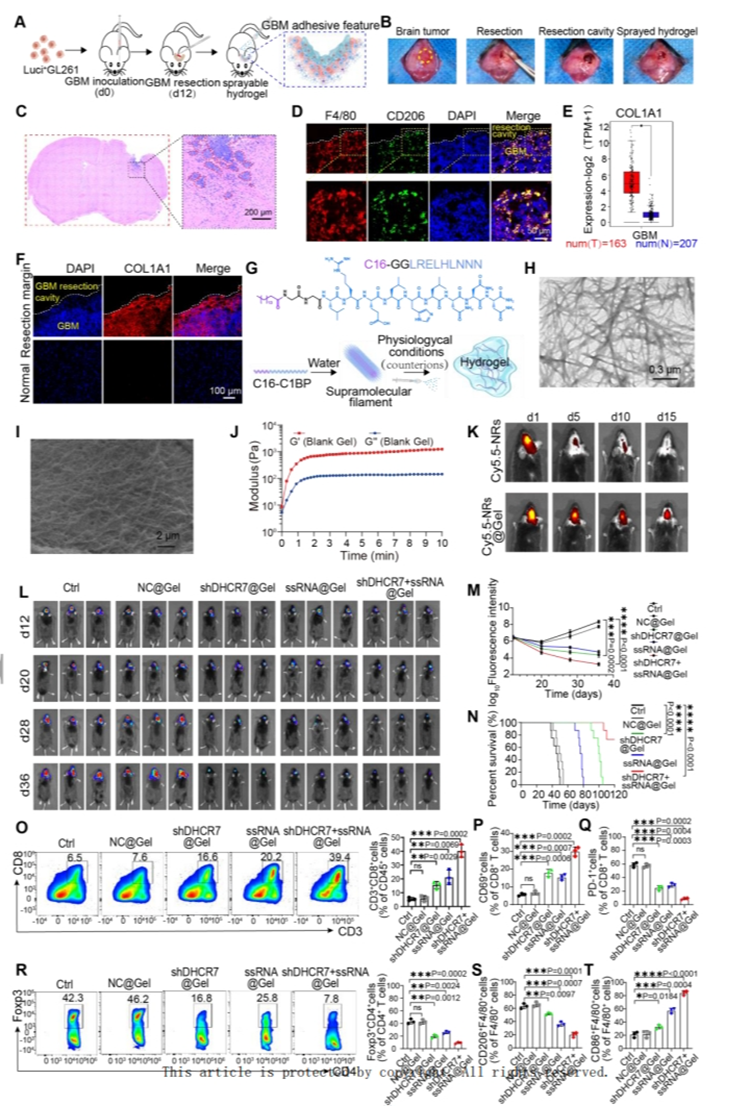
图7.腔内喷雾shDHCR7+ssRNA-NRs@Gel可有效抑制术后脑肿瘤复发
【shDHCR7和ssRNA的组合在异种移植模型中取得了有希望的抗肿瘤功效】
由于小鼠颅内胶质瘤模型不能准确模拟临床患者的特征,为了深入了解该治疗的未来临床转化,该研究将GBOs移植到成年huHSC-NOG-EXL小鼠的大脑中,以更好地模拟人类GBM的异质性验证该联合疗法的抗肿瘤功效。联合治疗延长了GBOs异种移植小鼠的存活时间并增加了体重。此外,联合治疗抑制GBM细胞的增殖并促进其凋亡。FCM结果显示,联合治疗不仅增加IFN-β分泌,而且抑制巨噬细胞分泌IL-10。正如预期的那样,shDHCR7+ssRNA-NRs@Gel在治疗8天后显著降低了GBM组织和组织间质液中的胆固醇水平。此外,与对照小鼠相比,shDHCR7+ssRNA-NRs@Gel治疗的小鼠表现出术后复发减慢、生存期延长和体重稳定增加。总体而言,多个动物模型有力地证明,将shDHCR7和调节GSMs胆固醇代谢的ssRNA结合起来,并激活TLR7信号通路可以显著诱导GSMs极性反转,促进GBM细胞凋亡并改善免疫抑制性TME,且不会引起任何可检测到的不良反应。
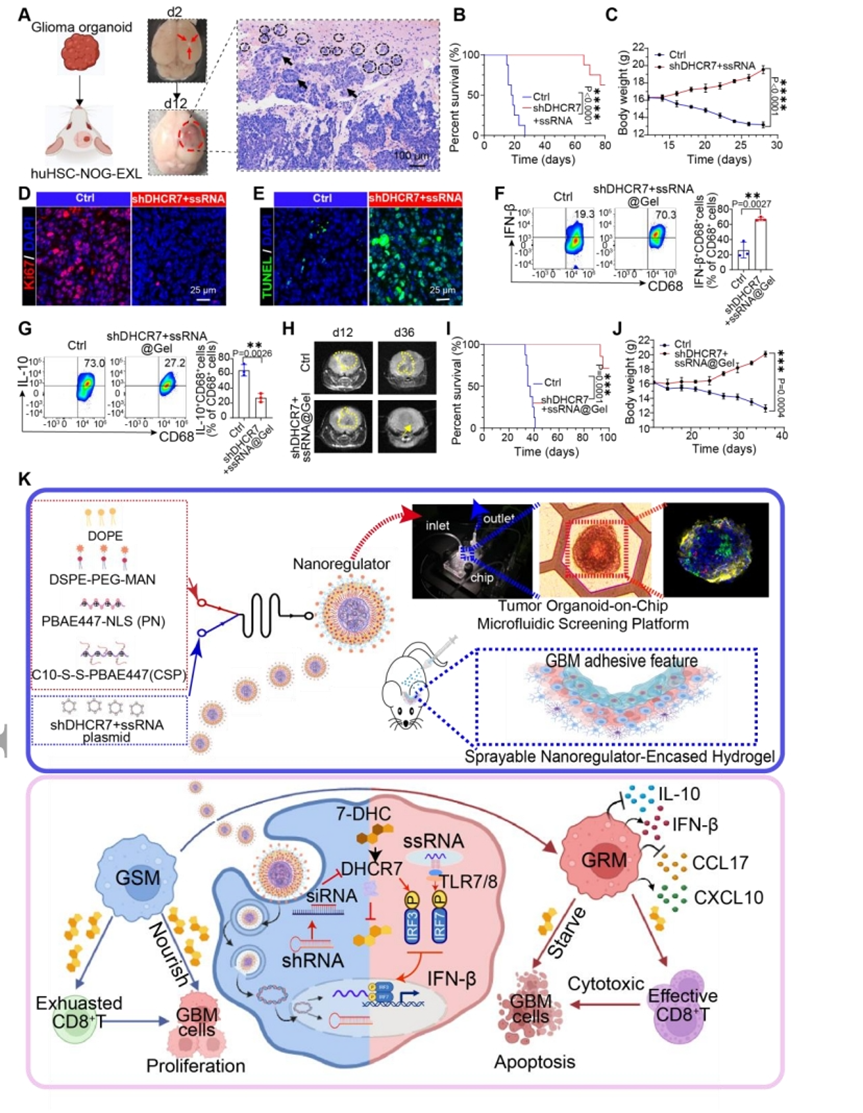
图8.shDHCR7+ssRNA-NRs和shDHCR7+ssRNA-NRs@Gel在异种移植模型中的抗肿瘤功效
【小结】
该研究揭示了胆固醇在支持GBM进展中发挥的两个关键作用。其中一个作用提供了肿瘤快速生长所需的能量,而另一个作用则通过诱导免疫抑制性TME促进GBM细胞的免疫逃避。这项工作表明,GSMs是中枢神经系统中胆固醇供应的关键细胞,也是免疫抑制TME的关键控制器,负责这两种机制。通过靶向沉默DHCR7来调节GSMs胆固醇代谢,不仅可以减少GBM细胞的胆固醇供应,还可以逆转CD8+T细胞的耗竭。此外,shDHCR7和ssRNA的结合可显著诱导GSMs极性反转,并激活CD8+T细胞的杀肿瘤活性,从而启动杀肿瘤免疫,这在临床前研究中已被证明对于GBM治疗有效且安全。因此,shDHCR7与ssRNA的协同作用表明免疫代谢调节对于改善基于CD8+T细胞的免疫疗法在临床应用中的潜在价值。此外,这种抗肿瘤免疫代谢调节策略可能适用于具有相似临床免疫抑制特征的多种免疫冷肿瘤,值得进一步的临床验证。
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202311109


