【指南与共识】| 侵犯邻近脏器的进展期胃癌的临床诊疗中国专家共识(2024年版)
时间:2024-06-16 06:00:41 热度:37.1℃ 作者:网络
[摘要] 胃癌是常见的消化系统恶性肿瘤之一,中国有超过7成的胃癌患者确诊时已进入进展期。对于侵犯邻近脏器的局部进展期胃癌而言,不仅诊断、手术困难,而且预后差,严重威胁着中国民众的健康。为进一步规范侵犯邻近脏器的局部进展期胃癌的临床诊疗,采用循证医学方法,聚焦国内外目前对于进展期胃癌侵犯邻近脏器的诊疗进展,以目前已有较高循证医学证据的临床研究结果为线索,探讨诊断、治疗及疗效评估模式等多个方面,在文献检索的基础上,进行质量等级评价、证据综合,并采用德尔菲问卷调查法,对进展期胃癌侵犯邻近脏器的临床诊疗过程中所共同关注的诊断方法、围手术期治疗、手术治疗及疗效评估等具体问题和热点,通过多学科专家会议讨论、问卷调查等形式,经过4次对10多个不同地区、24家医院共计37名专家意见的调查汇总、归纳、梳理和总结,依托上海市抗癌协会胃癌专业委员会和中国人体健康科技促进会胃肠肿瘤专业委员会,形成了《侵犯邻近脏器的进展期胃癌的临床诊疗中国专家共识(2024年版)》,以期为侵犯邻近脏器的进展期胃癌的基础和临床研究探索提供帮助,并为一线医务人员临床实践等提供证据借鉴和规范依据,进而为后续的相关行业指南制定奠定基础。
[关键词] 局部进展期胃癌;侵犯邻近脏器;专家共识;诊断;治疗
[Abstract] Gastric cancer is one of the most common malignant tumors, and over 70% of patients were diagnosed as advanced stage at the first visit in our country. For patients with locally advanced gastric cancer invading adjacent organs, the diagnosis and surgical treatment are quite difficult, and prognosis is poor. To further standardize the clinical research practice of locally advanced gastric cancer invading adjacent organs, this consensus was guided by evidence-based methodology, focusing on the progress of diagnosis and treatment in locally advanced gastric cancer invading adjacent organs, and the clinical studies with high level of evidence but not approved at present, and exploring the new modes of diagnosis, efficacy evaluation and other aspects. On the basis of literature retrieval, quality evaluation and evidence summary were carried out, and specific issues and hot topics such as the methods of diagnosis, peri-operative treatment, surgical treatment and other common concerns in the clinical application were discussed and investigated through multidisciplinary expert meetings, Delphi methods and other forms. The “Chinese expert consensus on clinical practice of locally advanced gastric cancer invading adjacent organs (2024 edition)” was completed by the investigation and summarization of the opinions of 35 experts from more than 10 different regions and 30 hospitals for 4 times, relying on Professional Committee on Gastric Cancer of Shanghai Anticancer Association, Professional Committee on Gastrointestinal Cancer of China Association for Promotion of Health Science and Technology, with a view to providing evidence reference and normative basis for frontline medical personnel in future clinical practice of locally advanced gastric cancer treatment, and laying a foundation for subsequent development of relevant industry guidelines.
[Key words] Locally advanced gastric cancer; Invading adjacent organs; Expert consensus; Diagnosis; Treatment
《侵犯邻近脏器的进展期胃癌的临床诊疗中国专家共识(2024年版)》
专家组
编写指导专家
-
朱正纲 | 上海交通大学医学院附属瑞金医院普外科
-
徐惠绵 | 中国医科大学附属第一医院肿瘤外科
-
王亚农 | 复旦大学附属肿瘤医院胃外1科
执笔专家
-
罗天航 | 海军军医大学第一附属医院胃肠外科
-
刘晓文 | 复旦大学附属肿瘤医院胃外2科
-
徐大志 | 复旦大学附属肿瘤医院胃外1科
专家组成员
(以姓名汉语拼音字母排序)
-
崔越宏 | 复旦大学附属中山医院肿瘤内科
-
董 平 | 上海交通大学医学院附属新华医院 普外科
-
樊 林 | 西安交通大学第一附属医院普通外科
-
高晓东 | 复旦大学附属中山医院胃肠外科
-
何显力 | 空军军医大学唐都医院普通外科
-
何新阳 | 安徽省肿瘤医院胃肠外科
-
黄 陈 | 上海交通大学医学院附属第一人民医院胃肠外科
-
黄 华 | 复旦大学附属肿瘤医院胃外1科
-
蒋小华 | 同济大学附属东方医院胃肠外科
-
李 琛 | 上海交通大学医学院附属瑞金医院普外科
-
李桂超 | 复旦大学附属肿瘤医院放疗科
-
刘福囝 | 中国医科大学附属第一医院胃肠肿瘤外科
-
刘建强 | 复旦大学附属肿瘤医院内镜科
-
宋 武 | 中山大学附属第一医院胃肠外科
-
覃吉超 | 华中科技大学同济医学院附属同济医院胃肠外科
-
汪学非 | 复旦大学附属中山医院胃肠外科
-
王龙跃 | 山西省肿瘤医院普外科
-
王伟军 | 海军军医大学第二附属医院胃肠外科
-
王振宁 | 中国医科大学附属第一医院胃肠肿瘤外科
-
卫 勃 | 解放军总医院 第一医学中心普通外科医学部
-
徐阿曼 | 安徽医科大学第一附属医院普外科
-
严 超 | 上海交通大学医学院附属瑞金医院普外科
-
杨 力 | 江苏省人民医院普通外科
-
叶 凯 | 福建医科大学附属第二医院胃肠外科
-
于文滨 | 山东大学齐鲁医院胃肠外科
-
张 健 | 浙江大学医学院附属第一医院胃肠外科
-
张 涛 | 辽宁省肿瘤医院胃外科
-
张 嵬 | 复旦大学公共卫生学院生物统计学教研室
-
张子臻 | 上海交通大学医学院附属仁济医院胃肠外科
-
赵 平 | 四川省肿瘤医院胃外科
-
赵恩昊 | 上海交通大学医学院附属仁济医院胃肠外科
-
周东雷 | 复旦大学附属肿瘤医院胃外1科
-
朱 晖 | 复旦大学附属肿瘤医院放射诊断科
-
朱甲明 | 中国医科大学附属第一医院胃肠肿瘤外科
-
朱晓东 | 复旦大学附属肿瘤医院肿瘤内科
胃癌是全球常见的恶性肿瘤之一,其发病率和病死率在全球恶性肿瘤中分别位居第5位和第4位[1]。国家癌症中心统计数据[2]显示,中国每年新增的胃癌病例约占全球总例数的50%。且与日本、韩国等邻国截然不同的是,中国有高达70.8%的胃癌患者在确诊时已进入局部进展期,严重影响中国胃癌患者的预后[3]。但目前对于局部进展期胃癌,特别是侵犯邻近脏器的局部进展期胃癌的具体诊断方法、围手术期及手术方案的选择,尚未达成一致。因此,进一步规范侵犯邻近脏器的局部进展期胃癌的临床诊疗方法,对于提高疗效和改善患者预后都具有重要意义。
本共识已在国际实践指南注册与透明化平台(Practice guideline REgistration for transPAREncy,PREPARE)上注册,注册号为PREPARE-2024CN296。
1 共识制定方法
1.1 共识专家构成
共有38名来自上海、安徽、辽宁、浙江、北京、湖北、广东、陕西、山西、四川、江苏、山东、福建共13个不同地区的专家参与问卷咨询与调研,涵盖胃肠外科、普外科、肿瘤科、放射诊断科、放疗科、肿瘤基础研究、流行病学及卫生统计学等领域的多学科专家,其中包含1名统计学专家,只参与数据统计,不参与问卷调查;97.37%(37/38)的专家有诊断、治疗侵犯邻近脏器的进展期胃癌的一线临床工作经验,81.57%(31/38)的专家曾主持或参与侵犯邻近脏器的进展期胃癌的相关临床研究,所有的专家均来自三级甲等医院。
1.2 文献检索方法
检索的英文数据库包括PubMed、Embase、Clinical Trials和Cochrane Library,中文数据库包括中国知网、万方数据和中国生物医学文献服务系统,检索时限为建库至2023年12月,英文检索词包括gastric cancer、local advanced gastric cancer、invasion of adjacent organs、operation、combined evisceration、adjuvant therapy、 radiotherapy、new adjuvant therapy、conversion therapy、immunotherapy;中文检索词包括胃癌、局部进展期胃癌、侵犯、手术治疗、联合脏器切除、辅助治疗、放疗、新辅助治疗、转化治疗、免疫治疗。纳入的文献包括报道胃癌侵犯邻近脏器的进展期胃癌患者诊疗的系统评价、meta分析、随机对照试验、队列研究、病例对照研究和病例报告等,排除索引目录、社论及重复文献。通过文献检索与筛选、证据总结,构建并起草“陈述”。
1.3 德尔菲问卷调查法
采用德尔菲问卷调查法就侵犯邻近脏器的进展期胃癌的临床诊疗进行专家函询。投票设置 “非常同意”“基本同意”“不确定”“不同意”和“非常不同意”5个选项,专家可对每条 “陈述”提出修改意见。每次调查结束后,根据专家的反馈意见对“陈述”进行修改或增补。
1.4 证据分级方法和推荐强度
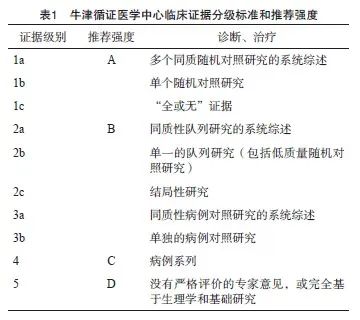
本共识采用牛津循证医学中心于2009年更新制定的临床证据分级标准和推荐强度系统将循证等级划分为5级(1~5级),推荐强度采用A~D表示(从强到弱),具体情况见表1。
1.5 共识的目标人群与使用人群
本共识的目标人群为邻近脏器受侵犯的进展期胃癌患者,使用人群为从事胃癌基础和临床研究的医务工作者。
1.6 共识的传播、实施及更新
本共识发布后,共识工作组将主要通过以下方式进行传播和推广:① 在学术期刊上发表本共识;② 在相关学术会议中对本共识进行解读;③ 通过媒体、公众号等进行推广;④ 有计划地在中国部分省、市、自治区组织本共识的推广专场会议,确保基层医务工作者充分了解本共识推荐的诊疗方法。共识工作组将综合循证医学证据及临床实践需求的进展,对本共识进行修订。计划每年对本共识的推荐意见予以更新和完善。
2 结果
2.1 问卷收集情况
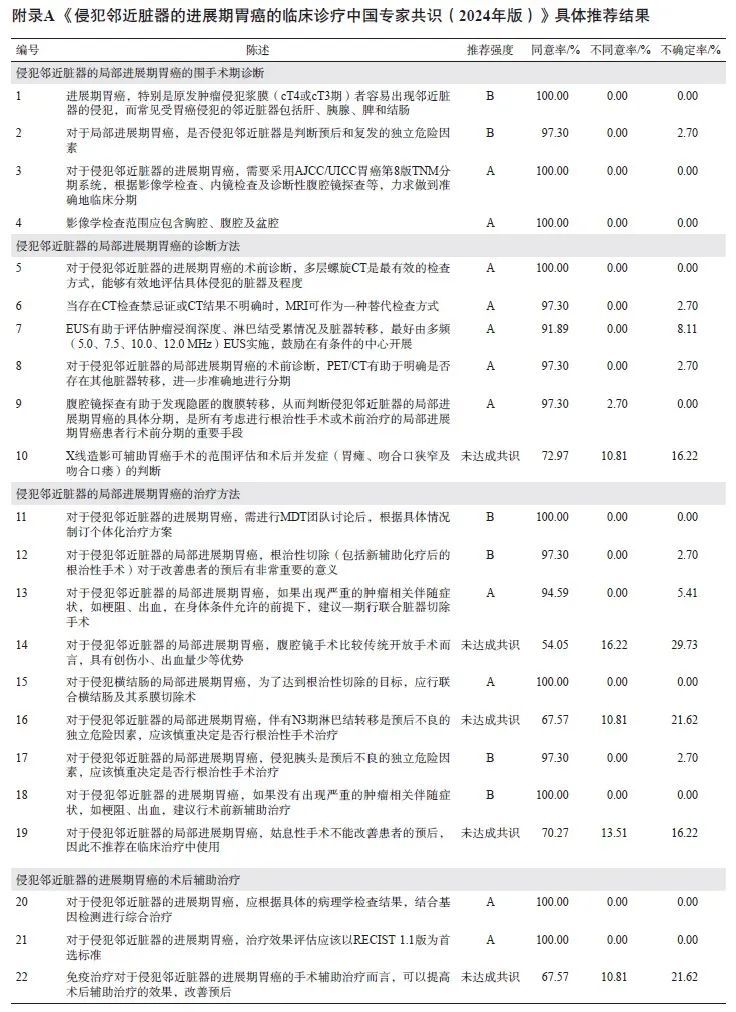
共开展了4次问卷调查,37名专家参与问卷填写,收集了123条专家建议。汇总分析4次问卷数据,共调查了35条“陈述”,基于审核专家的一致意见,删除了13条“陈述”,最终纳入分析的22条“陈述”中,共有17条达成共识(同意率≥75%),具体推荐结果见附录A。最后经审核并部分修改后定稿。
2.2 共识达成情况
2.2.1 进展期胃癌侵犯邻近脏器的围手术期诊断
2.2.1.1 侵犯脏器的范围
进展期胃癌,特别是原发肿瘤侵犯浆膜(cT4或cT3期)者容易出现邻近脏器的侵犯,而常见受胃癌侵犯的邻近脏器包括肝、胰腺、脾和结肠(推荐强度B)。
背景与证据:局部浸润性生长是进展期胃癌的主要转移途径之一,胃癌可沿胃壁浸润生长,胃底部、贲门部位的癌细胞可以侵犯食管下端,胃窦癌可向十二指肠浸润。而当胃癌突破胃壁浆膜后,可直接侵袭相邻器官。国内外的大宗病例报告[4-5]均显示,胃癌通常可直接侵犯的脏器包括肝、膈肌、胰腺、脾和横结肠,其中胰腺和结肠尤为常见。
2.2.1.2 准确诊断的意义
对于局部进展期胃癌,是否侵犯邻近脏器是判断预后和复发的独立危险因素(推荐强度 B)。
背景与证据:对于进展期胃癌而言,肿瘤的T分期表示肿瘤侵犯胃壁的深度及是否存在邻近器官侵犯,是影响R0切除率的主要因素,也是决定手术方式、预测手术根治的可能性和患者预后的主要因素[6-7]。
2.2.1.3 术前分期
对于侵犯邻近脏器的进展期胃癌,需要采用美国癌症联合会(American Joint Committee on Cancer,AJCC)/国际抗癌联盟(Union for International Cancer Control,UICC)胃癌第8版TNM分期系统,基于影像学检查、内镜检查、诊断性腹腔镜探查的结果,力求达成准确的临床分期(推荐强度A)。
背景与证据:AJCC/UICC制定的第8版胃癌TNM分期系统在胃癌的诊断、治疗及预后评价方面发挥着至关重要的作用。第8版胃癌TNM分期系统在完善了T、N、M、G分期的基础上,重新规范了区域淋巴结的定义,并增加了临床分期及新辅助治疗后的病理学分期,从而更精确地对进展期胃癌进行分期,以便实施精准化治疗[8]。
2.2.1.4 术前检查范围
影像学检查范围应包含胸腔、腹腔及盆腔(推荐强度A)。
背景与证据:国内外多个指南均推荐对进展期胃癌行全面的影像学检查,尤其是胸部计算机体层成像(computed tomography,CT)检查,以明确是否存在肺及纵隔内的转移性病变[9]。
2.2.2 局部进展期胃癌侵犯邻近脏器的诊断方法
2.2.2.1 多层螺旋CT
对于侵犯邻近脏器的进展期胃癌的术前诊断,多层螺旋CT是最有效的检查方式,能够有效地评估具体侵犯的脏器及程度(推荐强度A)。
背景与证据:多层螺旋CT作为一种非侵入性检查手段,与其他方法相比具有特异度高、扫描速度快等优势,因此已成为进展期胃癌术前分期评估的首选方法[10]。有研究[11]显示,多层螺旋CT轴位图像结合冠状位、矢状位及任意角度的后处理图像判断肿瘤的大体类型和部位,准确率分别达89.6%和90.3%,而且对于侵犯邻近脏器的进展期胃癌,螺旋CT判断胰腺、肝和结肠是否受到侵犯的准确率分别为30.0%~92.0%、100.0%和30.0%~62.5%。
2.2.2.2 磁共振成像(magnetic resonance imaging,MRI)
当存在CT检查禁忌证或CT检查结果不明确时,MRI可作为一种替代检查方式(推荐强度A)。
背景与证据:MRI及以弥散加权成像(diffusion weighted imaging,DWI)为代表的磁共振功能成像具有无辐射损伤、极低对比剂的肾脏毒性、高分辨率及多方位多角度扫描建图等优势,对于进展期胃癌的术前分期具有很好的临床价值。有研究[12]显示,MRI对进展期胃癌T分期的诊断总准确率为82.81%,而对N分期的诊断准确率不同分期之间差距较大,其中对N0、N1、N2和N3期的诊断准确率分别为83.33%、65.00%、61.43%和85.71%。因此,目前普遍认为MRI适用于碘对比剂过敏而无法进行增强CT检查的患者,并有助于肝转移灶的评价[13]。
2.2.2.3 超声内镜(endoscopic ultrasonography,EUS)
EUS有助于评估肿瘤浸润深度、淋巴结受累情况及脏器转移,最好由多频(5.0、7.5、10.0、12.0 MHz)EUS实施,鼓励在有条件的中心开展(推荐强度A)。
背景与证据:EUS将超声与内镜结合,可通过内镜观察胃腔内病变形态,还可通过超声对胃壁组织学特征进行成像,从而可准确地确判断肿瘤是否存在淋巴结转移及肿瘤周围有无脏器浸润等。近年来,EUS已广泛应用于胃癌患者的临床分期,有研究[14]显示,EUS对胃癌T分期的诊断总准确率达81.6%,其中对T1、T2、T3和T4期的诊断准确率分别为82.8%、76.9%、82.7%和87.5%。
2.2.2.4 正电子发射计算机体层成像(positron emission tomography and computed tomography, PET/CT)
对于侵犯邻近脏器的局部进展期胃癌的术前诊断,PET/CT有助于明确是否存在其他脏器转移,进一步准确地进行分期(推荐强度A)。
背景与证据:腹膜转移是进展期胃癌最常见的远处转移方式,占胃癌远处转移的50%以上, CT、MRI等传统影像学检查对较小腹膜转移灶诊断的局限性较明显。PET/CT融合了代谢及解剖学形态信息,可于早期及时地发现微小腹膜转移灶,诊断灵敏度明显高于CT检査,避免了不必要的剖腹探査及腹腔镜检查,欧洲肿瘤内科学会(European Society for Medical Oncology,ESMO)胃癌临床指南推荐使用PET/CT检测胃癌是否伴有腹膜转移[15]。
2.2.2.5 腹腔镜探查
腹腔镜探查有助于发现隐匿的腹膜转移,从而判断侵犯邻近脏器的局部进展期胃癌的具体分期,是所有考虑进行根治性手术或术前治疗的局部进展期胃癌患者行术前分期的重要手段(推荐强度A)。
背景与证据:进展期胃癌容易出现腹膜转移,与高T分期尤其是T4期、淋巴结转移程度密切相关。有研究[16]显示,T3或T4期以及N+期患者的腹膜转移发生率为25%,术后病理学检查结果显示,淋巴结阳性患者的腹膜转移发生率为阴性患者的3.84倍,淋巴结外转移患者发生腹膜转移的风险更高,而目前对于腹膜转移的诊断,影像学检出率仍较低,诊断性腹腔镜检查是判定腹膜转移最可靠的方式。尤其对临床隐匿性腹膜转移的检出,灵敏度和特异度均较高,并能够较准确地评估腹膜癌指数(peritoneal cancer index,PCI)评分及新辅助治疗反应等。一项日本的前瞻性临床研究[17]显示,对于进展期胃癌应用腹腔镜探查,结果有47%的患者因发现隐匿性腹膜转移而改变了初始治疗策略。
2.2.3 侵犯邻近脏器的局部进展期胃癌的新辅助治疗方案选择
2.2.3.1 治疗方案的制订
对于侵犯邻近脏器的进展期胃癌,需进行多学科诊疗(multi-disciplinary treatment,MDT)团队讨论后,根据具体情况制订个体化治疗方案(推荐强度B)。
背景与证据:由于胃癌治疗的复杂性不断增加,MDT模式越来越受到重视,MDT模式可以提高胃癌的诊疗质量,改善患者预后。首先, MDT讨论使临床诊断更加准确;其次,MDT会议能促进不同学科专家更好地进行沟通和信息共享,并监督胃癌患者治疗的连贯性,保证治疗方案如期实施[18]。
2.2.3.2 根治性手术
对于侵犯邻近脏器的局部进展期胃癌,根治性切除(包括新辅助化疗后的根治性手术)对于改善患者的预后有非常重要的意义(推荐强度 B)。
背景与证据:根治性手术对于进展期胃癌患者的预后有非常重要的意义[19]。而目前新辅助化疗已成为进展期胃癌的标准治疗方式之一,并且新辅助化疗后的术后病理学检查结果能直接地反映疗效,与pTNM分期相比,ypTNM分期将新辅助化疗后肿瘤的降期效应考虑在内,对进展期胃癌具有更好的评估作用[20]。
2.2.3.3 联合脏器切除
对于侵犯邻近脏器的局部进展期胃癌,如果出现严重的肿瘤相关伴随症状,如梗阻、出血,在身体条件允许的前提下,建议一期行联合脏器切除手术(推荐强度A)。
背景与证据:联合脏器切除术是一种常用的针对胃癌的外科治疗手段,有研究[21]显示,联合脏器切除术可以一次性切除所有相邻脏器中的肿瘤组织,清除病变部位并控制感染,可用于修复或恢复其功能,提高治愈率。大宗的病例报道[22]显示,联合脏器根治性切除组患者的5年生存率可达40%,即使联合脏器姑息性切除组的疗效亦优于单纯姑息性胃切除组。
2.2.3.4 联合肠系膜的根治性切除
对于侵犯横结肠的局部进展期胃癌,为了达到根治性切除的目标,应行联合横结肠及其系膜切除术(推荐强度A)。
背景与证据:D2淋巴结清扫术已经成为进展期胃癌的标准根治性手术,要求完全切除网膜囊包括横结肠系膜前叶和胰腺被膜。宋武等[23]统计胃癌根治术后有48%的复发患者复发部位与横结肠或横结肠系膜有关。日本的一项多中心、前瞻性、随机化临床研究[5]显示,胃癌根治术中切除横结肠系膜前叶及胰腺被膜可能有助于提高患者的术后生存率。而关于扩大淋巴结清扫在进展期胃癌中的应用尚无统一意见,日本胃癌分类第3版将胃癌的腹主动脉旁淋巴结转移视为远处转移,而且JCOG9501多中心随机临床试验结果显示,腹主动脉旁转移率为8.5%,与单纯D2根治术相比,在可治愈的胃癌中行D2根治术+腹主动脉旁淋巴结切除术未延长患者的总生存期,亦未提高患者的5年无复发生存率[24]。
2.2.3.5 侵犯胰腺者的手术方案制订
对于侵犯邻近脏器的局部进展期胃癌,侵犯胰头是预后不良的独立危险因素,应该慎重决定是否行根治性手术治疗(推荐强度B)。
背景与证据:有研究[25]显示,胃癌根治性切除联合胰十二指肠切除术可延长侵犯胰头的进展期胃癌患者的生存期,5年的生存率达47.4%,最长生存期达156个月。但胃癌根治术联合胰十二指肠切除术,手术创伤大,术后可能出现严重的并发症,围手术期死亡率高[26]。对于部分进展期胃癌,扩大手术范围也不一定能提高其5年生存率,因此需要慎重决定是否行根治性手术[27]。
2.2.3.6 围手术期治疗
对于侵犯邻近脏器的进展期胃癌,如果没有出现严重的肿瘤相关伴随症状,如梗阻、出血,建议行术前新辅助治疗(推荐强度B)。
背景与证据:术前新辅助治疗越来越广泛地用于进展期胃癌。既往研究[28]表明,术前新辅助治疗可使肿瘤缩小,达到降期、提高R0切除率的效果,同时可消灭微小转移灶、减少术后复发转移风险,使患者获益。
2.2.4 侵犯邻近脏器的进展期胃癌的术后辅助治 疗
2.2.4.1 术后辅助治疗
对于侵犯邻近脏器的进展期胃癌,应根据具体的病理学检查结果,结合基因检测进行综合治疗(推荐强度A)。
背景与证据:进展期胃癌的术后辅助化疗方案包括XELOX(奥沙利铂130 mg/m2静脉滴注,第1天;卡培他滨1 000 mg/m2每天两次口服,第1~14天;3周/疗程)、FOLFOX(奥沙利铂85 mg/m2静脉滴注,第1天;亚叶酸钙 400 mg/m2静脉滴注,第1天;5-FU 400 mg/m2静脉滴注,第1天,后续为2 400~3 600 mg/m2持续静脉滴注46 h;2周/疗程)和SOX(奥沙利铂130 mg/m2静脉滴注,第1天;替吉奥40 mg/m2每天两次口服,第1~14天;3周/疗程)[29]。靶向治疗方面,曲妥珠单抗联合化疗方案(如奥沙利铂/顺铂+5-FU/卡培他滨)是人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性胃癌患者的一线治疗方案,雷莫芦单抗[抗血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)单抗]单药或联合紫杉醇推荐为二线治疗方案,甲磺酸阿帕替尼(VEGFR2小分子酪氨酸激酶抑制剂)被推荐为晚期胃癌三线或三线以上治疗方案[30]。胃癌的免疫治疗主要依赖活化的T淋巴细胞歼灭胃癌细胞。淋巴细胞表面的免疫检查点主要包括程序性死亡蛋白-1(programmed death-1,PD-1)和细胞毒性T淋巴细胞相关抗原4(cytotoxic T lymphocyte associated antigen-4,CTLA-4),其在肿瘤微环境中的T淋巴细胞表面表达上调,通过传递抑制信号来抑制T淋巴细胞的功能[31]。目前免疫检查点抑制剂联合化疗获批为胃癌的一线治疗药物,纳武利尤单抗和帕博利珠单抗等更多用于治疗程序性死亡蛋白配体-1(programmed death ligand-1,PD-L1)联合综合阳性评分(combined positive score,CPS)高的复发或转移性胃或食管胃连接部腺癌。对高度微卫星不稳定(microsatellite instability-high,MSI-H)及错配修复缺陷(deficient mismatch repair,dMMR)的胃癌腹膜转移者,可用帕博利珠单抗、纳武利尤单抗行一线、二线或三线治疗[32]。ATTRACTION-2研究[33]中亚洲胃癌患者队列显示,与安慰剂组相比,纳武利尤单抗治疗组生存期显著延长,中位总生存期为5.26个月,3年生存率明显高于安慰剂组。
2.2.4.2 疗效评估
对于侵犯邻近脏器的进展期胃癌,疗效评估应该以实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)1.1版[34]为首选标准(推荐强度A)。
背景与证据:RECIST是由欧洲癌症研究与治疗组织、美国国家癌症研究所及加拿大国立癌症研究所共同制定的一种基于一维测量的评价标准,计算靶病灶的最大直径总和评价疗效,测量方法简单易行,可以通过重复测量以减少测量误差[35]。有研究[36]比较了世界卫生组织(World Health Organization,WHO)标准和RECIST,认为RECIST更具科学性,其比WHO标准更为简捷可靠,后者要求测量病灶的双垂直径,计算双径乘积之和的变化进行疗效评价,由于胃是空腔器官,其双径的测量及判断比较困难,应用WHO标准评价疗效几乎不可行。
3 讨论
本共识围绕侵犯邻近脏器的局部进展期胃癌的临床诊断方法、围手术期治疗、手术治疗及疗效评估等具体问题和研究进展等多个方面开展了多次德尔菲问卷调查,参与专家在胃癌研究领域具有一定权威性。在最终纳入调查的22条“陈述”中,强推荐的“陈述”为16条,推荐的“陈述”为1条,未达成共识的“陈述”共5条(附录A)。
未达成共识的“陈述”中,免疫治疗用于治疗局部进展期胃癌的效果目前尚不确定,而且目前多数研究尚处于进行中,因此专家对免疫治疗用于治疗局部进展期胃癌的效果尚未达成一致。未达成的共识主要集中在侵犯邻近脏器的局部进展期胃癌的手术方面,尤其是腹腔镜手术在这类疾病中的意义,虽然CLASS-01研究[37]已经明确腹腔镜手术在局部晚期胃癌患者中与传统开放手术具有类似的安全性及5年总生存率,而且创伤更小。但由于腹腔镜技术的局限性限制了其在可能需要进行联合脏器切除手术中的应用。其次是姑息性手术的意义,对于无法进行R0根治切除的进展期胃癌,姑息性手术包括减量手术、胃肠吻合短路手术等,主要目的在于缓解症状,提高患者的生活质量[38]。但有meta分析[39]显示,减量手术组在1、3和5年生存率方面,与非手术治疗组相比,均不能为患者带来生存获益;而且减量手术组围手术期患者的并发症发生率和病死率分别为15%和4%,均明显高于非手术组。同时,进展期胃癌发展迅速[40],很难达到姑息性手术的目的,而且预后几乎没有任何改善,因此在这次的调研中也未达成共识。最后关于淋巴结清扫的范围,目前D2淋巴结清扫是公认的标准清扫范围,而对于侵犯邻近脏器的进展期胃癌而言,适当扩大清扫范围是否能够清除转移或扩散的癌细胞,目前也没有一致的观点[41]。这些问题也是目前临床上争论的焦点,亟待更多临床研究加以验证。
本共识形成强推荐的“陈述”比较多,证明目前对于侵犯邻近脏器的局部进展期胃癌的诊断方法、价值及治疗方面的观点比较统一,值得在临床中推广应用。尤其在精确诊断的意义、MDT团队在治疗方案中的价值及综合治疗对改善预后的作用方面,都达到了100%的同意率。胃癌作为异质性显著的肿瘤之一,对于不同类型、部位的胃癌,围手术期治疗的效果也大不相同[42]。即使同一类型的胃癌由于分期不同,个体免疫微环境的不同,疗效也有很大差别。随着进展期胃癌术前分期的手段越来越多,越来越精准,以及胃癌分子分型越来越科学,根据不同分型采取的综合治疗的手段和模式越来越丰富,必将使进展期胃癌的外科综合治疗进一步规范化、科学化。
本共识基于国内外现有的文献证据及前期临床研究结果与专家共识,采用德尔菲问卷调查法,就目前侵犯邻近脏器的进展期胃癌的临床诊疗过程中所共同关注的诊断方法、围手术期治疗、手术治疗及疗效评估等具体问题和热点,形成了更加精准的临床实践指导意见,有望为临床医师治疗侵犯邻近脏器的进展期胃癌提供有益的参考。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249.
[2] ZHENG R, ZHANG S W, ZENG H, et al. Cancer incidence and mortality in China, 2016[J]. J Natl Cancer Cent, 2022, 2(1): 1-9.
[3] 薛 驰, 高 鹏, 朱 志, 等. 免疫治疗在胃癌的围手术期及转化治疗中的应用和挑战[J]. 中国癌症杂志, 2024, 34(3): 259-267.
XUE C, GAO P, ZHU Z, et al. Application and challenge of immunotherapy in perioperative therapy of gastric cancer[J]. China Oncol, 2024, 34(3): 259-267.
[4] YANG Y, WANG X Y, DUAN C, et al. Clinicopathological characteristics and its association with digestive system tumors of 1 111 patients with Schistosomiasis japonica[J]. Sci Rep, 2023, 13(1): 15115.
[5] OKABE H, AOYAMA H, MIYAHARA Y, et al. Dorsal approach for advanced gastric cancer invading the transverse mesocolon[J]. Ann Gastroenterol Surg, 2023, 7(4): 678-683.
[6] AN W X, BAO L J, WANG C Y, et al. Analysis of related risk factors and prognostic factors of gastric cancer with liver metastasis: a SEER and external validation based study[J]. Int J Gen Med, 2023, 16: 5969-5978.
[7] DING P A, YANG P G, TIAN Y, et al. The clinical value of further accurate staging of PT2 gastric cancer based on the depth of invasion[J]. Chin J Oncol, 2021, 43(11): 1197-1202.
[8] FANG C, WANG W, DENG J Y, et al. Proposal and validation of a modified staging system to improve the prognosis predictive performance of the 8th AJCC/UICC pTNM staging system for gastric adenocarcinoma: a multicenter study with external validation[J]. Cancer Commun, 2018, 38(1): 67.
[9] CHEN A H, CHAN W H, LEE Y H, et al. Routine chest CT for staging of gastric cancer[J]. Br J Surg, 2019, 106(9): 1197-1203.
[10] BAI L G, LIU W M, DI S T, et al. Clinical study of CT enhanced scan in preoperative TNM staging of advanced gastric cancer and the effect of misdiagnosis rate[J]. Panminerva Med, 2023, 65(2): 259-260.
[11] 闫文锋, 孙培春, 吴 刚, 等. 3D-CT模拟影像描述胃周动脉变异对腹腔镜全胃切除术的指导作用[J]. 中华胃肠外科杂志, 2021, 24(2): 173-178.
YAN W F, SUN P C, WU G, et al. Application of 3D-CT simulation image in the description of gastric artery variation to guide laparoscopic total gastrectomy[J]. Chin J Gastrointest Surg, 2021, 24(2): 173-178.
[12] GAI Q, LI X, LI N, et al. Clinical significance of multi-slice spiral CT, MRI combined with gastric contrast-enhanced ultrasonography in the diagnosis of T staging of gastric cancer[J]. Clin Transl Oncol, 2021, 23(10): 2036-2045.
[13] TATSUBAYASHI T, TANIZAWA Y, MIKI Y, et al. Treatment outcomes of hepatectomy for liver metastases of gastric cancer diagnosed using contrast-enhanced magnetic resonance imaging[J]. Gastric Cancer, 2017, 20(2): 387-393.
[14] PARK J Y, JEON T J. Diagnostic evaluation of endoscopic ultrasonography with submucosal saline injection for differentiating between T1a and T1b early gastric cancer[J]. World J Gastroenterol, 2022, 28(46): 6564-6572.
[15] SHITARA K, FLEITAS T, KAWAKAMI H, et al. Pan-Asian adapted ESMO clinical practice guidelines for the diagnosis, treatment and follow-up of patients with gastric cancer[J]. ESMO Open, 2024, 9(2): 102226.
[16] 张维汉, 胡建昆. 胃癌腹膜转移诊治现状[J]. 中华胃肠外科杂志, 2021, 24(3): 204-207.
ZHANG W H, HU J K. Current status of diagnosis and treatment of gastric cancer peritoneal metastasis[J]. Chin J Gastrointest Surg, 2021, 24(3): 204-207.
[17]NOMA T, TAKAHASHI T, MIYAZAKI Y, et al. Multi-look staging laparoscopy and conversion surgery for gastric cancer with peritoneal metastases[J]. Gan To Kagaku Ryoho, 2019, 46(1): 184-186.
[18]ZHANG Q, ZHOU Y, SONG L J, et al. China special issue on gastrointestinal tumors-Improved survival after multidisciplinary team decision for patients with advanced gastrointestinal cancer: a multicenter, noninterventional, controlled study[J]. Int J Cancer, 2023, 153(11): 1885-1893.
[19]CAI Z M, LIN H M, LI Z X, et al. The short- and long-term outcomes of laparoscopic D2 lymphadenectomy plus complete mesogastrium excision for lymph node-negative gastric cancer[J]. Surg Endosc, 2024, 38(2): 1059-1068.
[20]SANDØ A D, GRØNBECH J E, BRINGELAND E A. Does the ypTNM-stage adequately predict long-term survival rates in gastric cancer patients receiving neoadjuvant chemotherapy followed by radical rep?[J]. Acta Oncol, 2023, 62(12): 1846-1853.
[21]SMYTH E C, NILSSON M, GRABSCH H I, et al. Gastric cancer[J]. Lancet, 2020, 396(10251): 635-648.
[22]ZHANG X J, WANG W Q, ZHAO L L, et al. Short-term safety and long-term efficacy of multivisceral rep in pT4b gastric cancer patients without distant metastasis: a 20-year experience in China National Cancer Center[J]. J Cancer, 2022, 13(10): 3113-3120.
[23]宋 武, 何裕隆. 晚期胃癌腹主动脉旁淋巴结转移综合治疗策略[J]. 中国实用外科杂志, 2017, 37(10): 1102-1106.
SONG W, HE Y L. Comprehensive treatment strategies of advanced gastric cancer with para-aortic lymph node metastasis[J]. Chin J Pract Surg, 2017, 37(10): 1102-1106.
[24]SASAKO M, SANO T, YAMAMOTO S, et al. D2 lymphadenectomy alone or with para-aortic nodal disp for gastric cancer[J]. N Engl J Med, 2008, 359(5): 453-462.
[25]LI D B, YOU J, WANG S J, et al. Pancreaticoduodenectomy for locally advanced gastric cancer: results from a pooled analysis[J]. Asian J Surg, 2019, 42(3): 477-481.
[26]SCHIZAS D, GIANNAKODIMOS I, MYLONAS K S, et al. Multivisceral rep for locally advanced gastric cancer: a systematic review and evidence quality assessment[J]. J Clin Med, 2023, 12(23): 7360.
[27]KUMAGAI K, NUNOBE S, HIKI N, et al. Anatomical position of the pancreas as a risk factor for pancreatic fistula after laparoscopic gastrectomy for gastric cancer[J]. World J Surg, 2023, 47(7): 1744-1751.
[28]CAINAP C, NAGY V, SEICEAN A, et al. Results of third-generation epirubicin/cisplatin/xeloda adjuvant chemotherapy in patients with radically resected gastric cancer[J]. J BUON, 2016, 21(2): 349-359.
[29]LI N, LI Z, FU Q, et al. Efficacy and safety of neoadjuvant sintilimab in combination with FLOT chemotherapy in patients with HER2-negative locally advanced gastric or gastroesophageal junction adenocarcinoma: an investigator-initiated, single-arm, open-label, phase Ⅱ study[J]. Int J Surg, 2024, 110(4): 2071-2084.
[30]许永虎, 徐大志. 21世纪以来胃癌治疗进展及未来展望[J]. 中国癌症杂志, 2024, 34(3): 239-249.
XU Y H, XU D Z. Progress and prospects of gastric cancer treatment in the 21st century[J]. China Oncol, 2024, 34(3): 239-249.
[31]XIA L Z, OYANG L, LIN J G, et al. The cancer metabolic reprogramming and immune response[J]. Mol Cancer, 2021, 20(1): 28.
[32]BOILÈVE J, TOUCHEFEU Y, MATYSIAK-BUDNIK T. Clinical management of gastric cancer treatment regimens[J]. Curr Top Microbiol Immunol, 2023, 444: 279-304.
[33]BOKU N, SATOH T, RYU M H, et al. Nivolumab in previously treated advanced gastric cancer (ATTRACTION-2): 3-year update and outcome of treatment beyond progression with nivolumab[J]. Gastric Cancer, 2021, 24(4): 946-958.
[34]EISENHAUER E A, THERASSE P, BOGAERTS J, et al. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2009, 45(2): 228-247.
[35]TSAGKALIDIS V, BLASZCZYK M B, IN H. Interpretation of tumor response grade following preoperative therapy for gastric cancer: an overview[J]. Cancers, 2023, 15(14): 3662.
[36]KARABULUT S, DOGAN I, USUL AFSAR C, et al. Does nutritional status affect treatment tolerability, chemotherapy response and survival in metastatic gastric cancer patients? Results of a prospective multicenter study in Turkey[J]. J Oncol Pharm Pract, 2022, 28(1): 127-134.
[37]HUANG C M, LIU H, HU Y F, et al. Laparoscopic vs open distal gastrectomy for locally advanced gastric cancer: five-year outcomes from the CLASS-01 randomized clinical trial[J]. JAMA Surg, 2022, 157(1): 9-17.
[38]KARPEH M S JR. Palliative treatment and the role of surgical rep in gastric cancer[J]. Dig Surg, 2013, 30(2): 174-180.
[39]李 杨, 王 权, 叶颖江, 等. 应用减量手术治疗无症状不可切除性晚期胃癌疗效meta分析[J]. 中国实用外科杂志, 2022, 42(1): 80-86.
LI Y, WANG Q, YE Y J, et al. Meta-analysis of the efficacy of reduction surgery in incurable asymptomatic advanced gastric cancer[J]. Chin J Pract Surg, 2022, 42(1): 80-86.
[40]汪学非, 周 鹏, 唐兆庆. 胃癌外科治疗的新进展及发展趋势[J]. 中国癌症杂志, 2024, 34(3): 250-258.
WANG X F, ZHOU P, TANG Z Q. New progress and development trend of surgical treatment for gastric cancer[J]. China Oncol, 2024, 34(3): 250-258.
[41]WANG X D, CHEN Y, GAO Y S, et al. Predicting gastric cancer outcome from resected lymph node histopathology images using deep learning[J]. Nat Commun, 2021, 12(1): 1637.
[42]SONG X H, ZHANG W H, KAI-LIU, et al. Prognostic impact of Borrmann classification on advanced gastric cancer: a retrospective cohort from a single institution in western China[J]. World J Surg Oncol, 2020, 18(1): 204.


