皮肤屏障与特应性皮炎
时间:2023-09-01 11:56:05 热度:37.1℃ 作者:网络
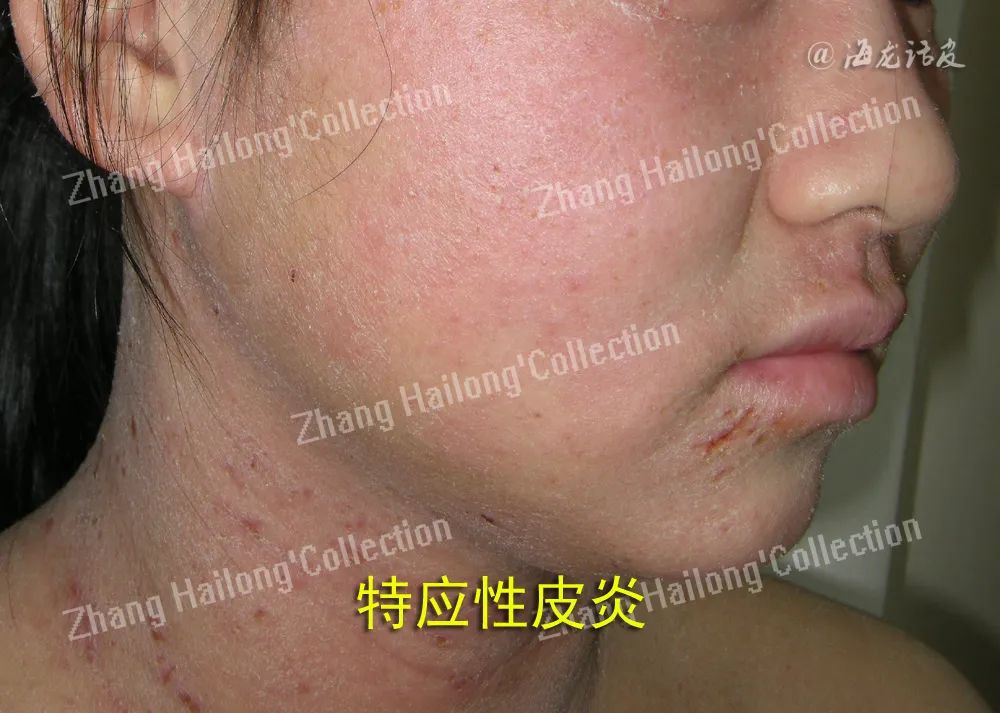
特应性皮炎 (AD) 是一种常见的慢性炎症性皮肤病,在我国AD患病率呈明显升高的趋势。AD发生后可出现食物过敏、过敏性鼻炎和哮喘,这个过程称为特应性进程(atopic march)。明确AD的发病机制有利于控制或阻断该进程。
皮肤屏障结构与功能异常是特应性皮炎的主要病理生理改变,而皮肤屏障的修复已成为特应性皮炎的基础治疗。
皮肤屏障
皮肤屏障主要由角质层相关结构以及紧密连接所构成,角质层位于皮肤最外层,形成“砖墙结构”,是皮肤屏障的主要组成部分,而紧密连接对于维持皮肤屏障的完整性也至关重要。角质形成细胞具有物理屏障作用,可减少机械性损伤及外界物质的入侵,同时其所含成分与结构是皮肤屏障的重要成分,包括丝聚合蛋白、角质化包膜、角质桥粒、蛋白酶、细胞间脂质等。
1.丝聚合蛋白(filaggrin, FLG)
FLG及其代谢产物对于维持皮肤屏障具有重要作用。在角质层浅层,FLG与角蛋白解离并被分解为游离氨基酸,包括乳酸、尿刊酸和吡咯烷酮羧酸等,是构成天然保湿因子的重要成分,后者对于皮肤保湿具有重要意义。乳酸和吡咯烷酮羧酸吸收水分溶解后,可阻止角质细胞间裂隙形成从而增强角质层的完整性,抵抗外界环境物质的进入。此外,这些酸性物质有利于保持角质层的酸性环境。
2.角质化包膜(cornified envelope, CE)
在角质层,CE是位于角质细胞膜内侧的一种特殊屏障结构,它包裹角质细胞,提高了角质细胞的强度。角质化包膜由高度交联的蛋白形成,包括兜甲蛋白、斑蛋白、内披蛋白等。在从棘层至角质层分化过程中,角质形成细胞内包斑蛋白与周斑蛋白形成异二聚体,并与内披蛋白结合,在转谷氨酰胺酶的作用下互相交联。内披蛋白作为支架,斑蛋白二聚体连接角蛋白束,继而与桥粒蛋白结合,形成稳定的机械性结构,而兜甲蛋白和小分子富含脯氨酸的蛋白质也在转谷氨酰胺酶的作用下与内披蛋白反复交联强化CE。
3.角质桥粒
角质桥粒由3种蛋白家族构成,包括钙黏蛋白、犰狳蛋白(armadillo proteins)和斑蛋白。钙黏蛋白家族的桥粒芯糖蛋白1和桥粒芯胶蛋白1与犰狳蛋白家族的斑珠蛋白和斑菲素蛋白相互交联,并与包斑蛋白和周斑蛋白结合,从而与相邻的角质细胞形成稳定的连接。与角质形成细胞之间的桥粒不同的是,角质桥粒含有角质桥粒蛋白以增强桥粒芯糖蛋白1和桥粒芯胶蛋白1之间的黏合。角质细胞通过角质桥粒增强稳定性,有利于减少机械性损伤。
4.蛋白酶及其抑制剂
角质细胞不断从角质层表面脱落,对于维持角质层的稳态具有重要意义。角质细胞的脱落主要受激肽释放酶(kallikreins, KLKs)相关肽酶的调控,如KLK5、KLK7和 KLK14等。KLKs属于丝氨酸蛋白酶家族,在颗粒层表达。KLKs可裂解角质桥粒,KLK5和KLK14具有胰蛋白酶活性,可裂解桥粒芯糖蛋白,KLK7具有糜蛋白酶活性,可裂解桥粒芯胶蛋白和角质桥粒蛋白。KLKs的作用受到严格调控,主要与丝氨酸蛋白酶抑制剂(lym-phoepithelial Kazal-type 5 inhibitor, LEKTI)有关。KLKs和LEKTI储存于板层小体,在颗粒层与角质层交界处释放入细胞间隙中发挥作用,二者活性均与局部pH有关。在角质层浅层偏酸性环境中,KLKs与LEKTI活性均受到抑制,仅出现局部角质桥粒的裂解和角质细胞脱落。
5.细胞间脂质
细胞间脂质相当于表皮“砖墙结构”的重要成分—灰浆,由神经酰胺、游离脂肪酸和胆固醇组成。这些成分在颗粒层形成并储存于板层小体,到达角质层时释放到细胞外间隙。其中,ω-羟基神经酰胺可在转谷氨酰胺酶作用下与内披蛋白结合,包裹在角质细胞表面,作为模板继而在角质细胞间形成了脂质层,并最终取代了细胞膜的脂质双层结构。细胞间脂质是角质层唯一的连续性结构,成为物质经皮肤弥散渗透的主要通道。因此,细胞间脂质一方面有利于阻止经皮水分丢失(TEWL), 另一方面可阻止外界环境中的物质进入表皮,增强皮肤屏障的弹性与紧实性。
6.紧密连接
除了以上角质层相关结构外,紧密连接对于维持皮肤屏障的完整性也是至关重要的。紧密连接是由密封蛋白(claudin)、闭锁蛋白以及一些胞浆支架蛋白如闭锁小带蛋白(zonula occludens)等所构成。在颗粒层,紧密连接覆盖在角质形成细胞表面,封闭了细胞间空隙,是一些离子和蛋白的屏障,防止其丢失以及外界环境物质的进入。由于大部分皮肤含有角质层,因此紧密连接可视为角质层之外的第二道屏障,但是在缺少角质层的皮肤附属器,如毛囊和汗腺等部位则是主要的屏障结构。
皮肤屏障与AD
AD的病因比较复杂,疾病的始发因素尚不清楚。Elias 等提出了AD发病的“outside-inside-outside”模型,认为遗传等因素引起的皮肤屏障功能损伤可能是AD进展的第一步,在内外多种因素作用下引起免疫功能异常,继而加重皮肤屏障功能损伤,因此形成恶性循环。
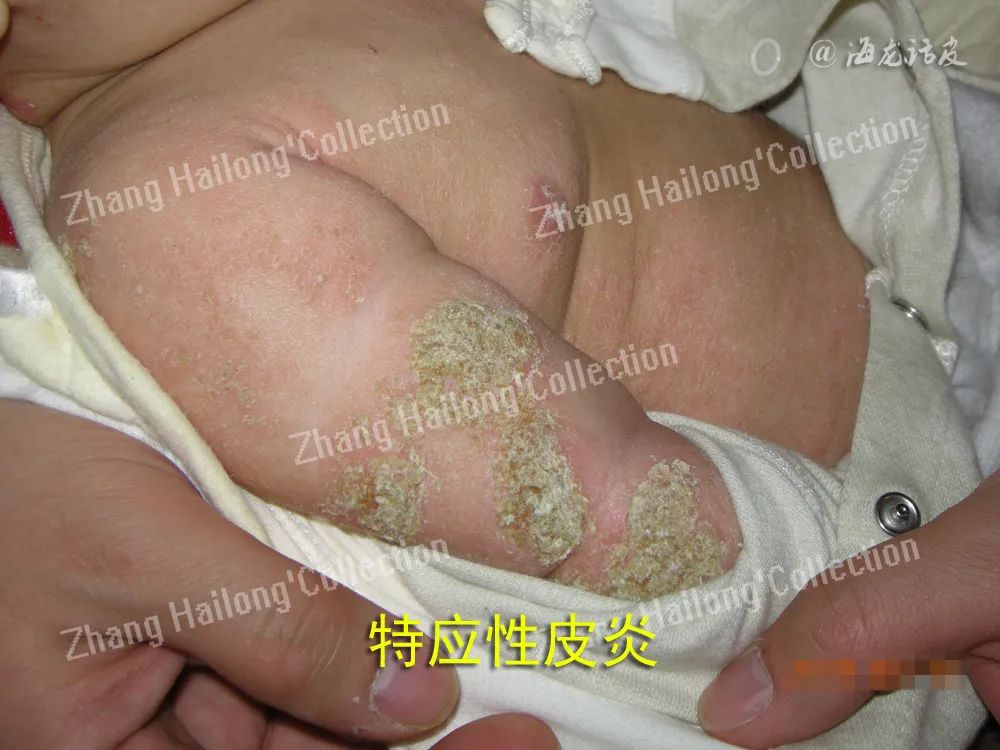
AD患者存在大量相关基因位点改变,其中以FLG突变最为常见。欧洲AD患者携带FLG基因突变的发生率可高达约50%,而亚洲AD患者FLG基因突变的发生率相对较低,我国汉族人群约为31.4%,日本约为27%。有研究发现,携带FLG基因突变与AD强相关,且增加患者过敏和哮喘的风险。FLG无义突变及拷贝数变异可引起FLG 表达降低,继而引起角质形成细胞分化异常、角质细胞完整性改变、皮肤水合能力下降、表皮pH升高以及脂质产生异常等。此外,AD还与皮肤屏障其他相关分子基因的单核苷酸多态性(SNP)和基因突变等有关,如分别编码LEKTI、蛋白酶活化受体 2(protease activated receptor 2, PAR2)和密封蛋白1的基因SPINK5、F2RL1和CLDN1等。
皮肤屏障功能受损时,外界环境因素如刺激物质、半抗原、抗原等可引起Th2型免疫反应。病原微生物、过敏原及搔抓等均可引起角质形成细胞产生胸腺基质淋巴生成 素(thymic stromal lymphopoietin, TSLP),继而诱导树突状细胞介导Th2型免疫反应,以及B细胞增殖和分化。角质形成细胞还可产生白细胞介素(IL)-25、IL-33等促进Th2型免疫反应以及朗格汉斯细胞活化,产生T细胞趋化因子等。表皮朗格汉斯细胞、真皮树突状细胞等具有抗原提呈功能,且表面分布高亲和力IgE受体,可引起针对外界抗原或自身抗原的T细胞介导的免疫反应。此外,尘螨和金黄色葡萄球菌等外源性蛋白酶也可以裂解角质桥粒引起皮肤屏障功能损伤。
正常皮肤表面呈弱酸性,这与皮肤表面微生物、毛囊皮脂腺与汗腺产生的游离脂肪酸和乳酸及FLG代谢产生的酸性物质等有关。皮肤屏障损伤可引起表皮pH升高,导致皮肤表面病原微生物定植、表皮细胞脱落异常、角质层完整性的破坏。AD患者皮损区和非皮损区表皮均出现pH明显升高,而表皮pH升高使KLKs活性增强,一方面引起角质桥粒的裂解、破坏角质层完整性,另一方面可活化PAR2,进而诱导角质形成细胞产生TSLP。
Rerknimitr等认为屏障损伤、免疫紊乱和瘙痒(搔抓)三者相互作用,形成正反馈循环,可能导致AD的慢性化。屏障损伤所引起的Th2型免疫反应可能与过敏性鼻炎、哮喘等密切相关,形成特应性进程(atopic march)。
皮肤屏障修复在AD治疗中的作用
考虑到皮肤屏障在AD发病中的重要作用,目前修复皮肤屏障治疗和预防AD已成为研究热点。多国诊疗指南均将保湿润肤以及皮肤屏障修复作为AD的基础治疗。
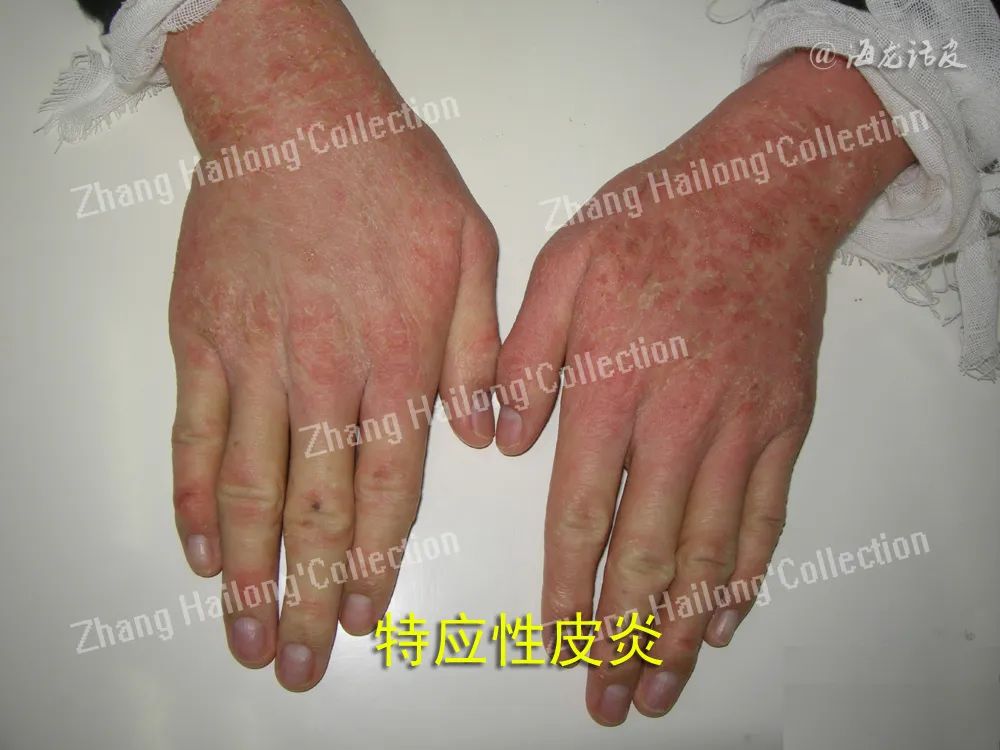
婴儿期规律使用保湿剂可使AD的患病率减少32%~50%,而保湿剂的使用安全简便且成本低廉,有利于大面积推广并减少疾病负担,这提示早期修复皮肤屏障是预防AD的重要策略,也为皮肤屏障受损是AD发病初始环节提供了理论支持。含有皮肤屏障相关成分的保湿剂可能对于修复皮肤屏障具有更为直接的效果。队列研究发现,使用含神经酰胺的浴液和保湿剂可明显减轻AD症状和瘙痒程度。而外用尿刊酸可以减少皮肤 TEWL,减轻AD患者红斑和疾病严重程度。此外,也可采用具有多种活性物质的复方制剂,如由维生素B3棕榈基单乙醇酰胺、β-谷甾醇蔗糖酯和锌构成的润肤剂,采用多层脂质复合物增强进入皮肤的能力,具有止痒、抗炎和抗菌作用,兼具皮肤屏障修复能力,可显著改善AD症状。有研究发现含神经酰胺、生理性脂质的皮肤屏障修复制剂在治疗儿童中、重度AD方面的疗效与0.05%氟替卡松类似。
FLG替代治疗也是修复皮肤屏障功能的重要手段。外用尿素作为保湿因子可增强FLG表达、脂质合成及抗菌肽的产生,增强皮肤屏障功能。过氧化物酶体增殖物活化受体激动剂可增强FLG的表达,有利于角质形成细胞的分化和增殖。芹菜素可刺激表皮分化、FLG表达、脂质合成以及抗菌肽的产生,改善表皮渗透屏障功能。JTC801是一种选择性阿片受体1拮抗剂,可增强角质形成细胞FLG的表达,减轻AD样皮肤炎症反应。Janus激酶抑制剂JTE052可抑制STAT3,促进FLG表达而改善皮肤屏障功能。
此外,维持皮肤pH弱酸性在AD干预方面也具有重要意义。Lee等发现外用酸性制剂可部分缓解AD小鼠疾病严重程度,促进皮肤屏障修复。
总结
综上所述,皮肤屏障相关结构(主要是FLG和蛋白酶及其抑制剂)与AD发病密切相关,针对性地进行屏障修复有利于AD的治疗和预防。因此,继续探索皮肤屏障相关结构的功能将明确AD的发病机制,并为AD以及其他特应性疾病的治疗提供理论依据。
参考文献:
[1]慕彰磊,张建中.皮肤屏障与特应性皮炎[J].临床皮肤科杂志,2019,48(11):707-709.
[2]Egawa G, Kabashima K. Barrier dysfunction in the skin allergy [J]. Allergol Int, 2018, 67(1): 3-11.
[3]Zhang H, Guo Y, Wang W, et al. Mutations in the filaggrin gene in Han Chinese patients with atopic dermatitis [J]. Allergy, 2011, 66(3): 420-427.
[4]Amano W, Nakajima S, Kunugi H, et al. The Janus kinase in- hibitor JTE -052 improves skin barrier function through sup- pressing signal transducer and activator of transcription 3 signal-ing[J]. J Allergy Clin Immunol, 2015, 136(3): 667-677.
[5]Lee NR, Lee HJ, Yoon NY, et al. Application of topical acids improves atopic dermatitis in murine model by enhancement of skin barrier functions regardless of the origin of acids [J]. Ann Dermatol, 2016, 28(6): 690-696.


