Lancet Oncol:全球首创PD-1/CTLA-4双抗卡度尼利治疗晚期实体瘤研究成果发表
时间:2023-10-15 14:28:35 热度:37.1℃ 作者:网络
近日,《柳叶刀·肿瘤学》(The Lancet Oncology, IF 51.1)在线发表了北京大学肿瘤医院季加孚教授、沈琳教授和复旦大学附属肿瘤医院吴小华教授团队联合完成的卡度尼利(cadonilimab,PD-1/CTLA-4双特异性抗体)治疗晚期实体瘤(包括宫颈癌、食管鳞癌、肝癌)的多中心、开放标签的Ib/II期临床研究(COMPASSION-03/AK104-201)成果。
作为中国本土自主研发的全球首创的PD-1/CTLA-4双抗,卡度尼利具有同时靶向PD-1与CTLA-4两个免疫检查点靶点的特性,可减少肿瘤细胞对相关免疫抑制通路的激活并增强T细胞介导的免疫应答。临床研究证实了卡度尼利的“抗PD-1联合抗CTLA-4”的协同抗肿瘤效应,结合良好的安全特性,卡度尼利有望开启肿瘤免疫治疗的2.0时代。

COMPASSION-03(AK104-201)研究评估了卡度尼利单药治疗晚期实体瘤和联合化疗治疗晚期不可切除或转移性胃或胃食管结合部(G/GEJ)腺癌的疗效与安全性,是首个针对PD-1/CTLA-4双免疫检查点抑制剂治疗晚期实体瘤的多中心临床研究。
本次发表披露了240例接受卡度尼利单药治疗的患者数据,其中Ib期纳入83例晚期实体瘤患者(胃癌,宫颈癌、肝癌、食管癌、结直肠癌,非小细胞肺癌、肾癌等),Ⅱ期纳入157例患者分为3个队列:1)111例既往接受含铂化疗治疗失败的复发或转移性宫颈癌(CC)患者;2)24例既往接受不超过一线系统性治疗失败的晚期肝癌(HCC);3)22例既往接受不超过一线系统性治疗失败的晚期食管癌(ESCC)患者。
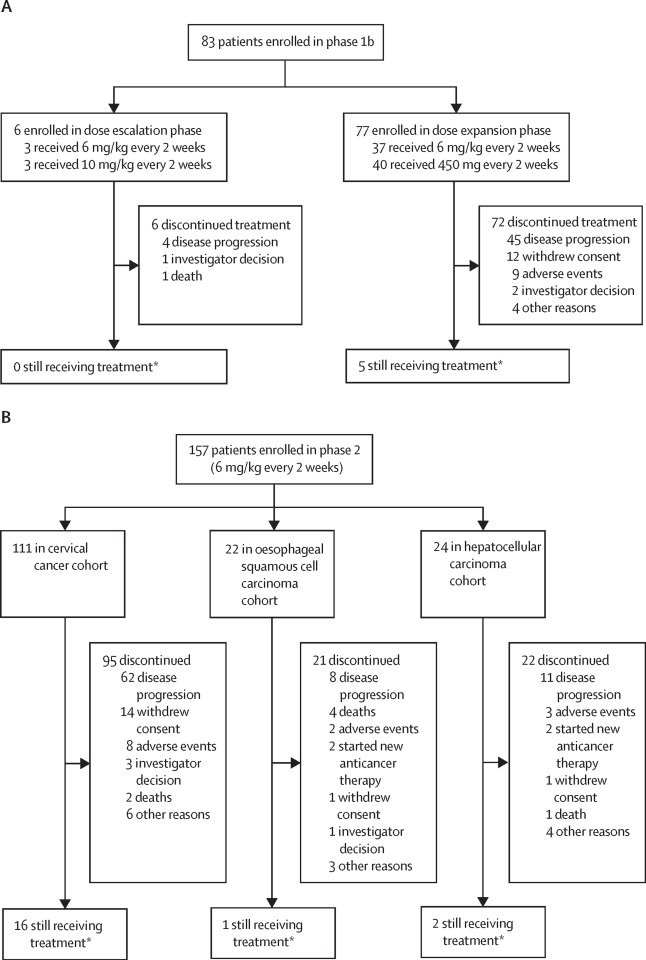
研究结果显示:
1. Ib期剂量递增阶段未发生剂量限制性毒性,卡度尼利整体安全性良好
3-4级治疗相关不良反应(TRAE)发生率为27.9%,最常见的≥3级TRAE包括贫血、食欲下降、中性粒细胞计数下降、输液相关反应等。
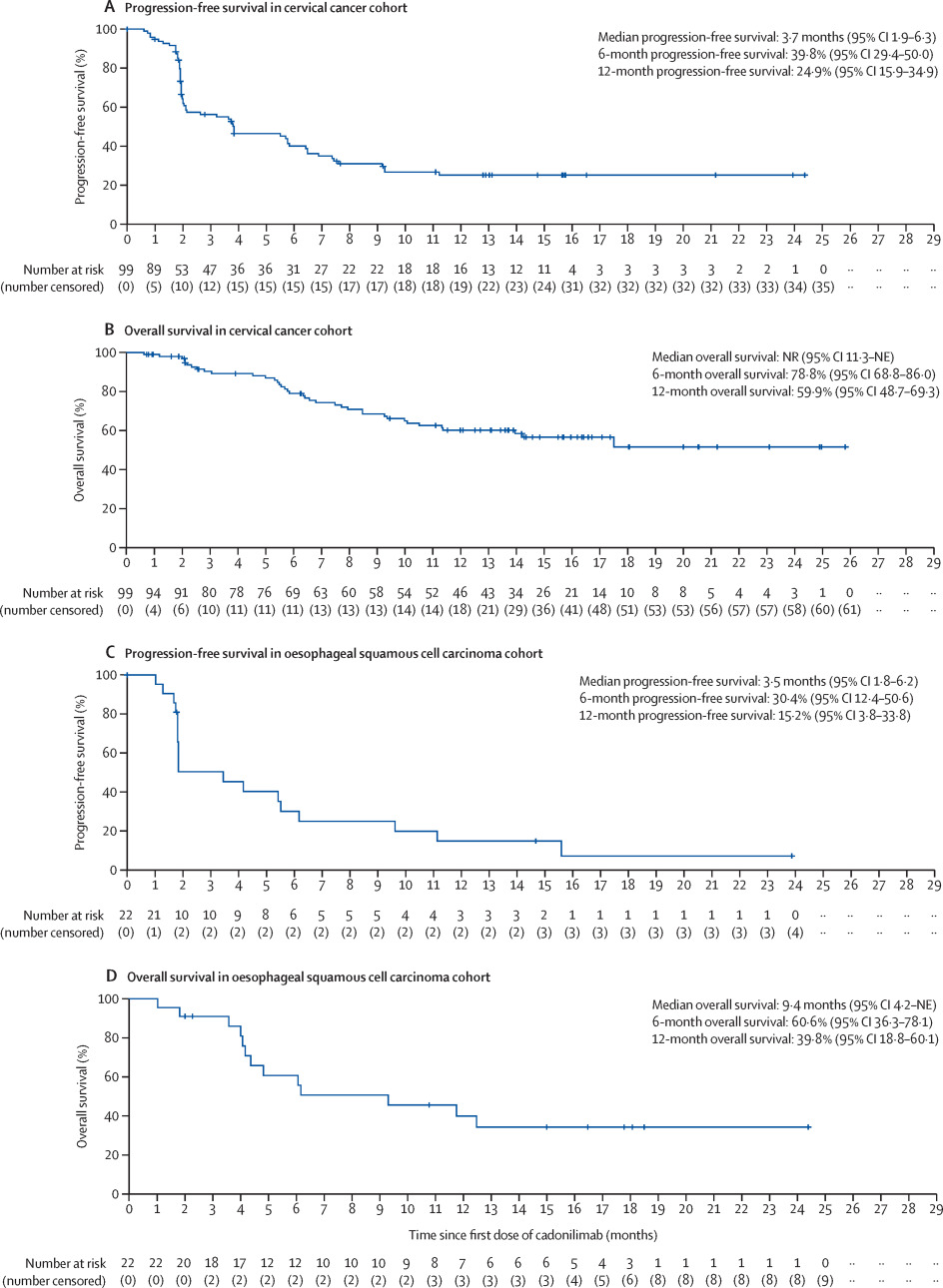
2. II期临床中卡度尼利单药的抗肿瘤活性令人鼓舞,长期生存获益显著
-
中位随访时间为14.6个月时,由独立影像评估委员会(IRRC)评估的卡度尼利单药治疗既往含铂化疗治疗失败的晚期CC患者,客观缓解率(ORR)为32.3%,14.1%(14例)达完全缓解(CR),18.2%(18例)达部分缓解(PR),中位OS尚未达到,18个月的OS率为51.2%。 -
中位随访时间为17.9个月时,卡度尼利单药治疗既往不超过一线系统性治疗失败的晚期ESCC患者,中位OS为9.4个月,6例患者删失在14个月以后。 -
中位随访时间为19.6个月时,卡度尼利单药治疗既往不超过一线系统性治疗失败的晚期HCC患者,中位OS尚未达到,18个月的OS率为56.7%。

卡度尼利在2022年6月被国家药品监督管理局附条件批注上市,用于在既往接受含铂化疗治疗失败的复发或转移性宫颈癌治疗,由此卡度尼利成为全球首个获批上市的双特异性肿瘤免疫治疗药物,也是中国首个获批上市的国产双特异性抗体,填补了全球肿瘤免疫治疗双特异性抗体药物以及我国晚期宫颈癌免疫治疗药物的空白。
原始出处:
u H, Bai L, Liu T, Li Y, Li Y, Fan Q, Feng M, Zhong H, Huang Y, Lou G, Wang J, Lin X, Chen Y, An R, Li C, Zhou Q, Huang X, Guo Z, Wang S, Li G, Fei J, Zhu L, Zhu H, Li X, Li F, Liao S, Min Q, Tang L, Shan F, Gong J, Gao Y, Zhou J, Lu Z, Li X, Li J, Ren H, Liu X, Yang H, Li W, Song W, Wang ZM, Li B, Xia M, Wu X, Ji J.Safety and antitumour activity of cadonilimab, an anti-PD-1/CTLA-4 bispecific antibody, for patients with advanced solid tumours (COMPASSION-03): a multicentre, open-label, phase 1b/2 trial.Lancet Oncol. 2023 Oct;24(10):1134-1146. doi: 10.1016/S1470-2045(23)00411-4
文稿摘选自:康方生物Akeso

